人源乳腺癌噬菌体抗体库的构建及初步筛选*
2010-02-10唐树彬李少林邹安娜
唐树彬,李少林,彭 杰,邹安娜,罗 弋
(1.四川省内江市第一人民医院肿瘤科 641000;2.重庆医科大学基础医学院核医学教研室 400016)
人源乳腺癌噬菌体抗体库的构建及初步筛选*
唐树彬1,李少林2△,彭 杰1,邹安娜1,罗 弋2
(1.四川省内江市第一人民医院肿瘤科 641000;2.重庆医科大学基础医学院核医学教研室 400016)
目的构建人源乳腺癌噬菌体单链抗体库,并筛选乳腺癌特异性单链抗体(Scfv)。方法利用乳腺癌患者癌旁淋巴组织来构建抗乳腺癌噬菌体抗体库。通过正常乳腺细胞(MCF-10F)和乳腺癌细胞(MCF-7)筛选富集后,用酶联免疫吸附试验(ELISA)法检测噬菌体抗体活性。结果成功的构建了1个4.2×107的噬菌体抗体库,并从该库中筛选到6株对乳腺癌细胞株MCF-7有结合活性的阳性克隆。结论从人源乳腺癌噬菌体抗体库中筛选到6株特异性噬菌体抗体,为下一步进行单链抗体的乳腺癌放射性核素显影及治疗奠定了基础。
乳腺癌;噬菌体抗体库;筛选;单链抗体
乳腺癌是女性常见的恶性肿瘤之一,全世界每年约有120万妇女发生乳腺癌,有50万妇女死于乳腺癌,发病率占全年各种恶性肿瘤的7%~10%[1]。我国乳腺癌的发病率虽较西方国家为低,但近年来亦有上升趋势。目前,以超声及X线等为主的乳腺癌诊断方法,对早期乳腺癌的诊断尚缺乏足够的准确性和特异性。而以手术、化疗和放疗及生物治疗为主的综合治疗又因不良反应太大而在临床应用中受到一定限制。因此,许多学者把目光投向了乳腺癌的抗体诊断及治疗。1985年Smith[2]提出了噬菌体展示技术概念;1992年Huse等[3]成功地构建第1个噬菌体组合文库,为肿瘤的诊断及治疗提供了一种全新的方法。但是,目前报道的抗乳腺癌噬菌体抗体库多为鼠源性,因人抗鼠免疫反应而不适合临床运用。本研究利用乳腺癌患者癌旁淋巴细胞来构建人源性抗乳腺癌抗体库,从而避免了人抗鼠免疫反应而适合于临床运用。
1 材料与方法
1.1 材料 RNA抽提试剂盒(RNA Kit)、质粒抽提试剂盒(Plasmid Kit)购自上海华舜生物工程有限公司。RT-PCR试剂盒(RNA PCR Kit)、SfiⅠ和 NotⅠ限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶为大连宝生物公司产品。噬菌粒载体pCANTAB5E、辅助噬菌体M13K07、大肠埃希菌E.coli TG1、鼠抗 M13噬菌体单克隆抗体(Anti-M13 Monoclonal Antibody)、辣根过氧标记的羊抗鼠抗克隆抗体(HRP/Anti-M13 Monoclonal Conjugate)均购自法玛西亚。正常乳腺细胞MCF-10F、乳腺癌细胞MCF-7为本实验室保存。引物参照Xu等[4]设计,由北京三博志远生物技术有限公司合成。
扩增 VH(重链可变区)基因的引物:5′-TGA GGA GAC GGT GAC CGT GGT CCC-3′;5′-CAG GTA CAG CTG CAG CAG TCA GG-3′。 扩增 VL(轻链可变区)基因 的引物:5′-ACG TT T GAT CTC CAC CT T GGT CCC-3′;5′-GAA ACG ACA CTC ACG CAG TCT CC-3′。VH连接Linker的引物:5′-AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC TGA GGA GAC GGT GAC CGT GGT CCC-3′;5′-TGA GGA GAC GGT GAC CGT GGT CCC-3′。 VL 连接 Linker 的引物:5′-GTT CAG GCG GAG GTG GCT CTG GCG GTG GCG GAT CGG ACA TCS WGA TGA C CC AGT CTC C-3′(S.W 为兼并引 物);5′-GAA ACG ACA CTC ACG CAG TCT CC-3′。Scfv(单链抗体可变区)扩增的引物(引物的带有SfiⅠ和NotⅠ内切酶位点):5′-GTC CTC GCA ACT GCG GCC CAG CCG GCC ATG GCC CAG GTA CAG CTG CAG CAG TCA GG-3′;5′-GAG TCA TTC TCG ACT TGC GGC CGC ACG T TT GAT CTC CAC CT T GGT CCC-3′。
1.2 方法
1.2.1 组织来源 将术中分离的乳腺癌患者癌旁淋巴结用无菌纱布包好后迅速放入液氮中冻存。共取14例患者癌旁淋巴结,其病理分型,见表1。
1.2.2 总RNA的提取 首先在盛有液氮的碾钵中迅速把淋巴组织碾成粉末,这样可以使组织脆硬同时防止 RNA破坏[5]。然后再利用RNA抽提试剂盒进行提取,得到总RNA。
1.2.3 VH和VL基因片段的扩增 首先,通过以Oligo dTAdaptor primer作为引物合成 cDNA,PCR条件:50℃ 30 min,99℃5 min,5℃5 min,1个循环。然后以cDNA为模板,以上下游引物配对分别扩增轻链基因片段和重链基因片段,PCR条件:94℃2 min,1个循环;94℃30 s,55℃30 s,72℃90 s,30个循环。最后利用Linker引物分别扩增VH-Linker基因片段和VL-Linker基因片段,PCR条件:94℃2 min,1个循环;94℃30 s,60℃30 s,72℃90 s,35个循环。得到VH-Linker基因片段和 VL-Linker基因片段。

表1 患者的病理分型(n)
1.2.4 Scfv基因片段的连接及PCR扩增 通过重叠-延伸-拼接PCR(SOE-PCR)形成单链抗体(Scfv)基因片段。先将胶回收纯化的VH-Linker基因片段和VL-Linker基因片段进行连接,反应条件为:94℃5 min,1个循环;94℃1 min,60℃1 min,72℃90 s,5个循环。从而将VH基因片段和VL基因片段连接形成Scfv基因片段。然后再向反应体系中加入Scfv扩增的引物(带有酶切位点),反应条件为:94℃30 s,60℃60 s,72℃90 s,5个循环。形成两端分别带有酶切位点的Scfv基因片段。
1.2.5 重组质粒的构建 用T4 DNA连接酶连接经SfiⅠ和NotⅠ双酶切Scfv基因片段和 PCANTAB-5E载体,用电穿孔法转化TG1感受态细菌制备参照文献[6],将转化后的感受态细菌TG1铺于氨苄青霉素选择培养基上,培养过夜,计算克隆数。随机挑取32个转化后TG1菌落,分别加入到2-YT培养液中振荡培养过夜,提取质粒,用PCR检查DNA中有无Scfv基因插入。
1.2.6 抗体库的构建 将阳性细菌克隆铺于SOBAG平板上37℃培养过夜,再加入10 mL 2-YT培养液收聚菌液。用2-YT培养液稀释至A600=0.3。加入氨苄青霉素,终浓度为100 μ g/mL,葡萄糖的终浓度为2%。37℃ 150 r/min振荡培养1 h,再加入 5.1×1010puf的M13K07至终浓度为4×109,37℃250 r/min振荡培养 1 h。4 000 g离心20 min,弃上清液。沉淀重悬于100 mL-YTAK培养液,30℃250 r/min振荡培养过夜。10 000 g离心10 min沉淀细菌,取上清液加入1/5的PEG/NaCl,冰浴60 min。10 000 g 4℃离心20 min,弃上清液。沉淀重悬于1 mL 2-YT培养液,10 000 g再次离心10 min,上清液中加入终浓度为0.02%的叠氮钠,4℃保存。
1.2.7 噬菌体的筛选 取107正常乳腺细胞(MCF-10F),用2%的脱脂牛奶/磷酸盐缓冲液(PBS)冰浴1 h,4℃250 r/min离心5 min,弃上清液。用1 mL Scfv噬菌体抗体库溶液重悬细胞,室温缓摇1 h,4℃250 r/min离心5 min,取上清液。在上清液中加入107MCF-7细胞,室温缓摇1 h,4℃250 r/min离心5 min,弃上清液。加入1 mLPBS洗涤细胞(第1轮洗涤3次,第2轮洗涤 5次,第3轮洗涤 8次,以后洗涤 10次),4℃200 r/min离心5 min,弃上清液。用1 mL 0.2%的 HCL-甘氨酸(pH=2.2)重悬细胞,冰浴 10 min,用 1 mol/L的 Tris碱(pH=9.1)中和,4℃200 r/min离心5 min。上清液即为第1轮筛选到的噬菌体,取少许感染生长对数期的TG1细胞 3 mL,铺SOBAG平板,计数重组噬菌体量。其余噬菌体重新进行第2轮筛选,共重复5次筛选。
1.2.8 细胞ELISA鉴定Scfv的特异性 从第5轮筛选后SOBAG平板上挑取40个单菌落,制备噬菌体单链抗体,分别以MCF-7细胞和MCF-10F细胞作为靶抗原做ELISA检测,检测方法参照文献[7]。将细胞用0.25%的戊二醛固定于96孔培养板中,以2%脱脂奶粉37℃封闭1 h,将上述单克隆噬菌体Scfv各100 μ L与等体积的2%脱脂奶粉混合,室温静置20 min,加入到平板中,以0.05%Tween20-PBS洗涤 6次。加入鼠抗M13噬菌体单克隆抗体为二抗,辣根过氧化物酶标记羊抗鼠抗体为三抗,以 TM B为底物显色,450波长酶标仪读板。
2 结 果
2.1 总 RNA的鉴定 从淋巴组织中提取总 RNA后,经1.5%的琼脂糖凝胶电泳鉴定。电泳可见明显的8 s和28 s两条带,见图1。

图1 RNA
2.2 VH基因片段和VL基因片段的鉴定 VH和V L基因扩增后,经1.5%琼脂糖凝胶电泳鉴定。结果提示VH基因片段在360 bp,VL基因片段在300 bp,见图 2。

图2 轻重链
2.3 Scfv基因片段的鉴定 VH-Linker基因和VL-Linker基因连接后,利用含有SfiⅠ和NotⅠ酶切位点的引物进行PCR扩增。得到含有酶切位点的Scfv基因。利用1.5%的琼脂糖凝胶电泳,结果提示 Scfv基因在750 bp左右,见图3。
2.4 质粒DNA的PCR检测 从SOBAG平板上随机挑选32个单菌落加入3 mL 2-YT培养液中振荡培养过夜,取1.5 mL提取质粒。质粒PCR鉴定提示Scfv基因插入率为81%(26/32),见图 4。

图3 单链

图4 质粒PCR
2.5 质粒DNA的酶切鉴定 将PCR阳性的质粒用SfiⅠ和NotⅠ双酶切,用1%的琼脂糖凝胶电泳后可见在750 bp及4 500 bp处见条带,见图5。
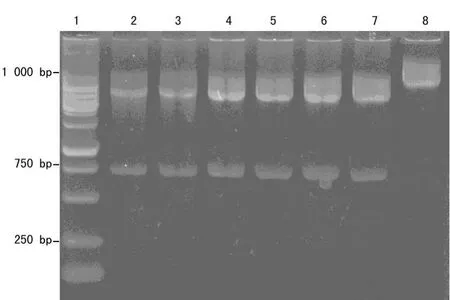
图5 双酶切图片
2.6 噬菌体单链抗体库的筛选 先以ER阴性的正常乳腺细胞MCF-10F对噬菌体抗体库进行负性筛选,再以ER阳性的人乳腺癌细胞MCF-7对噬菌体Scfv库进行了5轮“吸附-洗脱-扩增”的富集筛选。得到1个4.2×107的噬菌体抗体库,说明特异性的Scfv得到了有效富集,见表2。
2.7 噬菌体Scfv的ELISA鉴定 以MCF-7和M CF-10F为靶抗原进行ELISA检测,其中有6个噬菌体Scfv与MCF-7细胞反应的P/N值大于MCF-10F的两倍以上,见图6。
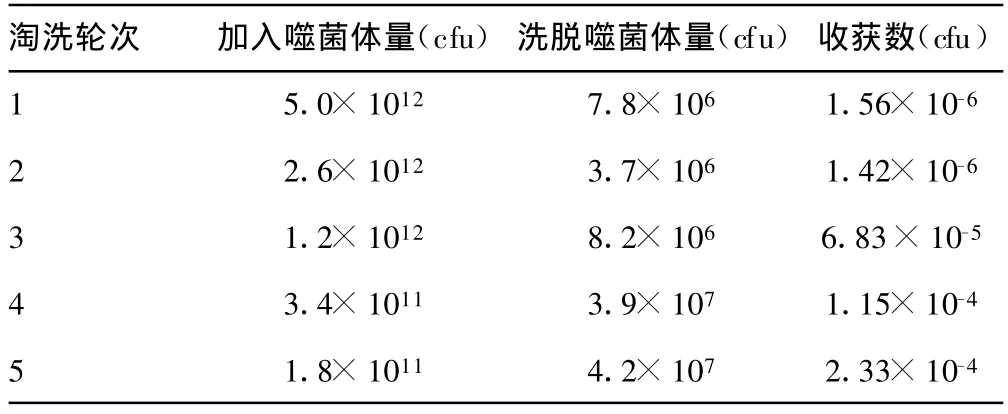
表2 噬菌体抗体库的筛选

图6 ELISA检测噬菌体抗体与MCF-7和MCF-10F细胞的结合活性
3 讨 论
噬菌体库技术是近20年发展起来的一种制备抗体的新技术,噬菌体单链抗体具有分子量小,组织穿透性强,在靶抗原部位浓聚快等优点[7-8],在肿瘤的诊断及治疗中有很强的应用价值。但是,目前文献报道的是噬菌体单链抗体多为鼠源性的抗体,这些抗体因为人抗鼠免疫反应而不适合于临床运用。
本实验直接从乳腺癌患者癌旁淋巴组织中提取总RNA,通过逆转录PCR和SOE-PCR合成单链抗体基因,再利用噬菌体展示技术构建了1个4.2×107的人源乳腺癌噬菌体单链抗体库。实验中,本研究选择的患者癌旁淋巴组织来构建的噬菌体抗体库比用患者外周血淋巴细胞构建的噬菌体抗体库更易筛选到高亲和力的抗体[9]。淋巴转移是乳腺癌最常见的转移方式,本研究选择乳腺癌患者癌旁淋巴组织来构建抗乳腺癌单链抗体基因有助于提高单链抗体的敏感性和特异性。同时,本研究选择病理类型不同及Her2/neu阳性与否的乳腺癌患者,增加了抗乳腺癌单链抗体基因的多样性,有利于构建较大的抗乳腺癌噬菌体单链抗体库。
在筛选过程中本研究采用先低后高的洗涤力度,低洗涤力度保证低丰度的噬菌体抗体不丢失,高洗涤力度则有利于得到高亲和力的噬菌体抗体[10]。此外,本研究选择正常乳腺细胞和乳腺癌细胞做正负差异性筛选。先用ER阴性的MCF-10F细胞进行负性筛选,既清除了大量的非特异噬菌体,同时又有效地保护了抗ER的噬菌体。然后再利用ER阳性的MCF-7细胞进行选择,从而有效地提高了选择效率,得到6株高亲和力噬菌体抗体。
本实验成功地构建了人源乳腺癌噬菌体单链抗体库,通过5轮的“吸附-洗脱-扩增”筛选到6株高亲和力噬菌体单链抗体,为本研究下一步进行单链抗体的放射性核素显影及治疗奠定了基础。
[1] 李少林,陈小品,吴凯南.乳腺癌的生物学特性和临床对策[M].北京:科学出版社,2004:65.
[2] Smith GP.Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J].Science,1985,2289(4705):1315.
[3] Huse WD,Sastry L,Iverson SA,et al.Generation of a large combinatorial library of the immunoglobulin repertoire in phage lambda.1989[J].Biotechnology,1992,24:517.
[4] Xu M Y,Xu XH,Chen GZ,et al.Production of a human single-chain variable fragment antibody against esophageal carcinoma[J].World J Gastroenterol,2004,10(18):2619.
[5] 何映谊,何新荣,叶铁真.人类胚胎组织完整RNA的分离[J].中国实验血液学杂志,2005,13(6):1058.
[6] Cummings PJ,Hooper NE,Rocolanel SS.Generation of a recombinant bacteriophage antibody library to mycobacterium luberculosis[J].Hybridoma,1998,17(2):151.
[7] 杨清浩,王祥卫,金燕,等.噬菌体展示肽表位的免疫原性研究[J].重庆医学,2005,34(10):1480.
[8] Yokota T,Milenic DE,Whidow M,et al.Rapid tumor penetration of a single-chain Fv and comparison with other immunoglobulin forms[J].Cancer Res,1992,52(12):3402.
[9] Saerens D,Kinne J,Bosmans E,et al.Single domain antibodies derived from dromedary lymph node and peripheral blood lymphocytes sensing conformational variants of prostate-specific antigen[J].J Biol Chem,2004,279(50):51965.
[10]张青,郝晓柯,苏明权,等.噬菌体抗体库筛选方法的研究进展[J].中国肿瘤生物治疗杂志,2005,12(3):222.
Constructing humanize phage antibody library and screening antibody binding to breast cancer*
TANGShu-bin1,LI Shao-lin2△,PENG Jie1,et al.
(1.Department of Oncology,First People′s Hospital of Neijiang,Neijiang,Sichuan641000,China;2.Department of Nuclear Medicine,College of Basic Medicine,Chongqing Medical University,Chongqing400016,China)
ObjectiveTo construct humanize phage antibody library against breast cancer and to screen specificity Scfv to breast cancer.MethodsTo construct phage library from tumor adjacent lymphatic tissue of breast cancer patients.After screening and amplifying by normal lacteal gland cell(MCF-10F)and breast cancer cell(MCF-7),the binding activity of antibody was detected by ELISA.ResultsA phage antibody of 4.2×107was obtained and six active clones against breast cancer cell MCF-7 were gained from the Scfv library.ConclusionSix antibody binding to breast cancer cell more strongly were identified from humanize phage antibody library.This work provides us the basis for radionuclide imaging and therapy for breast cancer.
breast cancer;phage antibody library;screening;Scfv
R737.9;R730.44
A
1671-8348(2010)05-0516-03
国家自然科学基金资助项目(30370422)。△
,电话:(023)68485007。
2009-07-21
2009-09-10)
◦论 著◦
