从放线菌发酵液中高通量筛选端粒酶抑制剂
2010-02-10张慧敏王卫国李波兰沈会芳林壁润庞建新吴曙光
张慧敏,曹 莹,王卫国,李波兰,沈会芳,林壁润,庞建新,吴曙光
(1.南方医科大学药学院新药评价中心,广东广州 510515; 2.珠江医院药材科,广东广州 510280;3.广东省农科院植物保护所,广东广州 510640)
以端粒酶为靶点筛选端粒酶抑制剂是近年来寻找抗肿瘤新药的重要途径之一[1]。端粒酶有活性的最小组成单位是端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)和起模板作用的端粒酶RNA(human telomerase RNA,hTR),体外只要重组这两部分就能重构端粒酶活性[2]。hTR-hTERT结合是可逆的,容易受抑制剂的影响。因此,如果筛选模型是针对hTR-hTERT的结合,就能提高筛选的特异性。根据以上理论,本实验采用了基于酵母三杂交原理[3]的端粒酶抑制剂筛选模型。该模型是将端粒酶主要成分即hTERT和hTR的易结合片断导入酵母菌L40 ura3/pHybLex/Zeo-MS2,通过在96孔板缺陷培养基上培养酵母[4],根据酵母菌的生长状态,高通量筛选抑制hTR与hTERT特异结合的抑制剂。
1 材料与方法
1.1 菌株 L40 ura3/pHybLex/Zeo-MS2由南华大学何淑雅教授惠赠;L40 ura3/pHybLex/Zeo-MS2/ hTR126-451/hTERT292-608aa、L40ura3/pHybLex/ Zeo-MS2/hTR240-450/hTERT292-608aa、L40ura3/ pHybLex/Zeo-MS2/hTR(m)/hTERT292-952aa[5]为本实验室构建好的酵母三杂交系统。
1.2 试剂和仪器 2 000多株放线菌发酵液由广东省农科院植保所提供;DNA聚合酶、dNTPS购自TaKaRa公司;YPD酵母培养基、YC-UHW酵母培养基[6]、PCR仪为美国AppLied Biosystems公司产品;多功能酶标仪Bench mark pLus,水平电泳槽及电泳仪购自为美国Bio-Rad公司;96孔细胞板购于美国Corning Costor公司。
1.3 酵母菌液PCR验证筛选系统 参照GenBank hTR和hTERT序列,采用引物设计软件设计5对引物如Tab 1所示,引物由英骏生物技术有限公司合成,用去离子水配制成20 μmol·L-1。挑取3种菌株的单克隆菌于YC-UHW中培养,然后用煮沸冷冻法[7]提取基因组。分别取以上3种上清1 μl于3个PCR管内,反应体系为50 μl,扩增hTR126-451、hTR240-450、hTRm,循环参数为95℃预变性5 min,95℃30 s,退火30 s(退火温度依引物而定),72℃延伸30 s,30次循环,72℃延伸5 min。再分别取3种上清1μl于3个PCR管内,反应体系为50μl,扩增hTERT292-952、hTERT292-952,循环参数为95℃预变性5 min,95℃ 30 s,60℃退火1 min,72℃延伸2 min,30次循环,72℃延伸5 min。反应扩增产物琼脂糖凝胶电泳鉴定。
1.4 放线菌发酵液样品库 2 000多株不同编号的放线菌样品(经发酵的米饭)0.3 g置于5 ml贴有标签的青霉素瓶内,用体积分数为0.5的乙醇3 ml浸泡,在室温下经摇床振荡24 h后过滤,收集滤过液置于贴有相同标签的青霉素瓶内,4℃冰箱保存备用。
1.5 确定合适的筛选条件 分别挑取3种菌株的单菌落,于YC-UHW培养液中30℃,250 r·min-1振摇培养13 h,测其OD595nm,并用新鲜培养液调节OD值为0.1、0.08、0.04、0.02。将以上菌液每种每孔200 μl加入96孔板的第1、2两列的12个孔,并在第3、4两列设副孔,25℃,250 r·min-1振摇封闭培养,每12 h测量记录OD值,直至其生长出现平台期为止,绘制酵母生长曲线图。通过该生长曲线确定此筛选条件下的最佳筛选起始浓度。

Tab 1 Pimers of PCR
分别将3种OD595nm为0.04的酵母菌液190 μl加入96孔板,相应孔加入相应剂量的无菌水和体积分数为0.5的乙醇,使得乙醇最终体积分数分别为0、0.05、0.10、0.15,总剂量200 μl,然后置于摇床中,25℃,250 r·min-1振摇培养,于12、24、36、48 h测量记录OD值并绘制酵母生长曲线,通过生长曲线选择合适的乙醇浓度(即样品的剂量)。
1.6 高通量放线菌发酵液筛选 首先进行酵母菌株L40 ura3/pHybLex/Zeo-MS2/hTR126-451/hTERT 292-608 aa的筛选。选择OD595nm为0.04的酵母菌液进行筛选。
实验中,96孔板1~11列用来检测样品,每孔含10 μl样品和190 μl菌液,第12列上面4孔作溶剂对照,即每孔10 μl体积分数为0.5的乙醇和190 μl菌液;中间2孔作空白对照,每孔10 μl无菌蒸馏水和190 μl菌液;最后2孔做负对照,每孔10 μl无菌蒸馏水和190 μl YC-UHW培养液。加液后于25℃,250 r·min-1振摇培养,分别于每隔12 h测量记录OD595nm值。所有药物样品测试完毕后,再分别以L40 ura 3/pH ybLex/Zeo-MS2/hTR 240-450/hTERT 292-608 aa、L40 ura 3/pH ybLex/Zeo-MS2/hTR (m)/hTERT 292-952 aa筛选,操作程序同上。
1.7 菌液抑制率的计算 抑制率/%=(溶剂对照孔OD595nm-样品孔OD595nm)/(溶剂对照孔 OD595nm-空白对照孔OD595nm)×100%
1.8 复筛 经初筛计算抑菌效率后,对所有抑菌效率达0.45以上的高活性放线菌发酵液样品进行复筛。复筛中我们设立了菌株对照板,以L40 ura3/ pHybLex/Zeo-MS2(用YPD酵母培养液培养)为对照。筛选起始菌液浓度,药物样品剂量以及程序同初筛。
2 结果
2.1 酵母菌液PCR结果电泳图 酵母菌液PCR,反应扩增产物用1.5%(Fig 1A)、0.8%(Fig 1B)琼脂糖凝胶电泳鉴定,均为正确的片段。

Fig 1 Electrophoresis of the three yeast PCR products
2.2 酵母菌生长曲线 实验结果表明当酵母菌起始OD595nm为0.04是合适的酵母菌筛选起始浓度,其生长曲线见Fig 2A。在酵母菌液起始OD595nm为0.04时,乙醇体积分数为0.25时对酵母菌生长影响很小,其生长曲线见Fig 2B。
2.3 初筛结果 通过对2 000多株放线菌发酵液筛选,本实验共筛出27株抑制率大于0.45的样品,如Tab 2所示,可用于下一步复筛。
2.4 复筛结果 对27株放线菌发酵液进行复筛,筛出14株阳性样品如Tab 3所示。
3 讨论
端粒酶是广谱肿瘤标志物之一,以端粒酶为靶标,建立肿瘤抑制剂筛选模型,寻找抗肿瘤新药,已成为探索癌症治疗的新途径[9]。但目前用于端粒酶抑制剂的筛选模型都是基于检测端粒酶活性的TRAP法。该方法步骤繁琐,成本高且特异性不强,不能用于RNA酶含量较高微生物代谢产物的筛选。而基于酵母三杂交系统的端粒酶抑制剂筛选模型克服了以上问题,在此系统中,hTERT和hTR的结合是已知的,当存在抑制两者结合的因素时,酵母菌在酵母缺陷培养基上生长受抑制。因此只需通过培养酵母菌,观察其生长状态,就可进行端粒酶抑制剂的筛选。

Tab 2 The active samples and corresp inhibition rate in primary screening
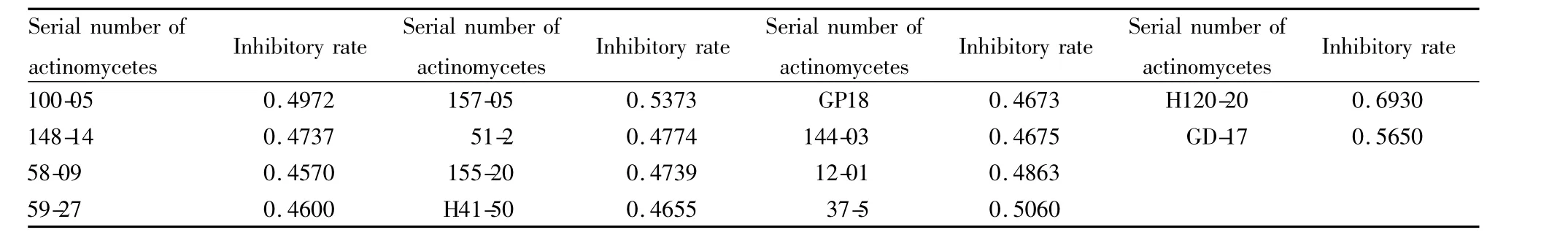
Tab 3 The active samples and corresp inhibition rate in secondary screening
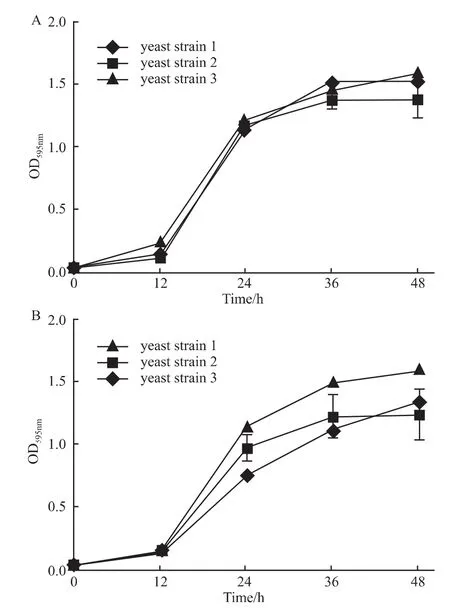
Fig 2 Growth curve of yeast strains
抑制剂的筛选,理论上只要能抑制hTERT和hTR的正确结合,就能抑制端粒酶活性,因此特异的抑制剂可能只抑制hTERT和hTR的其中一个结合部位,因此,为提高筛选模型的灵敏性和特异性,本实验选择了导入不同hTERT和hTR易结合结构片段的筛选模型,利用不同有效部位之间的相互作用来建立特异的酵母端粒酶抑制剂筛选模型。
由于放线菌发酵物的理化成分是未知的,为防止其有效成份不能完全溶出,本实验使用0.5的乙醇作为代谢产物的溶出液。但是乙醇可以使蛋白类物质失活且对酵母菌的生长有较强的抑制作用,影响实验的操作及结果,对此本实验需寻找对酵母生长影响较小的乙醇浓度,以避免出现假阳性的结果。
酵母菌细胞壁厚,通透性差,实验中需要延长培养时间以促进药物进入细胞,而培养时间长,菌液起始培养浓度低,容易污染,因此,本实验中采取酵母菌培养液添加氨苄青霉素(0.5 g·L-1),96孔板[10]封板培养等措施以避免菌液污染。
本实验采用3种模型分别对2 000多株放线菌发酵液进行筛选,筛选模型菌在96孔板中培养48 h,每隔12 h测量并计算抑菌率,因此每个样品对应12个抑菌率,将其中任一抑菌率大于0.45的放线菌发酵液视为阳性样品,并取最高抑制率作为该样品抑制率。初筛从样品库中筛选出的27株阳性样品,其中编号为100-05、148-14、51-27、133-05、144-03、GD17、59-27的样品为酵母菌 L40 ura3/pHybLex/Zeo-MS2/hTR126-451//hTERT292-608aa筛选而得;编号为51-27、144-03、160-11、51-2、155-20、37-7、157-05、37-5、51-10、58-09、H41-50、11-11、73-8样品为酵母菌 L40 ura3/pHybLex/Zeo-MS2/hTR240-450/hTERT292-608aa筛选而得,40-08、GD17、GD-17、179-02样品为酵母菌 L40 ura3/pHybLex/Zeo-MS2/hTR(m)/hTERT292-952aa筛选而得;而编号为72-5、47-12、H120-20、H102-4、GD18、12-01这6个样品则对3种酵母菌筛选模型抑制剂率大于0.45。若一个样品对两个或三个模型抑制率均大于0.45时,总的抑制率取其平均值。复筛设立了阴性酵母菌对照,对初筛筛出的27株放线菌发酵液进行再筛,筛出14种阳性放线菌发酵液。初筛和复筛结果基本吻合,说明了本筛选模型和筛选方法的可靠性及有效性。
[1] Fletcher T M.Telomerase:a potential therapeutic target for cancer[J].Expert Opin Ther Targets,2005,9(3):457-69.
[2] Bachand F,Autexier C.Functional regions of human telomerase reverse transcriptase and human telomerase RNA required for telomerase activity and RNA-protein interactions[J].Mol Cell Biol,2001,21:1888-97.
[3] Hook B,Bernstein D,Zhang B,et al.RNA-protein interactions in the yeast three-hybrid system:affinity,sensitivity,and enhanced library screening[J].RNA,2005,11(2):227-33.
[4] Young K,Lin S,Sun L,et al.Identification of a calcium channel modulator using a high throughput yeast two-hybrid screen[J].Nat Biotechnol,1998,16(10):946-50.
[5] 曹 莹,王卫国,李 琳,等.人端粒酶RNA突变体酵母三杂交诱饵质粒的构建[J].南方医科大学学报,2009,29(4):652-5.
[5] Cao Y,Wang W G,Li L,et al.Construction of a bait plasmid containing human telomerase RNA mutant in yeast three-hybrid system[J].J South Med Univ,2009,29(4):652-5.
[6] 亚当斯A,特施林D E.酵母遗传学方法实验指南[M].刘子铎译.北京:科学出版社,2000:109.
[6] Adams A,Sheeran D E.Guide to yeast genetics experiment[M]. Translated by Liu ZY.Beijing:Science Press,2000:109.
[7] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].北京:科学出版社,2002:1109-12.
[7] Sambrook J,Russell D W.Molecular Cloning A laboratory manual[M].Beijing:Science Press,2002:1109-12.
[8] Simple and reliable procedure for PCR amplification of genomic DNA from yeast cells using short sequencing primers[J].Biochen Mol Biol Int,1997,42(1):169-72.
[9] Greider C W,Blackburn E H.Telomeres Telomere and cancer[J]. Sci Am,1996,2:274(2):92-7.
[10]张 辉,喻莉萍,方 芳,方云祥.Edelfosine抑制S.pombe细胞分裂作用机制的研究[J].中国药理学通报,2007,3(23):374-9.
[10]Zhang H,Yu L P,Fang F,Fang Y X.Study of the inhibition mechanism of edelfosine on cytokinesis in Schizosaccharomyces pombe[J].Chin Pharmacol Bull,2007,3(23):374-9.
