雌激素通过调节MSC分泌细胞因子影响其对DC成熟与功能的抑制①
2010-02-06赵叶琳赵晓寅孙凌云侯亚义南京大学医学院免疫与生殖生物学实验室南京210093
赵叶琳 赵晓寅 孙凌云 侯亚义 (南京大学医学院免疫与生殖生物学实验室,南京 210093)
雌激素通过调节MSC分泌细胞因子影响其对DC成熟与功能的抑制①
赵叶琳 赵晓寅 孙凌云②侯亚义 (南京大学医学院免疫与生殖生物学实验室,南京 210093)
目的:本研究试图检测不同浓度17β-雌二醇(E2)存在的情况下人胎肺间充质干细胞(MSC)增殖和表型的变化,并分析这种状态的MSC对树突状细胞(DC)成熟和功能影响及其可能的机制。方法:分离培养人胎肺MSC,加入不同浓度E2,在24小时后对MSC进行细胞计数、测定其增殖和贴壁能力,并用流式细胞仪分析MSC表面标志,RT-PCR测定MSC中细胞因子(IL-6、TGF-β和VEGF)mRNA的表达情况。进一步探讨了E2处理24小时后的MSC对DC成熟和功能的影响。结果:分离得到的MSC纯度达到95%以上;E2影响MSC的增殖和贴壁能力,但不影响MSC表面标记的表达;MSC与DC共培养后DC表面CD86、MHCⅡ和CD80的表达均有所降低,而当DC与经E2预处理过的MSC共培后,DC表面MHCⅡ、CD80和CD86的表达回升;高浓度E2作用MSC 24小时后,MSC表达的TGF-β与对照组相比减少,而 IL-6和VEGF与对照组相比增加。结论:E2可能通过调节MSC分泌细胞因子的水平,改变MSC对DC的免疫抑制作用。
雌激素;间充质干细胞;树突状细胞;系统性红斑狼疮
雌激素与许多自身免疫性疾病的发生与发展有关,比如系统性红斑狼疮(SLE)的发病表现出明显的女性优势,尤其易发于育龄女性,并在妊娠末期,女性体内雌激素达到峰值时,病情严重恶化[1]。树突状细胞(DC)是最重要的专职抗原递呈细胞,在免疫应答的发生和外周免疫耐受的维持等方面发挥着重要的作用。许多证据表明,DC参与自身免疫性疾病的病理发生[2],在系统性红斑狼疮(SLE)患者中,DC递呈自身dsDNA,激活T细胞[3]。间充质干细胞(MSC)表型为 CD29、CD44和 CD105阳性,CD31、CD45和CD117阴性,具有多向分化、造血支持及免疫调节作用[4]。许多证据表明,MSC可抑制T淋巴细胞、B淋巴细胞、DC和自然杀伤(NK)细胞的功能[5-9]。我们前期的研究发现,正常人间充质干细胞(hMSC)移植到狼疮模型(MRL)小鼠中后,能改善MRL小鼠的肾脏病变,并减少MRL鼠肾脏中TGF-β和VEGF的表达以及C3免疫复合物的沉积;正常人MSC移植到SLE患者体内也能缓解其病情[10,11]。一些研究表明,MSC能通过对DC成熟状态的影响而发挥免疫调节作用,并通过影响DC的分化格局,间接的导致T细胞的分化无能或者抑制Th1细胞方向的分化和促进Th2方向的分化[5,6,12,13]。可是,在体内MSC与DC所处的微环境十分复杂,MSC对DC的作用受各种因素影响,在SLE发病过程中患者外周血中E2浓度明显高于正常人。虽然有研究显示E2能促进MSC的增殖,并能促进MSC对局部缺血后的心肌修复[14,15]。但是在E2的存在下,MSC还会发生怎样的改变呢?E2作用下的MSC对DC的抑制能力如何呢?关于这方面还未有报道。因此,本研究试图检测不同浓度E2存在的情况下MSC增殖和表型的变化,并分析这种状态的MSC对DC成熟和功能影响及其可能的机制。
1 材料与方法
1.1 材料 水囊引产的12~18周胎儿,获自于南京大学医学院附属鼓楼医院。所用材料均严格遵守医学伦理道德,经产妇及家属认可,并经医院医学伦理委员会批准。6~8周C57BL/6雌性小鼠,均购于江苏省扬州大学。所有动物饲养在24℃,12小时亮/暗光照周期的湿度控制设施中,并让其自由摄取水和食物。细胞培养板和细胞培养瓶(Costar公司);DMEM/F12培养基和优级胎牛血清(Gibco公司);小鼠抗 人 PE-CD117、PE-CD44、PE-CD29、FITC-CD31、FITC-CD45和APC-CD105单克隆抗体(ebioscience公司);rmGM-CSF、rm IL-4(biosource公司);新生小牛血清(四季青);兔抗小鼠PE-CD11c、Alexa Flour-CD11c、FITC-CD80、FITC-CD86和 APC-MHCⅡ单克隆抗体(ebioscience公司);17β-雌二醇(E2,Sigma公司)。
1.2 人胎儿肺脏来源的间充质细胞分离及纯化间充质细胞分离及纯化参照我们前期的研究方法[16]。即取水囊引产的胎儿,在无菌状态下打开胸腔,取肺脏放入平皿中,用 PBS洗 3次,尽量除去血细胞。在基本培养基(DMEM/F12+10%FBS)中,将肺脏组织剪成碎块,加2 g/L的胶原酶VI,37℃振荡消化15~25分钟,过200目筛网,获得细胞悬浮液。然后用基本培养基洗3次,培养于DMEM/F12完全培养基中(10%FBS)。调整细胞密度为1×109L-1培养于CO2培养箱中培养(37℃恒温,5%CO2),2~3天后,轻轻晃动培养板,全量换液,待细胞铺满度达80%左右,用2.5 g/L的胰酶消化,常规传代。取第4代到第7代的细胞,分析其表面标志,确定其为MSC后用于试验。
1.3 小鼠DC的分离培养与鉴定 DC的分离及纯化参照我们前期的研究方法[17],6~8周龄雌性C57BL/6小鼠,拉颈处死,无菌状态取出股骨和胫骨,反复冲洗骨髓,加入红细胞裂解液室温5分钟,去除红细胞,2×106m l-1细胞培养于RMPI1640完全培养基(10%FCS,1 ng/m l IL-4和10 ng/m l GMCSF),隔天半换液,诱导7天后,获得DC。然后与MSC在RMPI1640完全培养基体系下共培养,在LPS刺激后培养24小时后进行检测。
1.4 增殖贴壁 MSC铺板后2小时加入10μl不同浓度E2(E2溶于无水乙醇配成10-2mol/L贮存液,PBS稀释至10-7、10-6和10-5mol/L作为工作液,使用时加入10μl工作液至1m l培养基中,使终浓度分别为:低 、中 、高:10-9、10-8和 10-7mol/L),对照组加入10μl用PBS同样倍比稀释的无水乙醇,24小时后测定MSC各项功能或与DC进行共培养,后续实验皆采用同样处理方式。E2处理MSC 24小时后,将细胞消化重悬计数,再重铺板,2小时后计数未贴壁细胞。
1.5 RT-PCR测定细胞因子mRNA的表达 用Trizol试剂提取细胞中总的RNA,按照逆转录试剂盒的操作步骤进行逆转录,得到cDNA,反应条件:42℃20分钟,99℃5分钟,4℃5分钟。PCR扩增试剂盒采用PCR扩增试剂盒(上海生工),反应体系25μl,引物序列 :内参对照β-actin:上游 5′-AAATCGTGCGTGACATTAA-3′,下游 5′-CTCGTCATACTCCTGCTTG-3′;IL-6:上游 5′-GACTGATGTTGTTGACAGCCACTGC-3′,下游5′-AGCCACTCCTTCTGTGACTCTAACT-3′;TGF-β :上游5′-CAACAATTCCTGGCGATACCTCA-3′,下游5′-ATCCACTTCCAGCCGAGGTCCTT-3′;VEGF:上游5′-AAGCCATCCTGTGTGCCCCTGATG-3′,下 游5′-GCGAATTCCTCCTGCCCGGCTCA-3′(英骏公司合成);反应条件:94℃2分钟,94℃45秒,55℃45秒,72℃45秒,72℃6分钟,30个循环。用1.5%的琼脂糖作凝胶电泳后,经凝胶成像系统进行拍照分析。每次实验中的同组细胞重复3次。
1.6 流式细胞仪测定细胞表面标志 消化收集细胞,PBS洗涤两次,调整细胞密度约1×109L-1。加入相应抗体,4℃避光孵育30分钟,PBS洗涤两次后上机检测。MSC 检测标志为:CD117、CD29、CD31、CD44、CD105及CD45;DC检测标志为:CD11c、CD80、CD86和MHCⅡ。
1.7 MSC与DC的共培养 E2刺激MSC 24小时后,去上清,PBS洗涤一次,加入IL-4和GM-CSF诱导7天的DC(MSC∶DC=1∶10)培养于新鲜RMPI1640完全培养基,加LPS刺激24小时,流式测定DC表面分子的表达。
2 结果
2.1 MSC的形态学观察和表面标记物检测 原代培养早期细胞形态异质性较大,以梭形多角形为主。消化传代后从第2代起开始稳定生长,至第3代可获得较均一的MSC。细胞形态均一,为梭形或成纤维样、体积较大、单个核,呈漩涡样生长(图1A和B)。流式细胞仪检测显示,胎肺MSC稳定均一的表达CD29和CD44(纤维蛋白和透明脂酸盐的受体,基质细胞表达)、CD105(即SH-2);不表达CD117(多能造血干细胞标志)、CD31(内皮细胞标志)和CD45(造血细胞标志),经3代以上传代后,细胞成分均一,纯度在95%以上(图1C)。
2.2 E2影响MSC的增殖和贴壁能力,但不影响MSC表面标记的表达 将MSC以10 000孔铺于24孔板,每组3个复孔,加入E2处理24小时后细胞计数。结果表明,低浓度E2作用后MSC的数量低于对照组,随着E2浓度的升高,MSC的增殖能力逐渐增强,在10-7mol/L高浓度E2作用下MSC增殖能力高于正常对照(P<0.05)(图2A)。再将细胞重铺板,2小时后计数未贴壁细胞,计算贴壁率,E2处理后MSC贴壁能力均高于对照组(P<0.05)(图2B)。E2对MSC的表型没有影响,用三种浓度的E2处理MSC 24小时,流式细胞仪检测MSC表面标记CD117、CD29、CD31、CD44、CD105 及 CD45 的表达 ,结果显示,各处理组间(绿、红和蓝线表示)MSC表面标志的表达没有差异,且处理组和对照组(黄线表示)间也均无差异(图2C)。
2.3 E2调节MSC对DC表型的影响 E2能逆转MSC对DC的抑制作用,将MSC用E2预处理24小时,然后与用IL-4和GM-CSF诱导7天的DC共培养,加LPS(100 ng/ml)刺激DC成熟。24小时后用流式细胞仪测定DC成熟和功能标志MHCⅡ、CD80和CD86的表达。结果表明,与单独DC组相比MSC+DC共培养组中DC的CD86的表达显著降低(P<0.05)(图3A),而MHC Ⅱ和CD80的变化无显著性差异(图3C);当E2处理的MSC与DC共培后,DC表面MHCⅡ、CD80和CD86的表达均比MSC+DC共培养组有所提高(图3A、B和C),且在中及高浓度E2处理的MSC组中这种逆转更为显著(图3A和C)(P<0.05),提示E2能逆转MSC对DC的抑制作用。
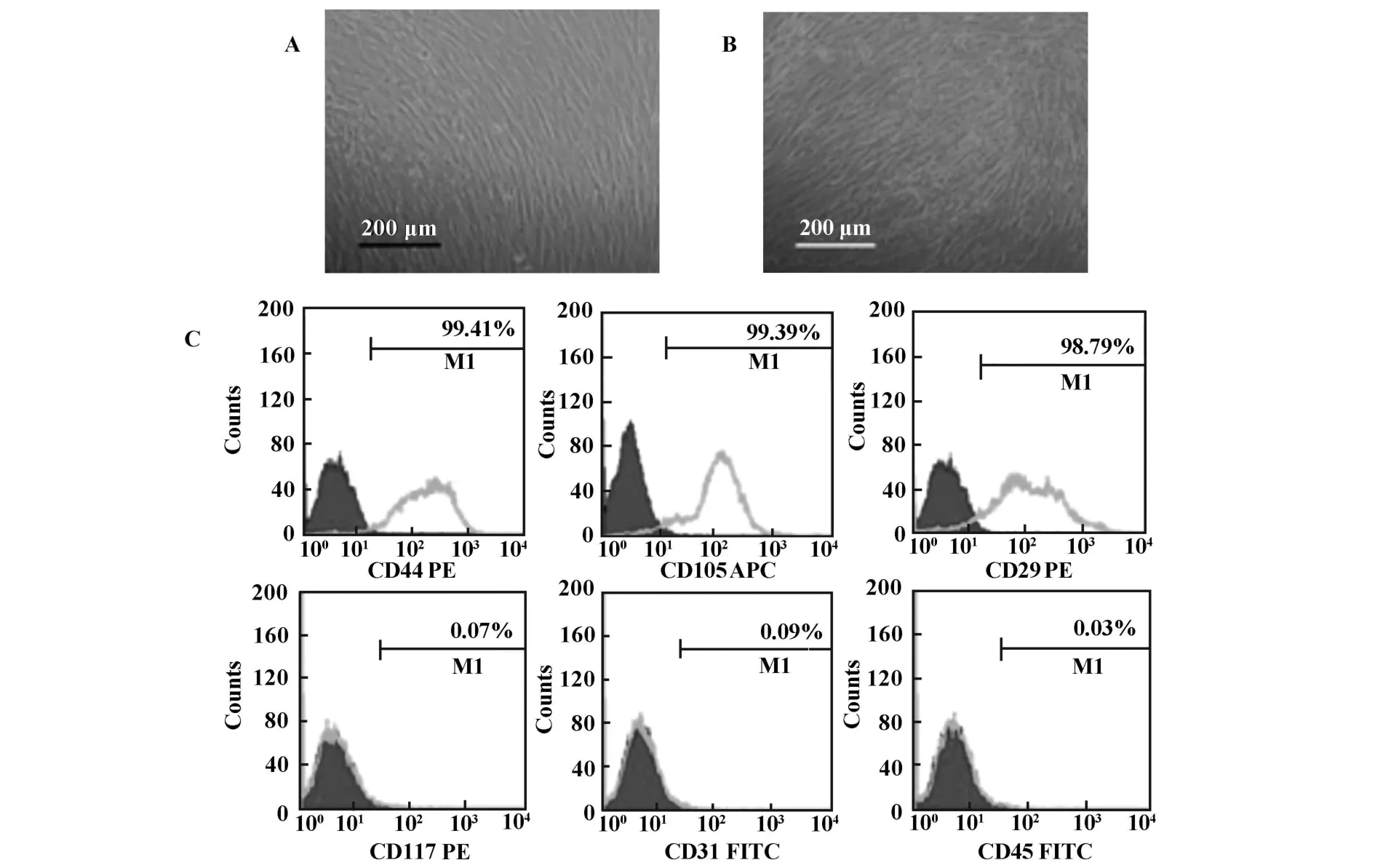
图1 人胎肺MSC的形态和表面标志Fig.1 Themorphology and surfacemarker of human fetal lung MSC
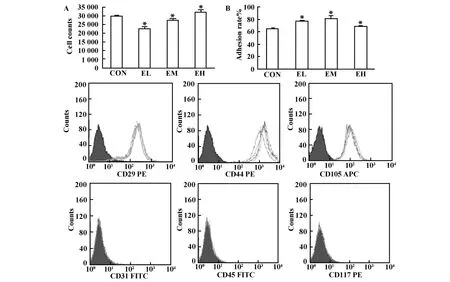
图2 E2作用后MSC的增殖贴壁能力以及MSC表面标志的表达Fig.2 The proliferation,adherent ability and surfacemarker of MSC after treated with E2

图3 E2处理过的MSC对DC表面标志的表达的影响Fig.3 The effects of MSC treated with E2 on the surface marker of DC
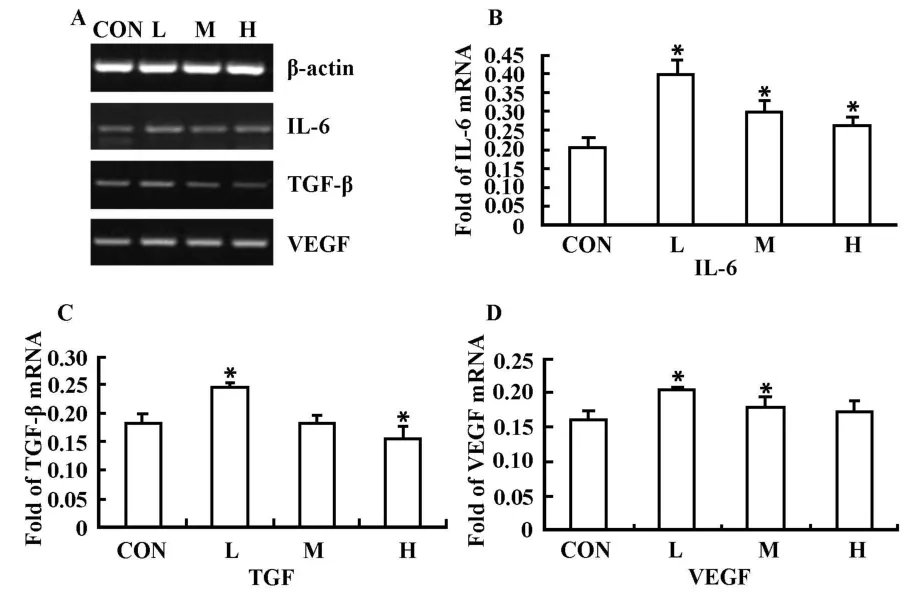
图4 E2处理后MSC分泌细胞因子的变化Fig.4 ValuateMSC's cytokine secretion after treated with E2
2.4 E2能改变MSC分泌细胞因子的水平 E2处理MSC 24小时后,提取MSC的mRNA,RT-PCR扩增IL-6、TGF-β和 VEGF 片段(图4A),从统计结果可以看出E2对MSC细胞因子的表达均有影响,在低浓度E2刺激时 IL-6、TGF-β和VEGF表达均增加(图4B、C和D),但随着E2浓度增高这三种细胞因子的表达均逐渐降低,其中IL-6和VEGF高于对照组(图4B、D),而高浓度 E2处理后,表达的TGF-β与对照组相比减少(P<0.05)(图4C),提示E2能影响MSC细胞因子的产生。
3 讨论
雌激素能影响间充质干细胞(MSC)的增殖及功能,我们选用雌二醇(E2)的两个正常生理浓度10-9mol/L和10-8mol/L以及妊娠末期雌激素的峰值浓度10-7mol/L,考察在不同浓度E2作用下MSC的增殖、表型和细胞因子的表达以及MSC对DC的作用。本实验结果显示,在相当于孕期峰值浓度(高浓度:10-7mol/L)的E2作用下,MSC的增殖和贴壁能力比对照组有所增加,但MSC表面标志的表达并无明显差异,这表明高浓度E2存在有利于MSC的增殖和增加细胞活性,但对MSC的表型以及纯度并没有太大影响。
MSC对DC有免疫抑制作用[5,6],我们思考在E2作用下MSC的功能发生怎样的改变,其对DC的抑制作用有没有变化?MSC几乎不表达MHCⅡ,具有低免疫原性的特点[18],并且以往的一些实验证明人源MSC输注MRL狼疮小鼠有治疗作用且不引起排斥反应[11],所以我们选用人胎肺MSC与小鼠DC进行共培养,在此实验中,可以看到正常的MSC能抑制DC的成熟,DC的CD86显著下降,MHCⅡ和CD80基本不变,但用E2预处理后的MSC和DC共培,发现E2+MSC+DC组的DC与MSC+DC组相比,DC的CD80、CD86和MHCⅡ的表达均有回升,尤其以CD86和MHCⅡ的回升更为明显,提示MSC的免疫抑制作用在一定程度上可能被E2逆转了。那么,MSC在E2作用下,是由于什么发生了改变而导致降低其对DC的免疫抑制能力?有研究报道MSC通过分泌的IL-6和TGF-β等对DC的分化有着部分抑制作用[19,20],故我们检测E2作用下MSC分泌细胞因子的变化。结果表明E2刺激时IL-6、TGF-β和VEGF表达均增加,但随着浓度升高三者表达均逐渐降低,在高浓度E2(10-7mol/L)作用MSC 24小时后,MSC表达的TGF-β与对照组相比减少,而IL-6和VEGF的表达仍高于对照组。
TGF-β1是重要的免疫负调节因子,而且能抑制淋巴细胞以外的细胞[21],有实验报道MSC能通过分泌的TGF-β抑制DC的成熟功能,我们的实验结果中可以看到,在正常生理浓度范畴的E2刺激时,TGF-β高于正常组,但当用妊娠期高浓度E2(10-7mol/L)作用下,MSC分泌的TGF-β减少,这可能是MSC对DC抑制减弱的原因之一。
迄今为止,关于IL-6对DCs分化发育的影响尚无定论,Park等[22]发现在gp130转基因小鼠中,IL-6刺激降低了 LPS介导 DCs上的MHCⅡ类分子、CD80、CD86和IL-12的表达,减弱了 DCs刺激 T细胞活化的能力;与之相反的是,Hegde等[23]发现IL-6可使单核细胞来源的DCs上MHCⅡ类分子、CD86的表达显著提高。所以在我们试验中,三种浓度E2处理后MSC分泌IL-6的均增多可能与DC的MHCⅡ、CD80和CD86的回升有关。另外,E2能通过促进MSC表达VEGF促进局部缺血后的心肌修复[15],但也有研究认为MSC并不通过VEGF对DC发挥抑制作用[19],本实验中在中、低浓度E2作用下表达略有升高,而在高浓度E2时恢复,这种变化是否对MSC抑制DC能力产生影响有待研究。
从以上分析我们推测,在不同浓度E2作用下MSC分泌的细胞因子发生改变,从而改变了对DC的抑制能力,尤其是高浓度E2作用后MSC分泌TGF-β和IL-6的改变可能导致MSC对DC抑制能力的降低,这也许是SLE在妊娠期病情加重的机理之一,但其具体机制还需进一步探讨。
1 Petri M.Sex hormones and systemic lupus erythematosus[J].Lupus,2008;5(17):412-415.
2 Ludewig B,Junt T,HengartnerHetal.Dendritic cells in autoimmune diseases[J].CurrOpin Immunol,2001;6(13):657-662.
3 Michelle A,Blanco P,Arce Eetal.Blood dendritic cellsand DC-poietins in systemic lupuserythematosus[J].Hum Immunol,2002;12(63):1172-1180.
4 Jiang Y,Jahagirdar BN,Reinhardt R Ietal.Pluripotency ofmesenchymalstem cells derived from adultmarrow[J].Nature,2002;418(6893):41-49.
5 Crapnellc,Frias A M,Porada Cetal.Generation of functional natural killer and dendritic cells in a human stromal-based serum-free culture system designed for cord blood expansion[J].Exp Hematol,2008;36(1):61-68.
6 Jiang X X,Zhang Y,Liu Betal.Humanmesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells[J].Blood,2005;5(10):4120-4126.
7 Keyser K A,Beagles K E,Kiem H Petal.Comparison ofmesenchymal stem cells from different tissues to suppress T-cell activation[J].Cell Trans,2007;16(5):555-562.
8 KeatingA.How domesenchymalstromalcellssuppressT cells?[J].Stem Cell,2008;2(2):106-108.
9 Pérez-Simón JA,Díez-Campelo M,Tabera Setal.The effect of mesenchymalstem cellson the viability proliferation and differentiation of B-lymphocytes[J].Haematologica,2008;93(9):1301-1309.
10 Sun L Y,Zhang H Y,Feng X Betal.A llogenic bonemarrow derived mesenchymalstem cells transplantation for refractory systemic lupuserythematosus[J].Arthritis Rheum,2008;58(9):925-925.
11 Zhou K X,Zhang H Y,Jin Oetal.Transplantation of human bonemarrowmesenchymal stem cell ameliorates the autoimmune pathogenesis in MRL/lprm ice[J].CellMol Immunol,2008;5(6):417-424.
12 Aggarwal S,Mark F P.Human mesenchymal stem cellsmodulate allogeneic immune cell responses[J].Blood,2005;105(4):1815-1822.
13 English K,Frank P,Bernard PMetal.Murinemesenchymal stem cells suppress dendritic cell migration,maturation and antigen presentation[J].Immunol Lett,2008;115(1):50-58.
14 Yun S P,Lee M Y,Ryu JMetal.Role of HIF-1{alpha}and VEGF in humanmesenchymal stem cell proliferation by 17{beta}-estradiol:involvementof PKC,PI3K/Akt,andMAPKs[J].Am JPhysiol Cell Physiol,2009;296(2):317-326.
15 Erwin GS,Crisostomo PR,Wang Yetal.Estradiol-treatedmesenchymal stem cells improvemyocardial recovery after ischem ia[J].JSurg Res,2009;152(2):319-324.
16 Ling L Z,Ni YH,Wang Q Letal.Transdifferentiation ofmesenchymal stem cells derived-from human fetal lung to hepatocyte-like cells[J].Cell Biol Int,2008;32(9):1091-1098.
18 Campagnoli C,Roberts IA,Kumar Setal.Identification ofmesenchymal stem/progenitor cells in human first-trimester fetal blood,liver,and bone marrow[J].Blood,2001;98(8):2396-2402.
19 D jouad F,Charbonnier LM,Bouffi Cetal.Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6-dependentmechanism[J].Stem Cells,2007;25(8):2025-2032.
20 LiY P,Paczesny S,Laure Eetal.Human mesenchymal stem cells license adultCD34+hemopoietic progenitor cells to differentiate into regulatory dendritic cells through activation of the notch pathway[J].J Immunol,2008;180(3):1598-1608.
21 Massimo DN,Carmelo CS,MicheleMetal.Human bonemarrow stromal cellssuppress T-lymphocyte proliferation induced by cellular or nonspecificm itogenic stimuli[J].Blood,2002;99(10):3838-3843.
22 Park S J,Nakagawa T,KitamuraHetal.IL-6 regulates in vivo dendritic celldifferentiation through STAT3 activation[J].J Immunol,2004;173(6):3844-3854.
23 HegdeS,Pahne J,Smola-Hess S.Novel immunosuppressive properties of interleukin-6 in dendritic cells:inhibition of NF-kappaB binding activity and CCR7 expression[J].Faseb J,2004;18(10):1439-1441.
[收稿2009-07-13 修回2009-08-28]
(编辑 张晓舟)
Estrogen can alter the immuno-suppressive effects of MSC on DC via modulating MSC′s cytokine secretion
ZHAOYe-Lin,ZHAOXiao-Yin,SUNLing-Yun,HOUYa-Yi.ImmunologyandReproductiveBiologyLaboratory,Medical SchoolofNanjingUniversity,Nanjing210093,China
Objective:To investigate the effectsof 17β-Estradiol(E2)onmesenchymal stem cells(MSC)and toevaluate the effectsof MSC treated with E2 on thematurationand function of dendritic cells(DC).Methods:We first isolated and culturedMSC from the human fetal lung.TheMSCwere treatedwith E2 for24 hours at various concentrations(10-9,10-8and 10-7mol/L).After cell counting,proliferation,adherent ability and immunophenotypes ofMSCwere detected by flowcytometry.Thegeneexpressionsof cytokine(IL-6,TGF-βand VEGF)were measured by RT-PCR.The effects ofMSC treated with E2 on thematuration and function of DCwere determined.Results:After treated with E2,the p roliferation and adherent ability ofMSCwere increased,while the immunophenotypes ofMSCwere not affected.When MSCs co-cu lturedwith DC,MSC could inhibit the immuophenotypes and function of DC.However,when DC co-cultured with E2-pretreated MSC,the immunophenotypes(MHCⅡ,CD80 and CD86)of DC had been reconstructed.After treatedwith the high concentration of E2 for24 hours,MSC secreted lower level of TGF-βthan that in the control group,while IL-6 and VEGF expressionswere increased comparedwith those in the controlgroup.Conclusion:Estrogenmay alter the immuno-suppressive effects ofMSC on DC viamodulating the cytokine secretion ofMSC.
17β-Estradiol(E2);Mesenchymal stem cells(MSC);Dendritic cells(DC);System ic lupus erythematosus(SLE)
R392
A
1000-484X(2010)01-0041-06
①本文受国家自然科学基金项目(No.30771959)和江苏省自然科学基金(No.2006119)资助
②南京大学医学院附属鼓楼医院风湿免疫科,南京210008
赵叶琳(1986年-),女,在读硕士,E-mail:zhaoyelin.nju@gmail.com;
及指导教师:侯亚义(1960年-),男,博士,教授,博士生导师,主要从事分子免疫学研究,E-mail:yayihou@nju.edu.cn。