自体肺体外循环与常规体外循环对细胞因子影响的实验对比研究①
2010-02-06林柏松张秀和张柏民姜亦忠吉林大学中日联谊医院心脏外科长春130033
林柏松 张秀和 张柏民 姜亦忠 李 哲 (吉林大学中日联谊医院心脏外科,长春 130033)
自体肺体外循环与常规体外循环对细胞因子影响的实验对比研究①
林柏松 张秀和 张柏民 姜亦忠 李 哲 (吉林大学中日联谊医院心脏外科,长春 130033)
目的:探讨以自体肺取代人工肺的体外循环方法对犬体外循环相关性炎症反应的影响。方法:将12只杂种犬随机分为对照组及实验组(每组6只)。对照组在体外循环(CPB)期间使用膜式氧合器,实验组在CPB期间使用自体肺进行氧合,两组均阻断主动脉90分钟、辅助循环30分钟,于CPB前(T1)、转流后60分钟(T2)、停机后60分钟(T3)、停机后120分钟(T4)抽取动脉血,测定血浆肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素8(IL-8)和白细胞介素 10(IL-10)浓度。结果:两组实验犬血浆TNF-α、IL-6、IL-8和IL-10的浓度,在T2~T4各时点与体外循环前比较均明显增加(P<0.01);T2~T4时点实验组血浆TNF-α、IL-6和IL-8浓度明显低于对照组(P<0.01),IL-10浓度明显高于对照组(P<0.05)。结论:自体肺体外循环可抑制体外循环过程中促炎细胞因子TNF-α、IL-6和IL-8的释放,促进抗炎细胞因子IL-10的释放,从而减轻常规体外循环引起的全身炎症反应。
自体肺;炎症反应;细胞因子;体外循环
心脏外科的飞速发展离不开体外循环(Cardiopulmonary bypass,CPB)的广泛支持,但体外循环期间血液成分与体外循环的人工表面接触可引起急性阶段性炎症反应,进而引起严重的术后并发症。心脏外科医生始终进行不懈努力以减少血液与异物的接触面积、增加组织相容性,并不断开发毒性更低的体外循环管路。自体肺拥有良好的组织相容性,最大限度地降低体外循环相关性炎症反应的程度,有效地减轻了全身炎症反应引起的肺损伤。该方法虽然在闭式心脏手术有良好的效果,但在心内直视手术中空气极易直接进入切开的左心房或经心内缺损进入左心房,造成致命的体循环气栓,这是该方法在心脏外科早期昙花一现、当前无法广泛使用的根本原因,近四十年内全球尚无在打开心脏的心内直视手术中使用该方法的报道。本研究为对比使用自体肺体外循环和常规体外循环的实验研究,观察围手术期细胞因子的变化,为进一步在心内直视手术中使用该方法提供依据。
1 材料与方法
1.1 实验分组 杂种犬12只,体重17~22千克,随机分为对照组和实验组,每组6只:对照组为常规体外循环组:在体外循环期间使用膜式氧合器;实验组在体外循环期间使用自体肺进行氧合。
1.2 方法 实验犬以苯巴比妥钠25 mg/kg诱导麻醉后,气管内插管,人工呼吸机容量控制模式辅助呼吸,吸入氧浓度100%(FiO2=1.0),静注潘可罗宁0.3 μg/kg,芬太尼100μg/kg,静点芬太尼[50μg/(kg·h)]维持麻醉。心电监护,右侧股动脉置入测压管,股静脉置入Swan-ganz导管。胸部正中切口,显露心脏。肝素化,经升主动脉插入动脉管,经上、下腔静脉插入静脉管,建立体外循环。对照组为常规体外循环:在体外循环期间使用膜式氧合器,平均动脉压在50~70mmHg,阻断循环期间停止肺通气。实验组在体外循环期间使用自体肺进行氧合,肺动脉灌注压不高于20 mmHg。在鼻温降至25℃时阻断上、下腔静脉及升主动脉,经主动脉根部灌注冷晶体心肌停跳液。心脏阻断90分钟,开放上、下腔静脉、升主动脉、肺动脉。当鼻温达到 36.5℃、心跳有力、平均动脉压在60mmHg(8.0 kPa)、再灌注30分钟时,停体外循环机。
1.3 检测指标 对照组及实验组均在体外循环前(T1)、转流后60分钟(T2)、停机后 60分钟(T3)、停机后120分钟(T4)抽取动脉血,血样采集入肝素铵试管,用酶联免疫吸附(ELISA)法测定血浆肿瘤坏死因子α(TNF-α)、白细胞介素 6(IL-6)、白细胞介素8(IL-8)和白细胞介素10(IL-10)浓度。由于CPB期间的血液稀释程度在不断变化中,为排除血液稀释对测定值的影响,所有数据都按下列公式进行矫正,矫正值=实测值×(术前HCT/采样时HCT)。
1.4 统计学处理 采用SPSS11.0统计软件进行统计学处理,结果用±s表示,以Studentt检验评价两组配对样本的差别。P<0.05时双尾检查的差别有明显统计学意义。
2 结果
2.1 各组肿瘤坏死因子α(TNF-α)结果 两组实验犬血浆TNF-α浓度在T2~T4各时点与体外循环前比较均明显增加(P<0.05);T2~T4时点实验组血浆TNF-α浓度明显低于对照组(P<0.01)(表1)。
2.2 各组白细胞介素6(IL-6)结果 两组实验犬血浆IL-6的浓度在T2~T4各时点与体外循环前比较均明显增加(P<0.05);T2~T4时点实验组血浆IL-6浓度明显低于对照组(P<0.01)(表2)。
2.3 各组白细胞介素8(IL-8)结果 两组实验犬血浆IL-8的浓度在T2~T4各时点与体外循环前比较均明显增加(P<0.01);T2~T4时点实验组血浆IL-8浓度明显低于对照组(P<0.01)(表3)。
2.4 各组白细胞介素10(IL-10)结果 两组实验犬血浆IL-10的浓度在T2~T4各时点与体外循环前比较均明显增加(P<0.01);T2~T4时点实验组血浆IL-10浓度明显高于对照组(P<0.05)(表4)。
表1 各组肿瘤坏死因子α(TNF-α)结果(n=6,±s,pg/ml)Tab.1 Plasma concentration of TNF-αin each group(n=6,±s,pg/m l)

表1 各组肿瘤坏死因子α(TNF-α)结果(n=6,±s,pg/ml)Tab.1 Plasma concentration of TNF-αin each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
T2 T3 T4 3 8.21±0.841)21.57±7.761)12.81±1.561)Study group 3.72±0.51 6.06±0.921)2)9.24±4.251)2)7.32±1.331)2)
表2 各组白细胞介素6(IL-6)结果(n=6,±s,pg/m l)Tab.2 Plasma concentration of IL-6 in each group(n=6,±s,pg/m l)

表2 各组白细胞介素6(IL-6)结果(n=6,±s,pg/m l)Tab.2 Plasma concentration of IL-6 in each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
Groups T1 T2 T3 T4 Control group 3.06±0.76 9.96±2.121)54.65±21.131)14.35±2.161)Study group 2.89±0.57 6.58±1.931)2)35.44±10.451)2)7.02±1.471)2)
表3 各组白细胞介素8(IL-8)结果(n=6,±s,pg/m l)Tab.3 Plasma concentration of IL-8 in each group(n=6,±s,pg/m l)

表3 各组白细胞介素8(IL-8)结果(n=6,±s,pg/m l)Tab.3 Plasma concentration of IL-8 in each group(n=6,±s,pg/m l)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.01 vs controlgroup.
Groups T1 T2 T3 T4 Controlgroup 11.56±1.16 29.36±2.421) 56.45±5.731)69.28±7.161)Study group 12.32±1.35 20.58±1.971)2)38.45±7.401)2)40.13±9.471)2)
表4 各组白细胞介素10(IL-10)结果(n=6,±s,pg/ml)Tab.4 Plasma concentration of IL-10 in each group(n=6,±s,pg/ml)
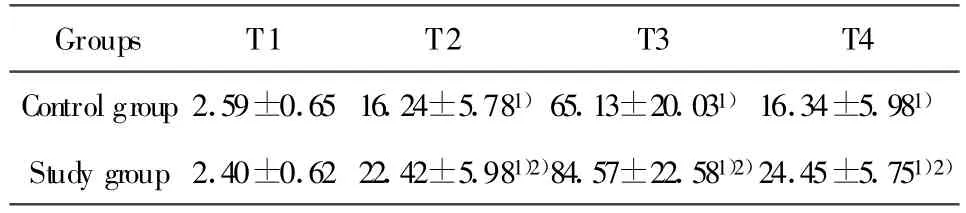
表4 各组白细胞介素10(IL-10)结果(n=6,±s,pg/ml)Tab.4 Plasma concentration of IL-10 in each group(n=6,±s,pg/ml)
Note:T1.Pre-operation,T2.60m in of CPB,T3.1 hour after CPB,T4.2 hour after CPB.1)P<0.01 vs T1;2)P<0.05 vs controlgroup.
Groups T1 T2 T3 T4 Controlgroup 2.59±0.65 16.24±5.781)65.13±20.031)16.34±5.981)Study group 2.40±0.62 22.42±5.981)2)84.57±22.581)2)24.45±5.751)2)
3 讨论
CPB经半世纪的探索与改进,技术日益成熟,其安全性得以明显增加,使得重症和复杂心脏直视手术死亡率和并发症明显下降。但CPB后的全身炎症反应仍然是心血管外科患者的一个主要并发症,已成为目前心血管外科的重要研究课题。
CPB的机械剪切作用、血液与体外循环的人工材料表面接触,可启动并激活中性粒细胞[1]。致炎介质随后通过扩增中性粒细胞激活而进一步加重肺损伤[2]。人工氧合器具有巨大的人工表面,是激活凝血反应的强烈刺激[3],即使使用大剂量肝素也不能完全抑制凝血酶的激活,从而进一步激活血小板和白细胞[4],激活的中性粒细胞可在体循环及肺组织内进一步释放一定数目的蛋白水解酶和氧化化学产物。这些产物包括降解的基质金属蛋白酶(MMP)、弹性蛋白酶、氧自由基(如髓过氧化物酶、过氧化氢、过氧化物)。这些物质可破坏肺组织的超微结构,导致肺泡-内皮通透性增加而影响气体交换和肺结构,产生CPB后肺损伤[5]。常规体外循环期间,肺脏被排除在血液循环之外,肺动脉内的血流处于相对静止状态,引起血管内皮细胞功能紊乱,导致肺脏再灌注后严重的微循环障碍[6]。
本研究发现:实验组及对照组实验犬血浆TNF-α、IL-6、IL-8浓度在T2~T4各时点与体外循环前比较均明显增加(P<0.01),进一步证实了体外循环可引起致炎性细胞因子的释放,全身炎症反应伴随体外循环而存在。TNF-α是体外循环相关性炎症反应的主要致炎因子,在炎症瀑布级联反应中起核心作用,是CPB后炎症反应过程中释放最早同时也是最重要的内源性介质之一,既可损伤血管内皮细胞,促进内皮细胞粘附分子的表达,又可促进白细胞介素的合成,激活血小板,诱导产生多种活性物质,增强炎症反应,导致组织器官损伤[7]。IL-6是细胞因子释放第二高潮中的主要因子,也是急性期反应蛋白合成和炎性细胞积聚的主要因素,它能整合早期炎症反应信号,促进炎性因子的进一步释放,其水平升高与CPB后心功能不全有关,是反映组织损伤的早期和敏感指标[7]。IL-8由活化的内皮细胞、单核细胞及T淋巴组胞产生,是最强的多形核白细胞和T淋巴细胞激活和趋化因子,它的血浆水平被认为是严重组织损伤的标志。本研究发现CPB开始后各组IL-8水平均明显增高,提示IL-8共同参与了CPB炎症反应。
自体肺体外循环方法有以下优点:(1)维持肺动脉灌注,肺动脉有持续血供,避免肺脏缺血再灌注损伤,继承了体外循环期间维持肺动脉灌注的优良肺保护效果;(2)自体肺拥有良好的组织相容性,最大限度地降低体外循环相关性炎症反应的程度,有效地减轻了全身炎症反应引起的肺损伤;(3)氧合器的成本接近零,可直接降低患者手术费用。
本研究显示 IL-10与 TNF-α、IL-6、IL-8同步升高,说明机体的炎症反应中既有促炎细胞因子的产生,同时又有抗炎细胞因子的产生。IL-10是抗炎细胞因子,可抑制炎症反应和免疫反应,对全身炎症反应导致的脏器损伤有一定的保护作用。IL-l0的释放增加代表着限制炎症反应的内源性反应,大量强效抗炎因子的产生反映了人体自身也尽可能地限制过激的炎症反应[8]。维持促炎细胞因子和抗炎细胞因子之间的平衡对减轻炎症反应、降低术后并发症有十分重要的意义。
本研究结果显示:T2~T4时点实验组血浆TNF-α、IL-6、IL-8浓度明显低于对照组(P<0.01),IL-10浓度明显高于对照组(P<0.05)。表明自体肺体外循环不仅可以有效抑制CPB期间促炎细胞因子TNF-α、IL-6和IL-8的释放,还促进抗炎细胞因子IL-10的释放,从而有效减轻体外循环相关性炎症反应,减轻体外循环相关炎症反应引起的重要器官损伤。其原因有二方面:(1)自体肺体外循环不使用人工肺,无表面接触激活血液中有关成分的根本缺点;(2)心脏缺血期间,肺脏的血供或氧供未减少,从而预防了肺脏再灌注后的病理生理学改变。
1 Oliver JW,Amy LW,Katie LWetal.Theinflammatory response to cardiopulmonary bypass:part2—anti-inflammatory therapeutic strategies[J].JCardiothoracic Vascular Anesthesia,2009;23(3):384-393.
2 Sahin S,Fevzi T,Serdar Getal.The impactofallogenic red cell transfusion and coated bypass circuit on the inflammatory response during cardiopulmonary bypass:a randomized study[J].Interactive Cardio Vascular Thoracic Surgery,2009;8(1):93-99.
3 UmeadiC,Kandeel F,Al-Abdullah IH.Ulinastatin isanovelprotease inhibitor and neutral protease activator[J].Transplant Proceed,2008;40(5):387-389.
4 Banz Y,Rieben R,Zobrist Cetal.Addition of dextran sulfate to blood cardioplegia attenuates reperfusion injury in a porcinemodelof cardiopulmonary bypass[J].Eur Cardio-Thoracic Surg,2008;34(9):653-660.
5 Yang YM,Cai JM,Wang SMetal.Better protection of pulmonary surfactant integrity with deep hypotherm ia and circulatory arrest[J].Ann Thorac Surg,2006;82(06):131-137.
6 Liakopoulos O J,Schm itto JD,Kazmaier Setal.Cardiopulmonary and system ic effects of methylprednisolone in patients undergoing cardiac surgery[J].Ann Thorac Surg,2007;84(7):110-119.
7 Stoney W S.Evolution of cardiopulmonary bypass[J].Circulation,2009;119(6):2844-2853.
8 Evans B J,Haskard DO,Finch JRetal.The inflammatory effectof cardiopulmonary bypass on leukocyte extravasation in vivo[J].JThorac Cardiovasc Surg,2008;135(05):999-1006.
[收稿2009-09-24 修回2009-12-23]
(编辑 张晓舟)
The empirical study for the effect of extracorporeal circulation with autologous lung and conventional extracorporeal circulation as oxygenator on cytokine levels
LINBai-Song,ZHANGXiu-He,ZHANGBai-Min,JIANGYi-Zhong,LIZhe.DepartmentofCardiovascularSurgery,China-JapanUnionHospital,JilinUniversity,Changchun130033,China
Objective:To determine the protective effectof cardio-pu lmonary bypass(CPB)with autologous lungas oxygenatoron CPB-relative inflammatory response.Methods:Twelveadultmongrel dogswere randomly divided into controlgroup and study group.Cardiopulmonary bypass(CPB)using amembrane oxygenator(controlgroup)or using the autologous lung(study group)for gas exchangewas performed for 120min in an alternating series of 12mongrel dogswith the heart arrested for 90min by crystalloid cardioplegia and 30min reperfusion.The blood sampleswere collected at the same time pointof pre-operation(T1),60min of cardiopulmonary bypass(T2),and 1 hour(T3),2 hours(T4)after cardiopulmonary bypass.Plasma concentration of IL-6,IL-10,TNF-αwere detected with ELISA.Results:The plasma levels of IL-6,IL-8,IL-10,TNF-αin eachgroupwere significantly increased atT2,T3,T4.The plasma levels of IL-6,IL-8 and TNF-αin study groupwere significantly lower than in the control group at T2,T3,T4.The plasma levels of IL-10 in study group were significantly higher than the levels in control group at T2,T3,T4.Conclusion:Thisstudy indicates thatextracorporeal circu lationwith autologous lung asoxygenator cou ld reduce the increased amplitude of plasma levels of TNF-α,IL-6 and IL-8whereas enhance the increased amp litude of the p lasma IL-10 levels that result from CPB.Inotherword,extracorporeal circulationwith autologous lung asoxygenator possessestheeffect to regulate inflammatory cytokine balance and down-regulate CPB-relative inflammatory response.
Autologous lung;Inflammatory response;Cytokine;Cardiopulmonary bypass
R332 R654.1
A
1000-484X(2010)03-0278-03
①本文为吉林省科技厅科技发展计划基金资助课题(20080742)
林柏松(1969年-),男,医学博士,副教授,副主任医师,硕士生导师,主要从事心肌保护和肺保护方面的研究。