GST/RIPX融合蛋白表达载体的构建及其在大肠埃希菌中的表达
2010-02-03王孝会王桂玲
王孝会,王桂玲
(中国医科大学 基础医学院细胞生物学教研室,卫生部细胞生物学重点实验室,沈阳 110001)
GST/RIPX融合蛋白表达载体的构建及其在大肠埃希菌中的表达
王孝会,王桂玲
(中国医科大学 基础医学院细胞生物学教研室,卫生部细胞生物学重点实验室,沈阳 110001)
目的 构建GST/RIPX融合蛋白基因表达载体,并在大肠埃希菌(E.coli)中诱导表达。方法 以质粒pcDNA3.1-RIPX为模板,通过BamH1和Xho1酶切位点将RIPX定向插入pGEX-4T-2中,构建原核表达质粒pGEX-4T-2-RIPX,并转化E.coliDH5α,筛选阳性重组子,限制性内切酶酶切鉴定和DNA序列测定正确后,转入化E.coliBL21中,异丙基硫代β-D半乳糖苷诱导表达,鉴定。结果 酶切及测序结果证明,成功构建了原核表达质粒pGEX-4T-2-RIPX,并用SDS-PAGE方法证实了GST/RIPX融合蛋白的表达。结论 成功构建了RIPX原核表达载体,并证实了融合蛋白的表达,为进一步纯化RIPX蛋白和研究RIPX的生物学功能奠定了基础。
质粒;原核表达;融合蛋白;RIPX
RIPX(Rap2interaction protein X) 又名 KIAA0871,属于KIAA基因家族成员,人的RIPXcDNA全长为4304bp,ORF全长为1460bp,编码蛋白为469氨基酸。该蛋白含有一个RUN结构域,在脑组织中存在高表达,与神经轴突形成相关[1]。RIPX同源蛋白包括Rap2相互作用蛋8(RPIP8)和Rap2相互作用蛋白 9(RPIP9)[2,3]。该蛋白家族能够通过与Rap和Rab家族蛋白相互作用而影响相关通路[3~5],但目前其具体作用方式及其产生的生物学效应还不明确。
为了进一步研究RIPX的功能及具体作用机制,我们利用基因重组技术成功构建了RIPX的原核表达载体,将其导入E.coliBL21中进行诱导表达,并进一步对其表达情况进行鉴定,为今后研究RIPX的生物学功能奠定了基础。
1 材料与方法
1.1 材料
大肠杆菌DH5α和BL21为本实验室保存,原核表达载体pGEX-4T-2购自美国Clontech公司;各种限制性内切酶﹑电泳凝胶回收试剂盒均购自TakaRa公司;T4DNA连接酶购自NEB公司,蛋白质分子质量标准购自MBI公司,异丙基硫代-D半乳糖苷(IPTG)为Amresco公司产品。DNA测序由南京金斯瑞公司完成。
1.2 RIPX原核表达载体的构建
将pcDNA-RIPX载体用Xho1和Bam1双酶切后,凝胶回收纯化产物后,与经同样酶切处理的原核表达载体p GEX-4T-2用T4-DNA连接酶连接16℃过夜,得到连接产物。取5ul上述连接反应液转化感受态细胞E.coliDH5α中,涂布于含氨苄西林的LB琼脂平板,37℃过夜培养过夜。挑取单克隆菌落接种于氨苄西林3ml的LB培养液中,37℃震荡过夜。用碱裂解法制备质粒DNA,用Xho1和Bam1双酶切鉴定重组质粒,并送生物公司测序,经测序正确后,将构建质粒命名为GST-RIPX。
1.3 重组质粒的诱导表达
将测序正确的重组质粒p GEX-4T-2-RIPX转化大肠埃希菌BL21涂布于LB琼脂平板,37℃培养过夜。各挑取单菌落5个,碱裂解法提取质粒DNA,利用BamN1和Xho1双酶切后鉴定阳性克隆。将阳性克隆接种到含氨苄霉素的LB培养基中,37℃过夜培养。
1.4 SDS-PAGE凝胶分离
将过夜培养含阳性克隆的菌液按1∶100稀释,37℃培养至OD600为0.6左右时,加入终浓度1mmol/L的IPTG30℃诱导培养3h时,收集菌体,加入 100μl 1×SDS缓冲液中,100℃加热 5min,12000r/min离心5min,冰上放置,取上清进行10%SDSPAGE电泳。电泳结束后进行考马斯蓝染色,脱色后观察电泳结果,发现诱导3h即可达到理想效果。
1.5 Western blot分析
将上述诱导表达后的蛋白经10%SDS-PAGE凝胶分离,恒流转移至PVDF膜上,4℃过夜,用5%脱脂奶粉封闭3h,TBST洗膜10min 3次,加入GST抗体(Cell Signaling 公司,1∶2000),室温 1.5h,TBST洗膜10min 3次,加入辣根过氧化物酶标记的二抗(1∶5000) 室温 2h,TBST洗膜 10min 3次,ECL显色,压片。
2 结果
2.1 pGEX-RIPX重组质粒的酶切鉴定
将重组质粒pGEX-4T-2-RIPX经Xho1和BamH1双酶切后得到约4.9kb和1.5kb左右的两条带,与预期结果相符(图1),并经测序鉴定正确,无移码突变。
2.2 原核表达质粒在大肠杆菌中的诱导表达
将构建的原核表达质粒pGEX-4T-2-RIPX及空载体pGEX-4T-2分别转化大肠杆菌BL21中,挑取单菌落进行诱导表达,利用10%的SDS-PAGE电泳进行分离,其中重组质粒pGEX-4T-2-RIPX在70kDa附近出现一明显的特异性蛋白带,其分子量与预期相符(图3)。
2.3 Western blot分析纯化后GST-RIPX融合蛋白

图1 pGEX-RIPX重组质粒的酶切鉴定结果Fig.1 Restrictin enzyme digestion analysis of the recombinant plasmid pGEX-RIPX

图2 pGEX-RIPX重组质粒的测序鉴定结果Fig.2 The sequencing result of the recombinant plasmid pGEXRIPX
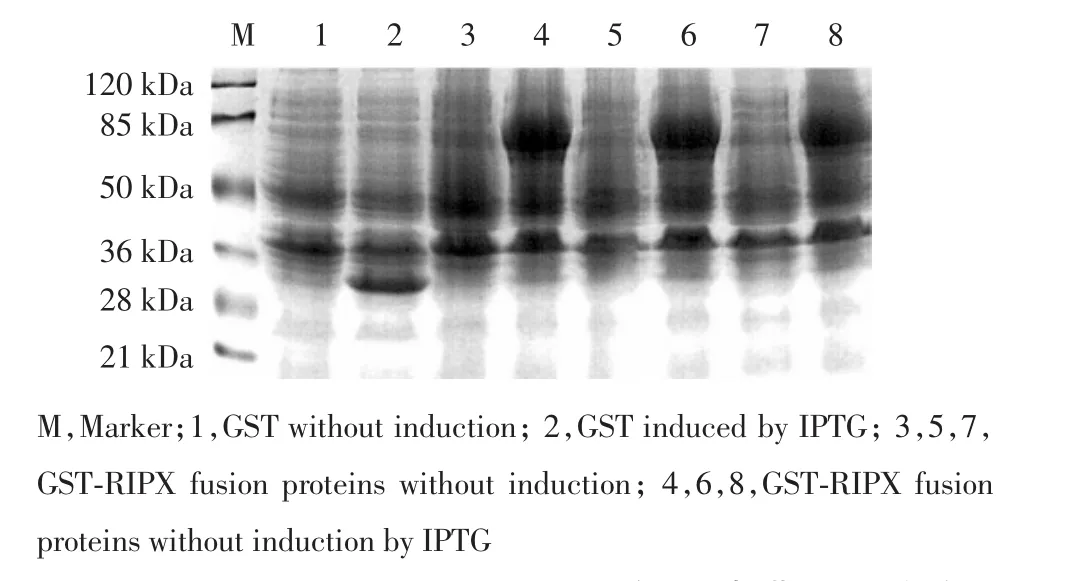
图3 SDS-PAGE分析GST-RIPX蛋白在大肠杆菌BL21中的诱导表达Fig.3 SDS-PAGEanalysis of the induction expression of GSTRIPXfusion proteins in E.coliBL21
我们利用10%SDS-PAGE电泳后,经Western blot分析,利用GST单克隆抗体检测,结果可见在分子量为70kDa附近出现条带,分析为质粒本身的谷胱甘肽转移酶(GST)分子量(26kDa)和RIPX分子量之和,说明表达了GST-融合蛋白,与预期结果一致。
3 讨论
随着人类基因组计划的完成,对未知蛋白质的鉴定和功能研究已经成为后基因组计划的主要研究内容。RIPX是近年来发现和克隆的人类基因,又名KIAA0871,属于KIAA基因家族成员。因其编码的蛋白与Rap和Rab家族中GTP酶功能相关的蛋白有相同的结构域,RIPX可能在Ras-like GTPase信号转导通路中发挥重要的作用[6]。
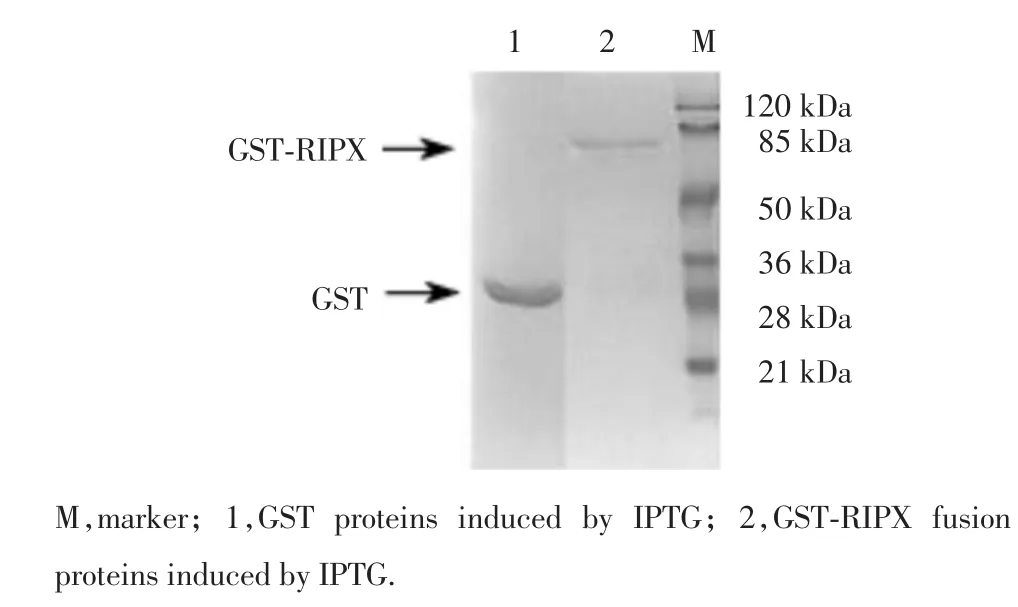
图4 GST-RIPX融合蛋白经纯化后SDS-PAGE后考马斯亮蓝染色分析Fig.4 SDS-PAGEanalysis of GST-RIPXfusion protein
为了进一步研究RIPX的生物学功能,构建RIPX的原核表达载体是关键之一。在本研究中,我们成功构建了RIPX原核表达载体,转入大肠杆菌后,用IPTG进行诱导表达。通过纯化,我们获得了原核表达的GST–RIPX融合蛋白。在进行原核细胞表达时,目前多以融合蛋白为表达形式的载体,这样既有利表达蛋白的纯化,又可防止宿主菌蛋白酶对表达蛋白的降解,保护目的蛋白的活性。表达的融合蛋白进一步可通过谷胱甘肽Beads结合吸附,从而获得原核表达的目的蛋白。本实验研究结果将为进一步寻找RIPX新的相互作用蛋白,探讨其生物学功能及具体机制奠定基础。
[1]Mori T,Wada T,Suzuki T,Kubota Y,et al.Singar1,a novel RUNdomain-containing protein,suppresses formation of surplus axons for neuronal polarity[J].JBiol Chem,2007,282(27):19884-19893.
[2]Janoueix-Lerosey I,Pasheva E,de Tand MF,et al.Identification of a specific effector of the small GTP-binding protein Rap2[J].Eur JBiochem,1998,252(2):290-298.
[3]Wang S,Zhang Z,Ying K,et al.Cloning,expression,and genomic structure of a novel human Rap2interacting gene (RPIP9)[J].Biochem Genet,2003,41(1-2):13-25.
[4]Kukimoto-Niino M,Takagi T,Akasaka R,et al.Crystal structure of the RUNdomain of the RAP2-interacting protein x[J].Biol Chem,2006,281(42):31843-31853.
[5]Yoshida H,Okumura N,Kitagishi Y,et al.Rab5(Q79L) interacts with the carboxyl terminus of RUFY3[J].Int JBiol Sci,2010,6(2):187-189.
[6]Zhao AG,Li T,You SF,et al.Effects of Wei Chang An on expression of multiple genes in human gastric cancer grafted onto nude mice[J].World JGastroenterol,2008,14(5):693-700.
(编辑 孙宪民,英文编辑 赵传胜)
Reconstruction of pGEX-4T-2-RIPXand Its Expressions inE.coli
WANGXiao-hui,WANGGui-ling
(Department of Cell Biology,The Key laboratory of Cell Biology,Ministry of Public Health of China,College of Basic Medical Sciences,China Medical University,Shenyang110001,China)
Objective To construct GST/RIPXfusion protein expression vector and induce its expression in Escherichia coli(E.coli).MethodsThe coding sequence of RIPXwas amplified from the plasmid pcDNA3.1-RIPXby PCRand inserted into pGEX-4T-2by BamHIand Xho1.The positive recombinants were identified by restriction endonuclease digestion and DNAsequencing.Then they were transformed into E.coli BL21,induced by IPTGand identified by SDS-PAGE.ResultsEnzyme digestion and DNAsequencing results indicated that the prokaryotic expression plasmid pGEX-4T-2-RIPXwas successfully constructed and confirmed.The desired GST/RIPXfusion protein was detected by SDS-PAGE.ConclusionThe prokaryotic expression plasmid of RIPXis successfully constructed and the expression of fusion proteins is confirmed.This study provides the basis for the further purification of RIPXand research on the biological function of RIPX.
plasmid;prokaryotic expression;fusion protein;RIPX
Q257
A
0258-4646(2010)12-0987-03
国家自然科学基金资助项目(30871294)
王孝会(1987-),男,硕士.
王桂玲,E-mail:wanggl@mail.cmu.edu.cn
2010-09-28
