舒胸片有效成分组微乳化剂型改造后的药效作用特点
2010-01-29谢生荣戚建平孙红爽傅继华平其能
刘 雯, 谢生荣, 戚建平, 孙红爽, 傅继华, 平其能
(中国药科大学,江苏南京211100)
舒胸片(Shuxiong Tablet,SXT)处方由三七、红花、川芎三味中药组成,具有活血、祛瘀、止痛等功效,临床上主要用于冠心病、心绞痛、心律失常等疾病的治疗。我们根据舒胸片有效成分各自在药材中的含量及舒胸片中各味药材的比例[1-3],组合成舒胸片有效成分组(Shuxiong Tablet effective compounds group,SECG),包含三七总皂苷(Panax notoginsenosides,PNS),羟基红花黄色素A(hydroxysaffloryellowA,HSYA),川芎挥发油(volatile oil of Rhizoma Chuanxiong,CVO)和阿魏酸(Ferulic Acid,FA)。前期研究表明,SXT与SECG在抗炎、镇痛、抗凝血、抗血栓和心肌保护等方面的作用效果相同并具有相同的量效关系,提示SECG有可能代替SXT应用于治疗。
微乳(ME)是由水相、油相、表面活性剂和助表面活性剂按适当的比例自发形成的一种透明或半透明的、低黏度、各相同性且热力学稳定的溶液系统,是一种新型给药系统。本研究将SECG制成微乳剂型(Shuxiong Microemulsion,SME),通过 SECG 和SME在抗炎、抗凝血、活血化瘀和心肌保护作用方面的比较研究,探讨进一步提高舒胸片有效成分组药效作用的可行性。
1 材料与动物
1.1 剂量设置
根据前期研究SECG给药量设定[4],SECG小鼠给药量取30.9 mg/kg,其中:PNS 19.5 mg/kg,HSYA 6.0 mg/kg,CVO 3.0 mg/kg,FA 2.4 mg/kg;大鼠给药量取 20.5 mg/kg,其中:PNS 12.9 mg/kg,HSYA 4.0 mg/kg,CVO 2.0 mg/kg,FA 1.6 mg/kg。
已制备的含药微乳中有效成分组的含量为14.12%折算为SME给药量为218.80 mg/kg,取中剂量的2倍及1/2倍为高、低剂量;大鼠给药中剂量取 20.5 mg/kg(含 PNS 13.0 mg,HSYA 4.0 mg,CVO 2.0 mg,FA 1.6 mg),折算为 SME给药量为146.3 mg/kg,取其2倍及1/2倍为高、低剂量。阿司匹林给药量取200 mg/kg。
1.2 主要试剂
PNS,云南昆明制药股份有限公司产品;HSYA,山东省天然药物工程技术研究中心;CVO,江西吉水同仁天然药用油厂产品;FA,中国国药集团上海化学试剂公司产品;含药微乳,中国药科大学药剂实验室提供,为油包水型(W/O);阿司匹林片,南京白敬宇制药有限责任公司产品;Miglyol 840,德国sasol公司,批号:040416;一抗 Mouse polyclonal anti NF-(SC-8008,65kD)购自美国Santa Cruz公司,1:500;二抗IRDyeTM800-conjugated aiti-Mouse IgG购自美国Rockland公司,1:10 000。
1.3 主要仪器
T6紫外可见光分光光度计,北京普析通用仪器有限责任公司生产;FA1004型电子天平,上海恒平科学仪器有限公司;SC—2000血小板聚集仪,北京赛科希德科技发展有限公司;半干式转膜槽:美国Biorad公司;6131型核酸、蛋白质含量测定仪:德国Eppendorf公司;Odyssey近红外荧光扫描成像系统,美国LI-COR公司。
2 方法
2.1 小鼠角叉莱胶足趾肿胀试验
昆明种小鼠60只,♀♂各半,随机分为6组,即模型组,阳性对照组,SECG组,SME高、中、低剂组。每天灌胃给药1次,给药体积为0.25 mL/10 g。连续给药4 d。末次给药前禁食12 h,末次给药后1 h,在小鼠的右后足皮下注射1%角叉菜胶0.03 mL,4 h后剪下双足,称重,并计算肿胀率。将致炎足充分剪碎,于2 mL生理盐水中浸泡过夜,3 000 r/min离心5 min,取上清液,于278 nm处测吸光度(A),以吸光度与足重(g)比值作为PGE2含量。
2.2 小鼠凝血时间试验
剂量设置、分组、给药方法及禁食处理,参照方法2.1项。给药1 h后,毛细血管眼眶取血,测定凝血时间。
2.3 大鼠动静脉旁路血栓试验
SD大鼠40只,♀♂各半,随机分为5组:对照组,SECG组、SME高、中、低剂量组。每天灌胃给药1次,连续14 d,第13天给药后禁食12 h过夜,次日给药40 min后,腹腔注射乌拉坦(10 mg/kg)麻醉,分离右颈总动脉和左颈外静脉,以生理盐水液充满聚乙稀管,管中预先放入一段约4 cm长的一号手术丝线,开放动脉夹,立即开始计时,使血流通15 min后中断血流,取出丝线称血栓湿重,计算各组血栓抑制率并与对照组比较。实验结果以血栓湿重和血栓抑制率表示。血栓湿重=(血栓+丝线重量)-丝线重量;血栓抑制率=(对照组血栓重-给药组血栓重)/对照组血栓重×100。
2.4 大鼠血瘀证模型试验
SD大鼠56只,♀♂各半,随机分为7组,分别为对照组、模型组、阿司匹林组、SECG组、SME高、中、低剂量组。灌胃给药14 d,每天1次,给药的第13天按照文献方法[5]采用皮下注射肾上腺素(Adr)方法造血瘀模型,造模后禁食12h过夜,次日清晨给药后40min,乙醚麻醉,腹主动脉取血4.5 mL至3.8%0.5 mL枸橼酸钠抗凝管中,800 r/min 10 min,吸取黄色上清液,为富含血小板血浆(PRP);剩余液体再3 000 r/min 8 min,吸取上清液为贫血小板血浆(PPP)。使用血小板聚集仪,测定血小板聚集率。
2.5 大鼠心肌缺血再灌注试验
动物分组与2.4项相同。灌胃给药1次/d,连续14 d,末次给药后40 min,大鼠经腹腔注射20%戊巴比妥(45 mg/kg)麻醉后,切开气管进行人工机械通气(呼吸频率60次/min,潮气量1.2 L/kg),沿胸骨左缘第四肋骨间开胸,参照文献方法[6],建立左冠状动脉前降支结扎-开放心肌缺血-再灌注模型。
(1)生化指标的测定:颈动脉取血按照试剂盒说明分别测定血清乳酸脱氢酶(LDH)、肌酸磷酸激酶(CK)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,按照说明书使用放免法测定肿瘤坏死因子(TNF-α)。
(2)心肌梗死面积的测定:取出心脏,切片,TTC磷酸盐缓冲液染色,10%甲醛固定24 h,呈深红色区域为非缺血区,而未被TTC染色的白色区域代表梗死区。沿着不同颜色的边缘切下不同区域并称重,分别以心肌梗死区重量(infarct weight,IW)占左室重量(weight of left ventrieular,WLV)的百一分比(IW/WLV)%、(WR/WLV)%反映心肌梗死范围。
(3)聚合酶链式反应(Polymerase Chain Reaction,PCR):取心肌缺血再灌注区域的心脏组织,按异硫氰酸胍—酚—氯仿一步法提取总RNA。用核酸、蛋白质含量测定仪检测浓度及纯度,并将mRNA调至1 g/L,-70℃保存备用。反转录-多聚酶链式反应(RT-PCR)中大鼠TNF-α的cDNA引物序列为,上游:5′-GGCTGTACCTTATCTACTCC-3′,下游:5′-TGACTCCAAAGTAGACCTGC-3′,cDNA 扩增产物长度为300 bp;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的 cDNA引物序列为,上游:5′-GGTGCTGAGTATGTCGTGGA-3′,下 游:5′-ATGCAGGGATGATGTTCTGG-3′,cDNA扩增产物长度为356 bp。上述目的cDNA的PCR扩增条件为:分别经过94℃ 30sec,60℃ 30sec,72℃ 1 min热循环,循环 30轮,终止延伸 72℃5min。PCR产物于1%琼脂糖凝胶电泳,结束后于全自动凝胶成像分析系统进行灰度扫描,并计算各组相对灰度值(计算公式:相对灰度值=各组对应泳道灰度值/对应泳道GAPDH灰度值)。
(4)免疫印迹分析(Western blot analysis):采用参考文献方法[7]提取核蛋白,各样本取定量核蛋白于10%聚丙烯酰胺凝胶进行电泳,分离的核蛋白随后通过Biorad半干转印系统电转印30 min至PVDF膜,膜在封闭液中(10%脱脂奶粉溶于Tris盐水缓冲液-PBS定容)37℃作用1 h封阻非特异性结合。一抗用PBST(PBS 990 mL-1%Tween-20 10 mL)稀释至工作液浓度,1 500 μL/条,37℃恒温摇床反应1 h。反应结束后,用 PBST清洗3次,每次10 min。用PBST稀释二抗至工作液浓度,1500 μL/条,37℃恒温摇床反应1 h(避光)。PBST洗膜2次,PBS洗膜一次,每次10 min。用Odyssey近红外荧光扫描仪扫描进行定量分析。
2.6 结果统计学处理
3 结果
3.1 小鼠角叉莱胶足趾肿胀
试验结果表明,SECG组及SME的高、中剂量组均可以抑制角叉莱胶导致的小鼠足趾肿胀,显著提高小鼠足趾肿胀的炎性渗出物中PGE2含量(P<0.01)。其中SME中剂量组与SECG组具有明显差异(P<0.01),说明相同剂量下,SME的效果明显优于SECG(见表1)。
表1 SME对角叉莱胶致小鼠足趾肿胀的影响(±s,n=10)Table.1 Effect of SME on carrageenan-induced paw edema

表1 SME对角叉莱胶致小鼠足趾肿胀的影响(±s,n=10)Table.1 Effect of SME on carrageenan-induced paw edema
与对照组比较,*P<0.05;与对照组比较,**P<0.01;与SECG组比较,#P<0.05;与SECG组比较,##P<0.01。
组别 给药量/(mg/kg) 肿胀度/% PGE2吸光度/(A/g) PGE2浓度/(A/g)对照组-23.4±3.6 0.170±0.027 1.112±0.211阿司匹林组 200 9.7±3.7** 0.122±0.017** 0.764±0.106**SECG组 30.90 18.8±4.6* 0.140±0.014** 0.896±0.090**SME组 15.45 25.6±7.5 0.155±0.014 1.110±0.100 30.90 14.7±4.6**# 0.123±0.013**## 0.809±0.086**#61.80 8.8±2.6** 0.115±0.016** 0.708±0.081**
3.2 小鼠凝血时间试验
结果表明,SECG组及SME各个剂量组均可以延长小鼠的凝血时间(P<0.01)。其中SME中剂量组与SECG组具有明显差异(P<0.01),说明相同给药剂量下,SME组的效果优于SECG组(见表2)。
表2 SME对小鼠凝血时间的影响(±s,n=10)
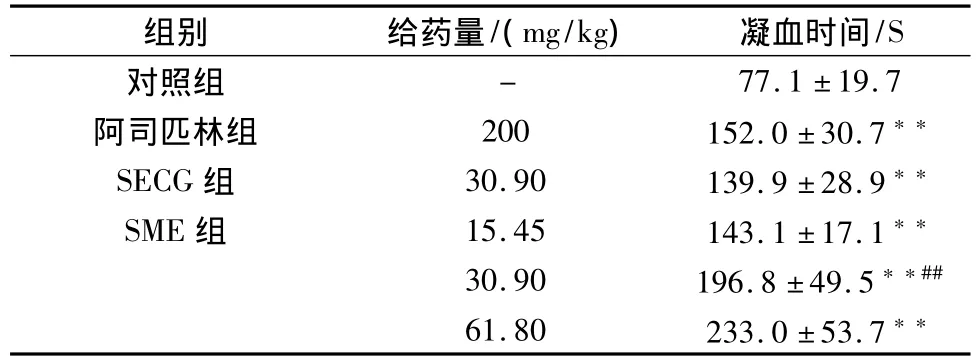
表2 SME对小鼠凝血时间的影响(±s,n=10)
与对照组比较,**P<0.01;与SECG组比较,##P<0.01。
组别 给药量/(mg/kg) 凝血时间/S对照组-77.1±19.7阿司匹林组 200 152.0±30.7**SECG组 30.90 139.9±28.9**SME组 15.45 143.1±17.1**30.90 196.8±49.5**##61.80 233.0±53.7**
3.3 大鼠动静脉旁路血栓试验
结果表明,SECG组及SME高、中剂量组均可以抑制血栓形成(P<0.05,P<0.01)。其中SME中剂量组与SECG组具有明显差异(P<0.05),说明相同剂量下,SME组的效果优于SECG组(见表3)。

表3 SME对大鼠动静脉旁路血栓形成的影响(¯x ±s,n=10)Table.3 Effect of SME on thrombus in arteriovenous shut of rats
3.4 大鼠血瘀证模型试验
结果表明,SECG组及SME高、中、低等剂量组均可以抑制血小板聚集(P<0.01),其中SME中剂量组与SECG组具有明显差异(P<0.05),说明相同剂量下,SME的抑制血小板聚集的影响强于SECG(见表4)。
表4 SME对大鼠血瘀证模型血小板聚集的影响(¯ ±s,n=10)Table.4 Effect of SME on anti-platelet aggregation in modle of blood stasis of rats
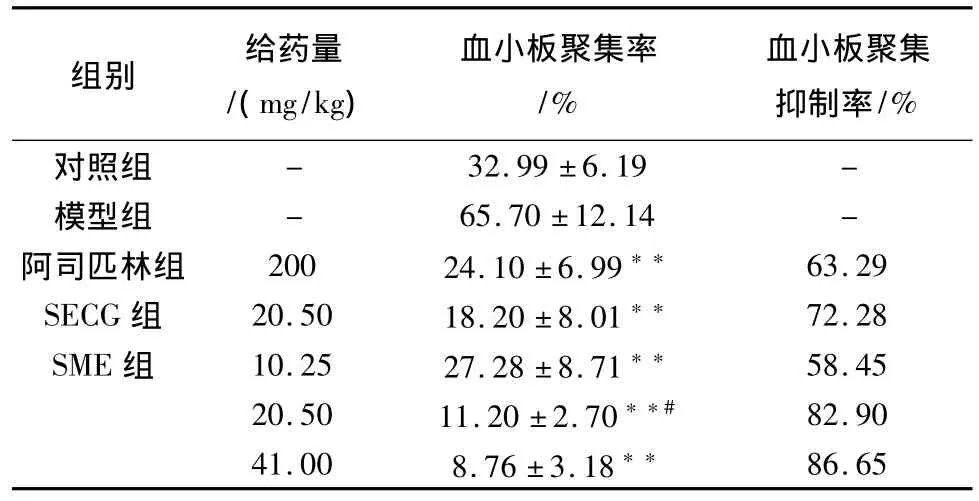
表4 SME对大鼠血瘀证模型血小板聚集的影响(¯ ±s,n=10)Table.4 Effect of SME on anti-platelet aggregation in modle of blood stasis of rats
与模型组比较,**P<0.01;与SECG组比较,#P<0.05。
组别 给药量/(mg/kg)血小板聚集率/%血小板聚集抑制率/%对照组-32.99±6.19 -模型组 - 65.70±12.14 -阿司匹林组 200 24.10±6.99** 63.29 SECG组 20.50 18.20±8.01** 72.28 SME组 10.25 27.28±8.71** 58.45 20.50 11.20±2.70**# 82.90 41.00 8.76±3.18**86.65
3.5 大鼠心肌缺血再灌注模型试验
3.5.1 SME对大鼠心肌缺血再灌注模型心肌损伤后生化指标的影响
结果表明,SECG组、SME组均能明显抑制大鼠血清LDH、CK活性、MDA含量的升高并增强心肌组织SOD活性(P<0.01);与SECG相比,相同给药量时SME能更明显的抑制大鼠血清LDH、CK及心肌组织MDA含量的升高,并增强心肌组织SOD活性(P <0.05,P <0.01)(见表5)。
表5 SME对大鼠心肌缺血再灌注模型心肌损伤后生化指标的影响(±s,n=8)Table.5 Effect of SME on CK,LDH,SOD activity and the content of MDA of rats in ischemia-reperfusion injury

表5 SME对大鼠心肌缺血再灌注模型心肌损伤后生化指标的影响(±s,n=8)Table.5 Effect of SME on CK,LDH,SOD activity and the content of MDA of rats in ischemia-reperfusion injury
与对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与SECG组比较,$P<0.05,$$P<0.01。
组别 给药量/(mg/kg) CK/(U/mL) LDH/(U/L) SOD/(U/mL) MDA/(nmol/mL)对照组-1.11±0.24 5409±354 148.1±8.6 2.56±0.41模型组 - 3.26±0.24## 7 525±525## 77.8±5.6## 6.21±0.77##SECG组 20.5 2.12±0.18** 6 125±226** 112.4±10.2** 3.73±0.38**SME组 20.5 1.43±0.25**$$ 5 408±296**$$ 122.6±8.2**$ 2.71±0.48**$$
3.5.2 SME对心肌缺血再灌注模型造模后心肌梗死面积的影响
结果表明,与对照组比较,心肌缺血再灌注造模后,模型组心肌梗死面积急剧升高(P<0.01),SECG组、SME组均能明显减少心肌梗死面积(P<0.01);相同给药量时SME比SECG能更明显的减少心肌梗死面积(P<0.05)(见图1,表6)。
3.5.3 SME对心肌缺血再灌注模型造模后血清TNF-α和心肌缺血再灌注区域TNF-α mRNA表达的影响

图1 SME对心肌缺血再灌注造模后心肌梗死面积的影响(±s,n=8)Fig.1 Effect of SME on the infraction size of rats in ischemia-reperfusion injury
表6 SME对大鼠心肌缺血再灌注模型心肌梗死面积、TNF-α、缺血再灌注区域TNF-α的mRNA表达和 NF-кB 蛋白表达的影响( ±s,n=8)Table.6 Effect of SME on the infraction size,TNF-α,TNF-α mRNA expression and NF-кB proteins expression of rats in ischemia-reperfusion injury
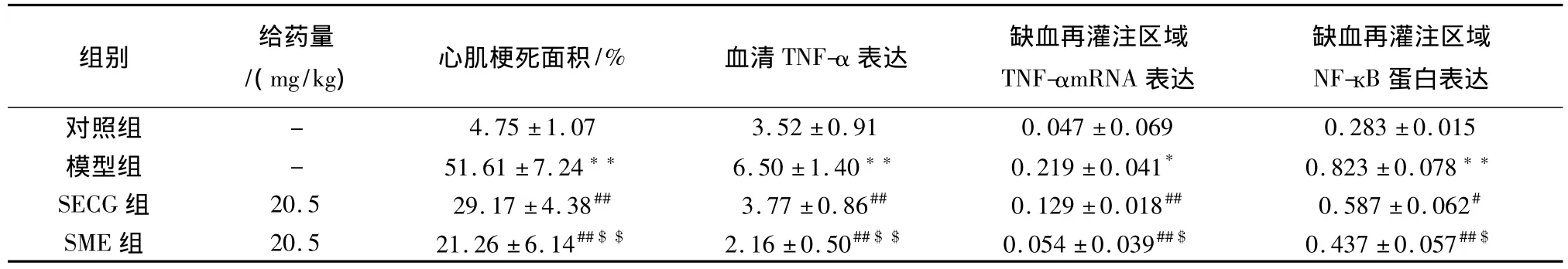
表6 SME对大鼠心肌缺血再灌注模型心肌梗死面积、TNF-α、缺血再灌注区域TNF-α的mRNA表达和 NF-кB 蛋白表达的影响( ±s,n=8)Table.6 Effect of SME on the infraction size,TNF-α,TNF-α mRNA expression and NF-кB proteins expression of rats in ischemia-reperfusion injury
与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与SECG组比较,$P<0.05,$$P<0.01。
组别 给药量15模型组 - 51.61±7.24** 6.50±1.40** 0.219±0.041* 0.823±0.078**SECG组 20.5 29.17±4.38## 3.77±0.86## 0.129±0.018## 0.587±0.062#SME组 20.5 21.26±6.14##$$ 2.16±0.50##$$ 0.054±0.039##$ 0.437±0.057蛋白表达对照组 - 4.75±1.07 3.52±0.91 0.047±0.069 0.283±0.0/(mg/kg) 心肌梗死面积/% 血清TNF-α表达 缺血再灌注区域TNF-αmRNA 表达缺血再灌注区域NF-кB##$
结果显示,与对照组比较,心肌缺血再灌注造模后,模型组大鼠血清中TNF-α含量急剧升高(P<0.01),而SECG、SME均能明显抑制血清TNF-α含量的升高(P<0.01),并使心肌缺血再灌注区域TNF-α mRNA表达显著减少(P <0.05,P <0.01)。与SECG相比,相同给药量时SME能更明显抑制血清TNF-α含量的升高(P<0.05),并使心肌缺血再灌注区域TNF-α mRNA表达显著减少(P<0.05)(见图2,表6)。
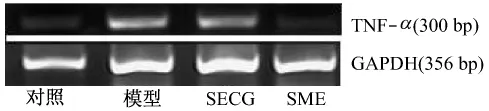
图2 SME对心肌缺血再灌注区域TNF-α mRNA表达的影响(±s,n=8)Fig.2 Effect of SME on TNF-α mRNA expression of of rats in ischemia-reperfusion injury
3.5.4 SME对心肌缺血再灌注造模后心肌缺血再灌注区域NF-кB蛋白表达的影响(图3)

图3 SME对心肌缺血再灌注造模后心肌缺血再灌注区域NF-кB蛋白表达的影响( ± s,n=8)Fig.3 Effect of SME on NF-кB proteins expression of rats in ischemia-reperfusion injury
结果表明,心肌缺血再灌注造模后,模型组大鼠缺血再灌注心肌区域NF-кB蛋白表达明显增加(P<0.05),SECG组和SME组均能显著降低大鼠心肌缺血再灌注区域NF-кB蛋白表达(P<0.05,P<0.01);与SECG相比,相同给药量时SME能更明显的抑制心肌缺血再灌注区域NF-кB蛋白表达(P<0.05)(见图 3,表6)。
4 讨论
中药制成W/O微乳制剂口服时,不但能够增加疏水性药物的溶解度,如 HSYA[8,9];还可以因为将药物包裹在微乳中从而避免胃肠道中代谢酶的降解,同时因为微乳的表面张力较低而易于通过胃肠壁的水化层,使药物能够直接与胃肠上皮细胞接触,从而促进药物的吸收。此外,微乳制剂也可经淋巴管吸收,克服了肝脏的首过效应,从而提高了药物的生物利用度[10]。Lyons等将易受胃肠道酶降解的N-乙酰基葡萄糖-N-乙酰基胞壁酰二肽(GMDP)制成含中等链长脂肪酸的W/O微乳剂,其生物利用度从水溶液的(8.3±4.4)%提高到微乳剂型的(80.1 ±30.4)%[11]。
实验结果说明,舒胸片微乳剂型与有效成分组均能够使前列环素PGE2升高,抑制足趾肿胀、抑制血栓形成、延长凝血时间和抵抗由ADP引起的血小板聚集,改善血液微循环,并且统计结果显示微乳化剂型优于有效成分组,微乳化剂型的药效与剂量呈依赖性,高中低剂量具有明显的量效关系。同时微乳化剂型和有效成分组均能使心肌缺血再灌注过程中的各种内源性抗氧化酶如SOD升高;使得脂质过氧化产物MDA的生成减少;使肌酸激酶CK、乳酸脱氢酶LDH的活性降低,减少心肌梗死后的染色面积;使炎症调节因子TNF-α血清中水平降低,心肌再灌注区域TNF-α的mRNA表达减少;使再灌注区域的核转录因子NF-кB的蛋白表达抑制。研究结果提示SME与SECG保护缺血再灌注心肌的作用机理,与抑制NF-кB信号通路活化,阻断TNF-α的基因表达,从而保护内皮细胞和心肌细胞损伤有关[12-13]。结果分析说明,微乳化剂型的药效学作用比有效成分组更加明显,并且在设置了高、中、低剂量的实验中具有良好量效关系,这可能和微乳化剂型能够增加其有效成分的体内吸收,增加其生物利用度有关。
我们前期研究先将SXT制成SECG,两者在抗炎、镇痛、抗凝血、抗血栓和心肌保护试验中作用结果相同,量效关系相近,作用结果一致,研究结果显示SECG可代替原处方SXT;此次研究再将SECG制成SME进行研究,得到结论说明微乳化剂型药效学作用更佳,说明在中药制剂中引进微乳技术,可利用其优势解决某些问题,这可能是一个新的方向,但是还需要进一步的研究证明。
[1]常海涛.中药红花化学成分及药理作用[J].国外医药植物药分册,1999,14(5):201-203.
[2]张剑峰,张丹参.三七总皂苷药理作用研究进展[J].医学综述,2007,13(6):472-474.
[3]舒 冰,周重建.中药川芎中有效成分的药理作用研究进展[J].中国药理学通报,2006,22(9):1043-1047.
[4]魏 巍,傅继华.有效成分组替代舒胸片原复方可行性的药效学探讨[J].中成药,2008,30(12):1748-1753.
[5]徐叔云,卞如濂,陈 修.药理试验方法学[M].第3版.北京:人民卫生出版社,2002:911-915.
[6]张本静,王炎林,王成夭.参附注射液对大鼠急性缺血/再灌注损伤心肌核转录因子-κβ的影响[J].中国临床药理学与治疗学,2005,10(3):306-309.
[7]Barnes PJ.Adcock IM.NF-κB:a pivotal role in asthma and a newtarget for therapy[J].Trends Pharmacol Sci,1997,18(2):B46-50.
[8]张海防,郭健新,平其能.羟基红花黄色素A在大鼠体内的药代动力学[J].中国药科大学学报,2006,5(16):456-460.
[9]王淑静,孙敏捷,平其能.羟基红花黄色素A磷脂复合物的制备及理化性质研究[J].药学与临床研究,2008,16(1):1-4.
[10]Myers,R.A.,Stella,V.J.Factors affecting the lymphatic transport of penclomedine(NSC-338720),liposomecyto toxic drug:comparison to DDT and hexachlorobenzene[J].Inter J Pharm,1992,80(1):51-62.
[11]Lyons KC,Charman WN,Miller R.Factors limiting the oral bioavailability of N-acetylglucosaminyl-N-acetylmuramy dipeptide(GMDP)and enhancement of absorption in rats by delivery in water-in-oil microemulsion[J].Int J Pharm,2000,199(1):17-28.
[12]Belosjorow S,Bolle I,Duschin A,et al.TNF-alpha anti-bodies are as effective as ischemic preconditioning in reducing infarct size in rabbits[J].Am J Physiol Heart Circ Physiol,2003,284(3):927-930.
[13]Li C,Browder W,Kao R.Early activation of transcription factor NF-кB during ischemia in perfused rat heart[J].Am J Physiol,1999,276:H543-H552.
