颌下径路阻塞咽鼓管创建大鼠分泌性中耳炎模型△
2010-01-25乔振花戴艳红徐琳佘万东
乔振花 戴艳红 徐琳 佘万东
分泌性中耳炎(otitis media with effusion,OME)最常见病因为咽鼓管阻塞或功能不良。国内外有数种方法创建OME模型用于研究该疾病,但国内创建模型的方法多为经鼓膜直接注射致病因子,诱发感染及变态反应导致中耳积液的产生[1],也有经手术切断颚帆张肌和翼突钩,或切断支配它的三叉神经分支等破坏咽鼓管的功能以诱发中耳积液产生的方法[2]。本研究拟经颌下径路阻塞咽鼓管骨性部分以非化学方法建立OME动物模型,旨在为研究OME可能导致的内耳损伤提供无化学因素干扰的动物模型。
1 材料与方法
1.1动物选择及模型建立[3]选择清洁级雄性SD大鼠24只,2月龄,体重180~220 g,南京大学附属鼓楼医院实验动物中心提供。所有动物耳廓反射灵敏,耳镜检查外耳道清洁,鼓膜标志清晰,ABR和声导抗检测正常。右耳为实验组(n=24),左耳为空白对照组(n=24)。取每只大鼠右侧耳手术造模,2%戊巴比妥钠(40 mg/kg)腹腔麻醉,将麻醉好的动物仰卧位安置于手术台上,剃去颈部的毛发,皮肤用1%聚维酮碘溶液消毒。在下颌弓下0.5 cm处作一与下颌弓平行、1.5~2.0 cm长的横形切口,钝性分离皮下组织,暴露右侧听泡腹侧面。确认咽鼓管的骨性部分后,在其上钻孔,并用消毒过的直径1~2 mm的木塞阻塞该孔(图1),术后用75%酒精溶液消毒切口并缝合,在电烤灯下保温直至动物完全从麻醉中清醒,随后送至笼中饲养。术后常规肌肉注射青霉素5天(20万U·kg-1·d-1)。于术后14、21、30、60 d分别行双侧ABR及声导抗检测,以ABR阈值升高、出现“B”型鼓室导抗图作为OME造模成功的客观依据,在耳内镜下观察鼓膜,并排除术后乳突炎和化脓性中耳炎的动物。
1.2ABR检测 测试在隔声屏蔽室进行。2%戊巴比妥钠40 mg/kg腹腔注射,采用头皮针形电极,记录电极置于颅顶中线,参考电极置给声侧耳后,零极置鼻根部。短声刺激,经耳机给声,刺激频率为13.1次/秒,带通滤波150~1 500 Hz,叠加次数为1 024次,记录时程10 ms。记录ABR反应阈及90 dB SPL声刺激时ABR波I、III潜伏期及Ⅰ-Ⅲ波间期。以波Ⅲ作为判断反应阈的依据。
1.3声导抗测试 以2%戊巴比妥钠40 mg/kg腹腔注射麻醉,待充分麻醉后,清除外耳道耵聍。应用与郭志强等[4]相似的方法即:应用GSI-33VersionⅡ型中耳分析仪做鼓室导抗图测试,将内径约2 mm自制橡胶探头套于与之匹配的婴儿探头之外,使之可与大鼠外耳道完全密封。将大鼠头部用自制头架固定,探测音为226 Hz、85 dB SPL,压力变化范围从+200 daPa~-400 daPa,压力变化速度400 daPa/s, 图上直接读出声导纳值(ml)、峰值(daPa)、耳道容积值(ml)及梯度值(daPa)。图型按Linen/Jerger分类法[5]分类。
1.4中耳粘膜标本制作 将测得B型曲线后的动物麻醉后固定,心内灌注4℃4%多聚甲醛,断头,取双侧听泡,听泡用4℃4%多聚甲醛灌注,石蜡包埋、切片机切片,常规脱蜡后行HE染色,光镜下观察。
1.5统计学方法 所有数据采用SSPS11.0软件进行配对t检验统计分析。
2 结果
2.1两组大鼠声刺激强度为90 dB时ABR波Ⅰ、Ⅲ潜伏期及反应阈见表1。
2.2鼓室导抗图测试结果 实验组ABR反应阈高于对照组(P<0.05),波I、III潜伏期较对照组长(P<0.05),I-III波间期两组无显著差异。对照组大鼠麻醉状态下均为A型或As型图(本文统称为有峰型),对照组大鼠声导纳值、峰压值、耳道容积及梯度值分别为0.57±0.09 ml、-21.00±24.24 daPa、0.42±0.07 ml和273.71±31.19 daPa,峰压值在-50~+50之间的占95%(表2)。实验组24耳中20耳鼓室导抗图为平坦型(B型图)(16耳于14 d时测得,3耳于21 d时测得,1耳于30 d时测得),2耳60 d时仍为有峰型图,判为造模不成功,1耳为化脓性中耳炎,1耳为化脓性乳突炎,无动物死亡,造模成功率为83.3%(20/24)。
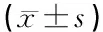
表1 两组大鼠ABR反应阈(dB SPL)及90 dB SPL声刺激时波Ⅰ、Ⅲ潜伏期、Ⅰ-Ⅲ波间期(ms)比较
注:*与对照组比较,P<0.05
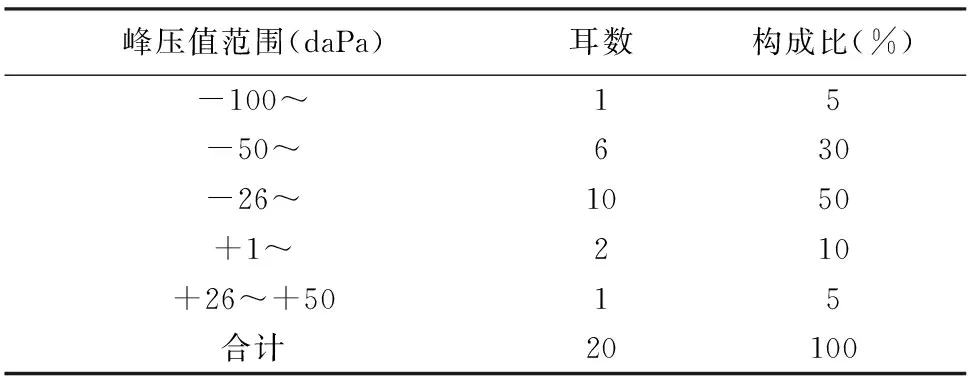
表2 正常大鼠鼓室峰压值分布范围
2.3光镜下见对照组咽鼓管黏膜细胞核排列整齐,皮下为致密纤维结缔组织,血管甚少,紧贴于软骨表面,无炎性细胞(图2);而实验组咽鼓管黏膜上皮层次增多,炎性细胞浸润明显,黏膜下毛细血管扩张充血,明显增生(图3)。对照组中耳黏膜下层有少许纤维母细胞和少许胶原纤维以及中性多形核白细胞、淋巴细胞,纤毛排列整齐(图4);实验组中耳腔黏膜出现成纤维细胞增生,新生血管增多,单核巨噬细胞浸润,中耳黏膜明显增厚,纤毛倒伏、缺失(图5、6)。
3 讨论
OME发病机制复杂,普遍认为可能与咽鼓管通气功能不良、细菌病毒感染及免疫功能紊乱相关[6]。目前构建OME动物模型的方法有:①经鼓膜直接注射卵蛋白、肺炎链球菌血清、有荚膜或无荚膜细菌、死菌或脂多糖等,通过诱发感染及变态反应途径导致中耳腔产生积液,但此法可造成鼓膜完整性的破坏,易引起术后注射部位愈合不良、局部反应较重、中耳腔感染播散等,而导致造模成功率下降[1]。②破坏咽鼓管的通气功能。常用两种方法:一是阻塞咽鼓管咽口,如用化学制剂或电灼致咽鼓管口疤痕粘连而阻塞,或者用弹性材料封堵咽鼓管咽口;二是破坏咽鼓管的开放功能,如手术切断颚帆

图1 手术图示 图2 对照组咽鼓管黏膜(HE×400) 图3 模型组咽鼓管黏膜(HE×400)
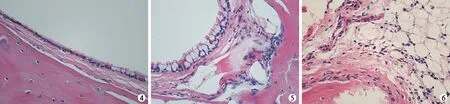
图4 对照组中耳腔黏膜(HE×400) 图5 模型组中耳腔黏膜(HE×400) 图6 模型组中耳腔黏膜(HE×400)
张肌和翼突钩,或切断支配它的三叉神经分支等。该方法手术创伤较大,操作困难,动物会因术中、术后窒息或因疼痛影响动物进食、术后急性肺水肿等死亡,故死亡率较高[7]。但若造模成功,中耳腔积液的产生率很高(80%)[2]。经腭径路和经下颌径路都是通过阻塞咽鼓管导致中耳积液而形成分泌性中耳炎,可以避免因化学及生物学因素导致的损伤。经颌下径路虽因打开了听泡有导致化脓性中耳炎的可能,但手术过程中如注意无菌操作,术后常规应用抗生素预防感染,可以降低化脓性中耳炎的发生率。且经颌下径路可避免术后疼痛影响动物进食、术中误吸血液而导致窒息的可能。本组24只大鼠(24耳),采用颌下径路阻塞咽鼓管的方法建立OME模型,动物无术中死亡,术后至少可以存活60 d。
本文结果可见,正常大鼠鼓室导抗图的峰压值为-21±24.24 daPa,在-50~+50之间的占95%,表明其咽鼓管功能良好。而实验组20耳鼓室导抗图为B型,说明木塞阻塞咽鼓管后,咽鼓管功能发生障碍,导致了中耳腔负压,最终导致中耳积液的产生。从两组的ABR反应阈来看,实验组手术后ABR反应阈明显提高,波Ⅰ、Ⅲ潜伏期显著延长,Ⅰ-Ⅲ波间期无明显变化,说明其听力下降主要为传导性聋,即鼓室积液导致鼓膜及圆窗膜振动受限所致[8]。说明OME模型成功建立。
从中耳粘膜的光镜下所见看,实验组大鼠咽鼓管上皮层次增多,小血管明显充血,鼓室黏膜上皮细胞明显增生,炎性细胞浸润明显,黏膜下毛细血管扩张充血,明显增生;术后四周出现成纤维细胞增生,新生血管增多,单核巨噬细胞浸润,中耳黏膜明显增厚,因此,组织学上也证实OME动物模型造成模成功。造模成功率为83.3%。
综上所述,通过颌下径路阻塞咽鼓管的方法可以影响咽鼓管的功能,从而能成功建立OME动物模型。
(致谢 :本文在实验期间得到了上海交通大学耳鼻咽喉科学研究所殷善开教授、王坚教授、黄艳艳老师的热心指导,在此表示感谢!)
4 参考文献
1 Piltcher OB,Swarts JD,Magnuson K. A rat model of otitis media with effusion caused by eustachian tube obstruction with and without streptococcus pneumonia infection: Method and disease course[J]. Otolaryngol Head Neck Surg,2002,126:490.
2 Tos M. Experimental tubal obstruction .Changes in middle ear mucosa elucidated by quantitative histology[J]. Acta Otolaryngol,1981, 92:51.
3 Yaman H,Oztur K,Uyar Y,et al. Effectiveness of corticosteroids in otitis media with effusion: an experimental study[J]. The Journal of Laryngology and Otology,2008, 122:25.
4 郭志强, 黄孝文, 崔永华,等. 实验性中耳积液大鼠的鼓室导抗图测试[J]. 听力学及言语疾病杂志,2003, 11:118.
5 钟乃川. 鼓室导抗图测试法(上)[J].听力学及言语疾病杂志,1995, 3: 42.
6 乔振花, 戴艳红, 佘万东. 分泌性中耳炎所致感音神经性聋发生机制的研究进展[J]. 山东大学耳鼻喉眼学报. 2009, 23:21.
7 Zhang Q, Liu C, Gao X,et al. Expression pattern of aquaporin 1 in the middle ear of the guinea pig with secretory otitis media [J]. ORL J Otorhinolaryngol,2009,71:70.
8 Coats AC,Martin JL. Human auditory nerve action potentials and brain stem evoked responses:Effects of audiogram shape and lesion location[J]. Arch Otolaryngol,1977, 103:605.
