吗替麦考酚脂治疗增殖性狼疮性肾炎的Meta分析
2010-01-24欧阳小琳黄献文邱梅冰
沈 琪 杨 彤 欧阳小琳 黄献文 邱梅冰
狼疮性肾炎(LN)是系统性红斑狼疮(SLE) 的主要临床表现和严重肾脏损害,其中1/2~2/3的病例可表现为增殖性狼疮性肾炎(PLN),是病情较重和治疗难度较高的类型[1,2]。一直以来,糖皮质激素加环磷酰胺(CTX)的治疗方案被认为是缓解疾病,避免复发的金标准[3]。近年来随着新型免疫抑制剂吗替麦考酚脂(MMF)的上市及治疗方案的改进,PLN患者的疗效得到进一步的改善。目前,关于MMF治疗PLN的疗效和安全性的Meta分析已有9项[4~12],但其纳入研究的来源和分析结果各不相同。Flanc等[7](2004)发表的Meta分析仅纳入1项研究,且样本量较小;欧三桃等[9](2006)发表的Meta分析纳入中英文文献9篇,反映当时的证据水平;Moore等[6](2006)发表的Meta分析仅纳入5篇英文文献;2007年,Zhu等[4]、Walsh等[5]及齐华林等[8]发表的Meta分析分别纳入3、4和4篇英文文献,均未纳入中文文献;殷蕾等[10](2008)发表的Meta分析纳入11篇文献,但英文文献纳入不全,且中文文献质量偏低;陈明玉等[11](2008)发表的Meta分析纳入10篇文献,实施地均在中国,未纳入实施地在国外的研究;在完成未研究文献检索后写作前的2009年8月Mak等[12]发表的Meta分析纳入10篇英文文献,3篇以摘要形式发表,其中1篇摘要目前已全文发表,未纳入中文文献。因此有必要对中英文发表的RCT研究进行更全面、更系统的检索来评价MMF治疗PLN的安全性及疗效,以期为临床医生治疗PLN提供更可靠的依据。
1 方法
1.1 纳入标准 同时符合以下条件的研究被纳入:①符合美国风湿病协会SLE的诊断标准,且病理类型为Ⅱ、Ⅲ或Ⅳ型LN的患者,年龄不限;②试验为RCT和半随机对照试验(quasi-RCTs);③干预措施:试验组予MMF+糖皮质激素治疗,对照组予CTX或CTX/硫唑嘌呤(AZA)+糖皮质激素治疗。
1.2 排除标准 ①继发于过敏性紫癜、肾淀粉样变性及病毒(如HIV、HBV、HCV和B19细小病毒)感染等引起的继发性肾病;②原发性肾病综合征及儿童先天性肾病综合征;③对照组及治疗组均使用MMF。
1.3 疗效判定指标
1.3.1 主要测量指标 终末期肾病(ESRD)发生率、病死率、完全缓解率和总缓解率(完全缓解率+部分缓解率)。
1.3.2 次要测量指标 部分缓解率、复发率、SCr倍增发生率和不良反应(如闭经、感染、WBC减少、带状疱疹和胃肠道反应等)发生率。
1.4 文献检索策略
1.4.1 数据库 Cochrane图书馆(2009年第2期)的临床对照试验中心资料库(CENIRAL)、PubMed、EMBASE、中国生物医学文献光盘数据库、中国期刊全文数据库和中国维普数据库,检索文献起止时间均从建库至2009年6月30日。还手工检索肾脏病会议论文和内部资料等灰色文献。通过检索电子期刊全文数据库或与作者联系索取全文。
1.4.2 检索策略 英文检索式:(lupus nephritis OR glomerulonephritis OR LN OR lupus) AND (cellecpt OR mycophenolate mofetil) AND (randomized controlled trial );中文检索式:随机对照试验AND(狼疮性肾炎OR肾病)AND(霉酚酸酯OR晓悉OR吗替麦考酚脂)。
1.5 文献纳入和排除及质量评价方法 由3位评价者完成,2位评价者独立完成检索和核对文献摘要,对于可能为RCT或在2位评价者中存在争议的文献,获取全文。原2位评价者按照Cochrane推荐的专用质量评价表和资料提取表(www.cochrane.org/resources/handbook/index.htm),独立进行质量评价和数据提取,交叉核对结果。对于非英文文献,先翻译成英文或中文再进行评价,文献中未表述清楚的内容直接与通讯作者联系。如遇分歧通过讨论解决或由第3位评价者协商解决。
1.6 统计学方法 采用RevMan 5.0软件进行Meta分析,计数资料采用比值比(OR)及其95%CI表示。对纳入研究的临床异质性和方法学异质性进行分析,按照临床异质性和方法学异质性进行亚组分析,并采用χ2检验分析各研究结果间的统计学异质性,当亚组内各研究间无统计学异质性(P≥0.1)时,采用固定效应模型分析;如研究间存在统计学异质性(P<0.1)时,采用随机效应模型分析。
2 结果
2.1 研究的一般情况 共检索到相关文献868篇,英文758篇,中文110篇。阅读题目和摘要,初筛出98篇提到随机的文献,阅读全文排除56篇,纳入35篇RCT文献、7篇Meta分析及Cochrane 系统评价全文;与作者联系后排除21篇RCT文献(18篇为回顾性研究,3篇纳入研究对象合并有其他肾病),最终14篇RCT文献[13~27]进入Meta分析 (表1)。其中英文文献10篇[13~23]、中文文献4篇[24~27],文献[14]是文献[13]的延续,但随访时间和终点指标不同,作为2篇文献处理;文献[19,20]为同一研究的草案及结果报告,进行合并分析;文献[21,23]以摘要形式发表,余为全文发表。共纳入1 032例PLN患者,11篇文献[15~18,20~24,26,27]采用MMF与CTX对照, 4篇文献[13,14,15,25]采用MMF与CTX/AZA对照。本研究所纳入的绝大多数为PLN成人患者,仅Appel等[19,20]纳入的为12岁以上患者、Ong等[17]纳入16岁以上患者;其余研究仅描述了患者的平均年龄,未单独报道患儿的数量及治疗情况。

2.2 文献质量 14篇文献均提及随机,其中2篇文献[17,20]采用了正确的随机化方法,5篇文献[13~16,22]采用了分配隐藏;纳入文献均未采用盲法或未提及;均报道了失访和退出情况,基线水平均具可比性。7篇文献[13~17,20,22]评为B级,7篇文献[18,21, 23~27]评为C级(表2)。

表2 纳入14项RCT研究的质量评估
2.3 MMF与CTX或CTX/AZA对照治疗PLN疗效的Meta分析 对报道MMF与CTX对照治疗PLN疗效的文献行漏斗图检验,提示存在一定的发表偏倚(图1),存在灰色文献未发表的可能。
2.3.1 ESRD发生率 由图2可见,3篇文献报道了MMF组和CTX组、2篇文献报道了MMF组和CTX/AZA组ESRD发生率。异质性检验P分别为0.91和0.21,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=0.45,95%CI:0.16~1.25;后者OR=0.62,95%CI:0.10~3.82。提示MMF组ESRD发生率和CTX组(6/118vs12/114,P=0.13)或CTX/AZA组(1/53vs2/50,P=0.61)差异均无统计学意义。
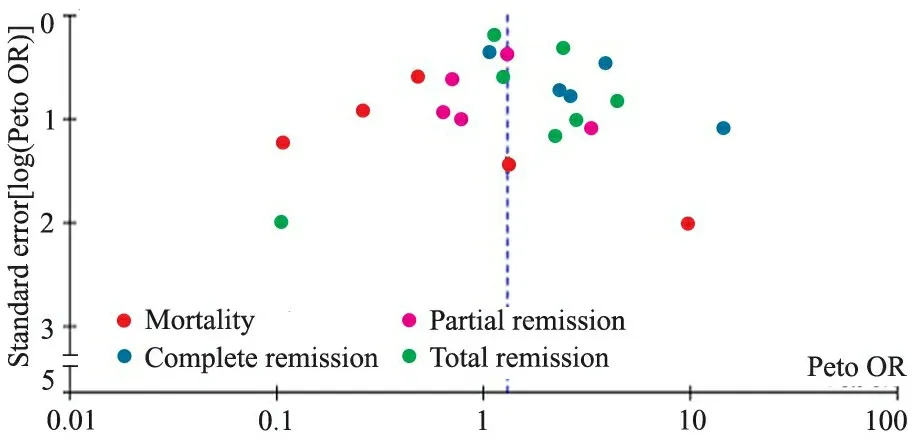
图1 MMF与CTX对照治疗PLN疗效的漏斗图
Fig 1 Funnel plot of MMFvsCTX efficacy in the treatment of PLN

图2 MMF组与CTX组、CTX/AZA组ESRD发生率的Meta分析
Fig 2 Meta analysis of ESRD rates in MMF and CTX, CTX/AZA groups
2.3.2 病死率 由图3可见,6篇文献报道了MMF组和CTX组、4篇文献报道了MMF组和CTX/AZA组的病死率,异质性检验P分别为0.22和0.51,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=0.77,95%CI:0.40~1.48;后者OR=0.34,95%CI:0.09~1.29。提示MMF组病死率和CTX组(16/325vs21/334,P=0.44)或CTX/AZA组(1/99vs6/92,P=0.11)差异均无统计学意义。

图3 MMF组与CTX组、CTX/AZA组病死率的Meta分析
Fig 3 Meta analysis of mortalities in MMF and CTX, CTX/AZA groups
2.3.3 完全缓解率 由图4可见,6篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组的完全缓解率。异质性检验P分别为0.19和0.91,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=2.16,95%CI:1.31~3.55;后者OR=1.11,95%CI:0.52~2.34。提示MMF组完全缓解率显著高于CTX组,61/314vs37/320,P=0.002;与CTX/AZA组差异无统计学意义,61/79vs55/73,P=0.79。

图4 MMF组和CTX组、CTX/AZA组完全缓解率的Meta分析
Fig 4 Meta analysis of complete remission rates in MMF and CTX, CTX/AZA groups
2.3.4 部分缓解率 由图5可见,6篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组的部分缓解率。异质性检验P分别为0.83和0.99,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=1.11,95%CI:0.80~1.54;后者OR=1.09,95%CI:0.47~2.48。提示MMF组部分缓解率和CTX组(122/314vs117/320,P=0.55)或CTX/AZA组(15/79vs13/73,P=0.85)差异均无统计学意义。
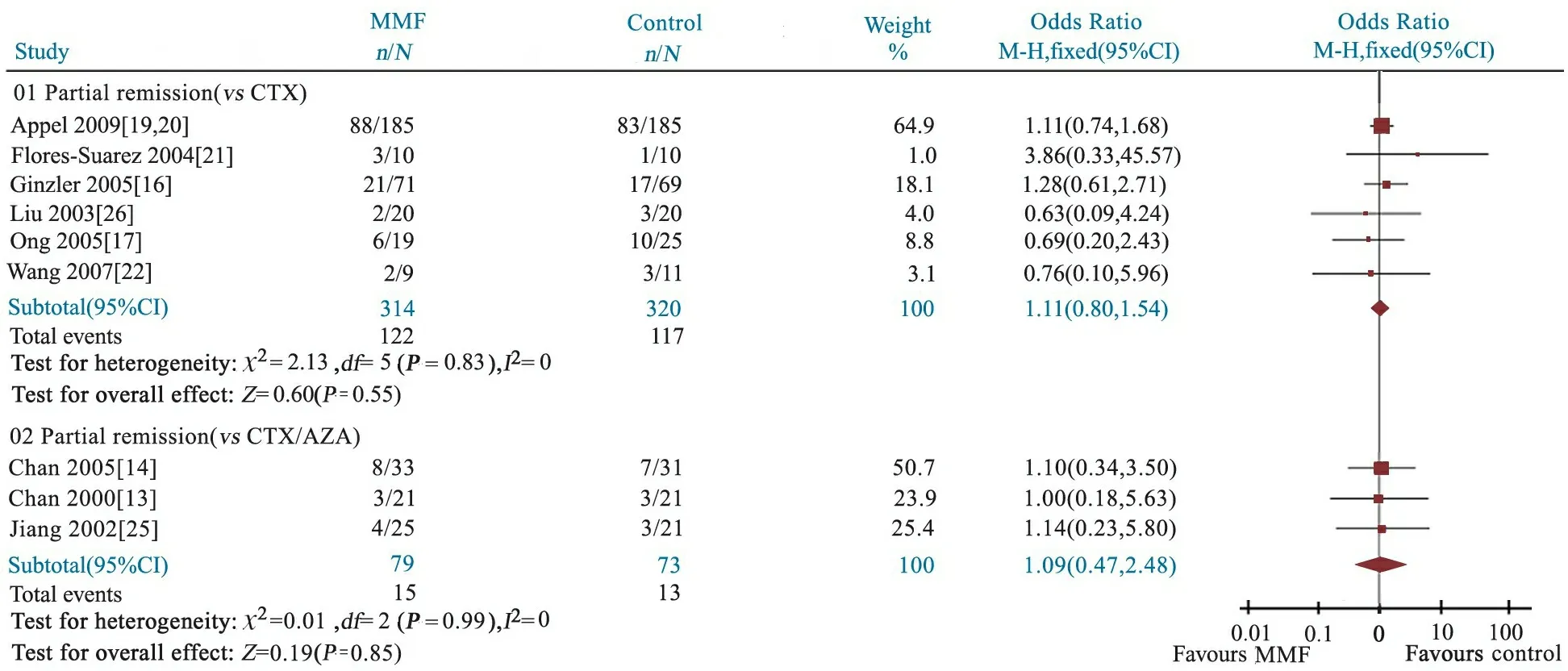
图5 MMF组与CTX组、CTX/AZA组部分缓解率的Meta分析
Fig 5 Meta analysis of partial remission rates in MMF and CTX, CTX/AZA groups
2.3.5 总缓解率 由图6可见,8篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组的总缓解率。异质性检验P分别为0.25和0.90,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=1.51,95%CI:1.10~2.07;后者OR=1.87,95%CI:0.43~8.13。提示MMF组总缓解率显著高于CTX组,237/370vs209/377,P=0.01;与CTX/AZA组差异无统计学意义,76/79vs68/73,P=0.40。

图6 MMF组与CTX组、CTX/AZA组总缓解率的Meta分析
Fig 6 Meta analysis of total remission rates in MMF and CTX, CTX/AZA groups
2.3.6 复发率 由图7可见,4篇文献报道了MMF组和CTX/AZA组的复发率,异质性检验P=0.64,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.98,95%CI:0.47~2.02,提示MMF组复发率和CTX/AZA组差异无统计学意义,20/93vs19/85,P=0.95。
2.3.7 SCr倍增发生率 由图7可见,2篇文献报道了MMF组和CTX/AZA组SCr倍增发生率,异质性检验P=0.79,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.69,95%CI:0.15~3.25,提示两组SCr倍增发生率差异无统计学意义,3/53vs4/50,P=0.64。
2.4 MMF与CTX或CTX/AZA对照治疗PLN安全性的Meta分析 对报道MMF与CTX对照治疗PLN安全性的文献行漏斗图检验,提示存在一定的发表偏倚,存在灰色文献未发表的可能(图8)。


图7 MMF组与CTX/AZA组复发率和SCr倍增发生率的Meta分析
图8 MMF与CTX对照治疗PLN安全性的漏斗图
Fig 8 Funnel plot of MMFvsCTX safety in the treatment of PLN
2.4.1 胃肠道反应发生率 由图9可见,8篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组胃肠道反应的发生率。异质性检验P分别为0.27和0.87,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=1.03,95%CI:0.75~1.40;后者OR=2.08,95%CI:0.66~6.51。提示MMF组胃肠道反应发生率与CTX组(175/357vs175/363,P=0.87)或CTX/AZA组(10/74vs5/71,P=0.21)差异均无统计学意义。
2.4.2 闭经的发生率 由图10可见,5篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组闭经的发生率。异质性检验P分别为0.91和0.21,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=0.16,95%CI:0.05~0.50;后者OR=0.20,95%CI:0.07~0.61。提示MMF组闭经发生率显著低于CTX组(3/123vs18/134,P=0.002)或CTX/AZA组(4/67vs16/62,P=0.005)。
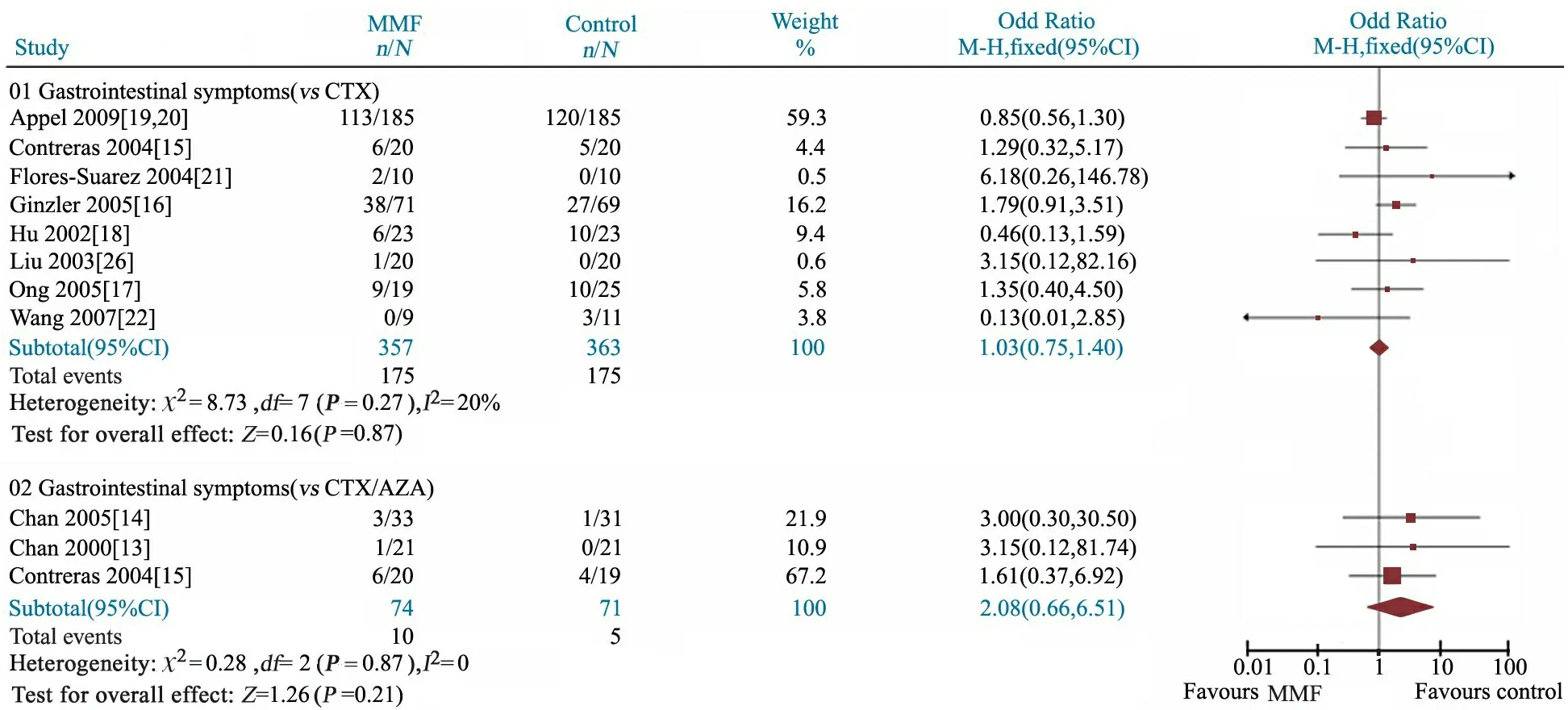

图9 MMF组与CTX组、CTX/AZA组胃肠道反应发生率的Meta分析
图10 MMF组与CTX组、CTX/AZA组闭经发生率的Meta分析
Fig 10 Meta analysis of amenorrhea rates in MMF and CTX,CTX/AZA groups
2.4.3 带状疱疹的发生率 由图11可见,9篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组带状疱疹的发生率。异质性检验P分别为0.32和0.49,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=0.62,95%CI:0.34~1.13;后者OR=0.72,95%CI:0.25~2.04。提示MMF组带状疱疹的发生率与CTX组(17/222vs28/224,P=0.12)或CTX/AZA组(7/74vs9/71,P=0.54)差异均无统计学意义。

图11 MMF组与CTX组、CTX/AZA组带状疱疹发生率的Meta分析
Fig 11 Meta analysis of herpes zoster rates in MMF and CTX,CTX/AZA groups
2.4.4 感染的发生率 由图12可见,9篇文献报道了MMF组和CTX组感染的发生率,异质性检验P=0.000 8,有统计学异质性,采用随机效应模型分析。Meta分析结果显示,OR=0.79,95%CI:0.58~1.07,提示MMF组感染的发生率与CTX组差异无统计学意义,187/371vs206/377,P=0.13。考虑研究间具统计学异质性,剔除文献[19,20]进行敏感度分析,异质性检验P=0.19,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.38,95%CI:0.23~0.61,提示MMF组感染的发生率显著低于CTX组,61/186vs96/192,P<0.000 1(图13)。
3篇文献报道了MMF组和CTX/AZA组感染发生率。异质性检验P=0.21,采用固定效应模型。结果显示,OR=0.46,95%CI:0.22~0.99。提示MMF组感染发生率显著低于CTX/AZA组,14/74vs24/71,P=0.05(图12)。
2.4.5 WBC减少的发生率 由图14可见,9篇文献报道了MMF组和CTX组、3篇文献报道了MMF组和CTX/AZA组WBC减少的发生率。异质性检验P分别为0.78和0.57,无统计学异质性,均采用固定效应模型分析。Meta分析结果显示,前者OR=0.43,95%CI:0.27~0.71;后者OR=0.12,95%CI:0.03~0.52。提示MMF组WBC减少的发生率显著低于CTX组(33/222vs63/224,P=0.000 9)和CTX/AZA组(1/74vs13/71,P=0.005)。


图12 MMF组与CTX组、CTX/AZA组感染发生率的Meta分析

图13 MMF组与CTX组感染发生率的敏感度分析
图14 MMF组与CTX组、CTX/AZA组WBC减少发生率的Meta分析
Fig 14 Meta analysis of leucopenia rates in MMF and CTX,CTX/AZA groups
3 讨论
本Meta分析共纳入14篇RCT文献,结果显示,MMF组较CTX组可显著提高PLN的完全缓解率、总缓解率,降低感染、闭经和WBC减少的发生率;ESRD发生率、病死率及其他不良反应发生率两组差异无统计学意义。MMF组较CTX/AZA组可显著降低感染、闭经、WBC减少的发生率,但不能提高PLN的完全缓解率和总缓解率,在预防复发和改善预后(ESRD发生率、SCr倍增发生率和病死率)方面疗效相似。
CTX被认为是治疗PLN既不安全,疗效又不肯定的药物,虽然CTX治疗PLN有一定比例的缓解率,但仍有15%复发及复发患者中有50%可进展至ESRD[28,29]。自20世纪90年代MMF首次应用于治疗PLN患者[30,31]和第1个MMF治疗PLN的RCT研究[13]发表以来,MMF被认为是一种疗效与CTX相当,不良反应较小的免疫抑制剂。随后有多项RCT研究[14~27]发表,但报道的疗效和安全性各不相同。已有的9项Meta分析[4~12]纳入研究数量及结论也不尽相同, Walsh等[5]、Moore 等[6]和殷蕾等[10]报道MMF较CTX可显著降低PLN患者的病死率和ESRD发生率,但其余6项Meta分析均得到阴性结果。在不良反应方面,Moore等[6]、欧三桃等[9]、殷蕾等[10]和陈明玉等[11]报道MMF较CTX可降低感染、闭经和WBC减少的发生率,其余5项Meta分析均得到阴性结果。在疗效方面,Moore等[6]、齐华林等[8]、欧三桃等[9]和殷蕾等[10]报道,MMF较CTX可显著提高完全缓解率及总缓解率,其余5项Meta分析不能得到相同的结果。Mak等[12]报道MMF在疗效方面与CTX差异无统计学意义,胃肠道反应发生率显著高于CTX,但未纳入中文文献。以上9项Meta分析结果的不一致可能与纳入样本量相对较小、观察结果不统一及种族不同有关。
本Meta分析纳入了1篇Aspreva Lupus Management Study (ALMS)的最新研究[19,20],样本量较大,文献质量较高,但报道的随访期仅为6个月。MMF与CTX比较,MMF不能显著提高PLN患者的疗效和安全性,且病死率及不良反应发生率均高于CTX,结果与目前中国大陆及香港的报道不一致。种群分析结果提示[19,20],非亚裔及非白裔人种对MMF的治疗反应要高于CTX,黑人及拉丁美洲混合人种对CTX的反应要高于MMF。这也可解释在MMF与CTX对照感染发生率存在组内异质性的原因。相同的种群差异也在ALMS另一研究[32]中得到证实,认为非高加索人种及非亚裔人种对MMF的反应也高于CTX。因此,造成目前Meta分析结论不一致的原因可能有:①各个研究的观察期不同,有些观察指标需要一定的观察时间才能表现出来,可能造成一定的偏倚;②所纳入患者的人种不同可能对MMF或CTX的反应不尽相同;③所有纳入文献均未实施双盲法(因MMF为口服药物,CTX为静脉用药;文献[13,14]中MMF和CTX均为口服用药,但仍未说明盲法的实施情况),观察人员的判定标准可能带来偏倚,这也可能是国内的研究观察到不良反应发生率显著低于国外报道的原因。
目前PLN患儿的治疗证据仅有数量非常有限的回顾性非对照研究,且结论相互矛盾[33~36],与此同时PLN患儿的某些特殊问题,如:生长抑制及预期寿命都是在治疗时必须考虑的,所幸WHO已着手进行SLE患儿的多中心RCT研究[37],PLN患儿的治疗将会有证可循。
本Meta分析的局限性:①纳入文献的总体研究质量不高,存在着选择、实施和测量偏倚的可能性;②纳入研究的测量指标和观测时间点均不统一,这样就给评价带来不利,无法对某些信息进行评价;③总体随访时间较短,未必能真实反映终点指标水平;④纳入的文献仅为中英文文献,未检出其他语种的文献,纳入的样本量较小,可能存在发表偏倚及偶然事件的可能性;⑤纳入的文献中,绝大多数病例为成人,不能反映患儿的疗效及安全性;⑥尚未对不同种群的疗效和安全性进行评价。
4 结论
本Meta分析根据现有的证据得出下列结论:①MMF较CTX可显著提高PLN的完全缓解率和总缓解率,降低感染、闭经和WBC减少的发生率;ESRD发生率、病死率及其他不良反应发生率两组差异无统计学意义。②MMF较CTX/AZA可显著降低感染、闭经和WBC减少的发生率,但不能显著提高PLN的完全缓解率和总缓解率,在预防复发和改善预后(ESRD发生率、SCr倍增发生率和病死率)方面疗效相似。③明确结论还需通过多中心、大样本、双盲、按种群区分的RCT研究,采用CONSONRT统一标准所得到的证据来支持MMF在PLN中的应用价值。
本研究得到《中国循证儿科杂志》编辑部上海强生制药儿科系统评价项目资助。
[1]Fine DM.Pharmacological therapy of lupus nephritis.JAMA,2005,293(24):3053-3060
[2]Mak A, Mok CC, Chu WP, et al.Renal damage in systemic lupus erythematosus: a comparative analysis of different age groups.Lupus,2007,16(1):28-34
[3]Mok CC, Wong RW, Lai KN.Treatment of severe proliferative lupus nephritis: the current state.Ann Rheum Dis,2003,62(9):799-804
[4]Zhu B, Chen N, Lin Y, et al.Mycophenolate mofetil in induction and maintenance therapy of severe lupus nephritis: a meta-analysis of randomized controlled trials.Nephrol Dial Transplant,2007,22(7):1933-1942
[5]Walsh M, James M, Jayne D, et al.Mycophenolate mofetil for induction therapy of lupus nephritis: a systematic review and meta-analysis.Clin J Am Soc Nephrol,2007,2(5):968-975
[6]Moore RA, Derry S.Systematic review and meta-analysis of randomised trials and cohort studies of mycophenolate mofetil in lupus nephritis.Arthritis Res Ther,2006,8(6):182
[7]Flanc RS, Roberts MA, Strippoli GF,et al.Treatment for lupus nephritis.Cochrane Database Syst Rev,2004,(1):CD002922
[8]Qi HL(齐华林), Jiang W, Yan HD. Mycophenolate mofetil for proliferative lupus nephritis: a meta-analysis of randomized controlled trials. J Nephrol Dialy Transplant (肾脏病与透析肾移植杂志),2007,16(5):426-434
[9]Ou ST(欧三桃),Zhong LC,Du X,et al. Mycophenolate mofetil for proliferative lupus nephritis: a systematic review.Chin J Evid-based Med (中国循证医学杂志),2006,6(10):712-720
[10]Yin L(殷蕾),Zhou W,Jin YL,et al. Comparision of cyclophosphamide versus mycophenolate mofetil in lupus nephritis:a systematic review. J Clin Pediatr (临床儿科杂志),2008,26(1):69-72
[11]Chen MY(陈明玉) , Sun LD , Zhao J,et al. Meta-analysis of mycophenolate mofetil versus cyclophosphamide for diffuse proliferative lupus nephritis. Journal of Xi'an Jiao tong University (Medical Sciences) (西安交通大学学报医学版),2008,29(5):549-555
[12]Mak A, Cheak AA, Tan JY, et al.Mycophenolate mofetil is as efficacious as, but safer than, cyclophosphamide in the treatment of proliferative lupus nephritis: a meta-analysis and meta-regression.Rheumatology (Oxford),2009,48(8):944-952
[13]Chan TM, Li FK, Tang CS, et al.Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. Hong Kong-Guangzhou Nephrology Study Group.N Engl J Med,2000,343(16):1156-1162
[14]Chan TM, Tse KC, Tang CS, et al.Long-term study of mycophenolate mofetil as continuous induction and maintenance treatment for diffuse proliferative lupus nephritis.J Am Soc Nephrol,2005,16(4):1076-1084
[15]Contreras G, Pardo V, Leclercq B, et al.Sequential therapies for proliferative lupus nephritis.N Engl J Med,2004,350(10):971-980
[16]Ginzler EM, Dooley MA, Aranow C,et al.Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis.N Engl J Med,2005,353(21):2219-2228
[17]Ong LM, Hooi LS, Lim TO, et al.Randomized controlled trial of pulse intravenous cyclophosphamide versus mycophenolate mofetil in the induction therapy of proliferative lupus nephritis.Nephrology (Carlton),2005,10(5):504-510
[18]Hu W, Liu Z, Chen H, et al.Mycophenolate mofetil vs cyclophosphamide therapy for patients with diffuse proliferative lupus nephritis.Chin Med J (Engl),2002,115(5):705-709
[19]Sinclair A, Appel G, Dooley MA, et al.Mycophenolate mofetil as induction and maintenance therapy for lupus nephritis: rationale and protocol for the randomized, controlled Aspreva Lupus Management Study (ALMS).Lupus,2007,16(12):972-980
[20]Appel GB, Contreras G, Dooley MA, et al. Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. J Am Soc Nephrol, 2009,20(5):1103-1112
[21]Flores-Suarez LF, Villa AR. Preliminary results of an open label randomized clinical trial comparing mycophenolate mofetil (MMF) vs intravenous cyclophosphamide as induction therapy for severe lupus nephritis. Arthritis Rheum ,2004,50(S1):1029
[22]Wang J, Hu W, Xie H, et al.Induction therapies for class IV lupus nephritis with non-inflammatory necrotizing vasculopathy: mycophenolate mofetil or intravenous cyclophosphamide.Lupus,2007,16(9):707-712
[23]Mulic-Bacic S,Antic D,Krizic M,et al. Mycophenolate mofetil or intravenous cyclophosphamide in treatment of lupus nephritis. Ann Rheum Dis,2008,67(S2):349
[24]Zhang JL(张江林),Zhang X,Ma L,et al. A multicentric and prospective study on mycophenolate mofetil in the treatment of systemic lupus erythematosus.Chin J Rheumatol (中华风湿病学杂志),2002,6(6):406-410
[25]Jiang WG(蒋文功),Xiao X,Fang JA. Efficacy of mycophe-nolate mofetil in patients with diffuse proliferative lupus nephriti. Chinese Journal of Integrated Traditional and Western Nephrology (中国中西医结合肾病杂志),2002,3(4):218-221
[26]Liu GP(刘国平),Huang JX,Lin L. Clinical study of mycophe-nolate mofetil in patients with diffuse proliferative lupus nephritis.Chinese Journal of Integrated Traditional and Western Nephrology (中国中西医结合肾病杂志),2003,4(7):386-388
[27]Zhu B(朱彬),Zhou ZA,Liu ZD,et al. Comparision of myco-phenolate mofetil therapy versus cyclophosphamide treatment in diffuse proliferative lupus nephritis.Acta Academiae Medicinae Shandong(山东大学学报医学版),2003,41(6):692-694
[28]Sesso R, Monteiro M, Sato E, et al.A controlled trial of pulse cyclophosphamide versus pulse methylprednisolone in severe lupus nephritis.Lupus,1994,3(2):107-112
[29]Belmont HM, Storch M, Buyon J, et al.New York University/Hospital for Joint Diseases experience with intravenous cyclophosphamide treatment: efficacy in steroid unresponsive lupus nephritis.Lupus,1995,4(2):104-108
[30]Glicklich D, Acharya A.Mycophenolate mofetil therapy for lupus nephritis refractory to intravenous cyclophosphamide.Am J Kidney Dis,1998,32(2):318-322
[31]Dooley MA, Cosio FG, Nachman PH, et al.Mycophenolate mofetil therapy in lupus nephritis: clinical observations.J Am Soc Nephrol, 1999,10(4):833-839
[32]Ginzler EM,Appel GB, Dooley MA,et al. Mycophenolate mofetil and intravenous cyclophosphamide in the Aspreva Lupus Management Study (ALMS):efficacy by racial group.Arthritis Rheum,2007,56(12):4308
[33]Lehman TJ, Onel K.Intermittent intravenous cyclophosphamide arrests progression of the renal chronicity index in childhood systemic lupus erythematosus.J Pediatr,2000,136(2):243-247
[34]Barbano G, Gusmano R, Damasio B,et al.Childhood-onset lupus nephritis: a single-center experience of pulse intravenous cyclophosphamide therapy.J Nephrol, 2002,15(2):123-129
[35]Bogdanovic R, Nikolic V, Pasic S,et al.Lupus nephritis in childhood: a review of 53 patients followed at a single center.Pediatr Nephrol,2004,19(1):36-44
[36]Wong SN, Tse KC, Lee TL,et al.Lupus nephritis in Chinese children-a territory-wide cohort study in Hong Kong.Pediatr Nephrol. 2006,21(8):1104-1112
[37]Ruperto N, Bazso A, Ravelli A, et al.Paediatric Rheumatology International Trials Organization (PRINTO).Lupus,2007,16(8):670-676
