喹那普利对单侧输尿管结扎大鼠肾纤维化拮抗作用的研究
2010-01-24高晓洁李永柏谷泽隆邦
高晓洁 李永柏 谷泽隆邦
肾间质纤维化是各类慢性肾脏疾病进展到终末期的主要病理特征。无论肾脏病原发病因和部位在肾小球、肾小管抑或肾血管,几乎所有的进展性肾病均可见到肾小管间质纤维化。大量研究表明,肾间质纤维化的程度与肾功能的相关性较肾小球硬化与肾功能的相关性更为密切[1~3]。积极探索阻抑肾间质纤维化发生、发展的治疗手段,对改善肾脏病的预后至关重要。因此,近年来围绕肾小管间质损伤的发病机制和防治措施方面的研究逐渐受到国内外学者的广泛重视。
血管紧张素Ⅱ(AngⅡ)是肾素-血管紧张素系统(RAS)最主要的活性物质,已证实在梗阻性肾病中,AngⅡ表达明显增加[4]。在AngⅡ的AT1受体基因敲除后,梗阻早期即可抑制巨噬细胞的浸润和转化生长因子-β1(TGF-β1)mRNA及Ⅲ型胶原的表达,而肾间质容积在梗阻后2~5 d显著下降[5]。由此可见,AngⅡ参与了梗阻性肾病肾间质纤维化的形成和发展。Klahr等[6]应用血管紧张素转换酶抑制剂(ACEI)及AT1受体拮抗剂抑制AngⅡ生成、表达和活化后,可显著减少细胞外基质(ECM)的沉积及成纤维细胞的增殖,提示AngⅡ是对肾间质纤维化影响最为明显的血管活性物质。
喹那普利是1989年在美国上市的含羧基类ACEI,具有安全剂量范围大,毒性作用和不良反应小等优点。近年来,国外许多学者已将喹那普利广泛应用于治疗链脲佐菌素诱发的糖尿病肾病,肾大部切除诱发的慢性肾功能不全和持续性不卧床腹膜透析(CAPD)并发的腹膜硬化等[7~9],在上述研究中喹那普利均被证实有显著的抗增殖和抗纤维化作用。目前,国内关于喹那普利干预单侧输尿管结扎(UUO)肾小管间质纤维化进程的研究尚未见报道。本研究通过分析喹那普利对大鼠肾组织TGF-β1mRNA表达、肾间质容量、肾组织α-平滑肌肌动蛋白(α-SMA)及TGF-β1蛋白水平的影响,为探索喹那普利保护肾脏功能的作用机制提供实验依据。
1 方法
1.1 实验动物分组及处置 5周龄雄性SD大鼠30只(体重150~180 g,日本兵库医科大学医学动物实验中心提供),以随机数字法分为3组:假手术组6只,UUO组及喹那普利组各12只。模型建立方法[10]简述如下:以戊巴比妥50 mg·kg-1腹腔注射麻醉后,在无菌条件下分离出左侧输尿管,上下两端结扎后离断。假手术组除不结扎离断输尿管外,余步骤同UUO组。喹那普利组在UUO前1 d予喹那普利10 mg·kg-1·d-1灌胃,假手术组及UUO组予同等体积生理盐水灌胃。各组的半数大鼠分别于术后14及28 d处死,取左肾组织,部分置于4%多聚甲醛液中固定,用于Masson染色和免疫组化实验;部分速冻于-80℃液氮中备用于原位杂交实验。动物实验在日本兵库医科大学动物实验室完成,并得到该校实验动物关爱委员会的批准。实验动物在清洁恒温(22℃)环境下饲养,予普通饲料喂养,进食、水的量不限。
1.2 主要药品与试剂 喹那普利(每片10 mg,日本田边三菱制药株氏会社提供),鼠TGF-β1cDNA (498 bp ,818-1315)探针(日本兵库医科大学提供);DIG RNA Labeling Kit (Boehringer Mannheim公司,德国);兔抗DIG/HRP 抗体 (Dako, 美国);兔抗TGF-β1多克隆抗体(Santa Cruz,美国);鼠抗α-SMA单克隆抗体(Novo Castra,英国);羊抗兔或鼠IgG (Envision+TM, Peroxidase, Dako,美国)。
1.3 大鼠肾组织TGF-β1mRNA表达检测 采用原位杂交法检测,按DIG RNA labeling kit操作说明书进行合成和标记TGF-β1cRNA 探针。原位杂交主要步骤:冰冻切片(厚6~8 μm)以4%多聚甲醛液(pH 7.2)固定,经0.2 mmol·L-1HCl处理后予蛋白酶K 10 ng·L-1消化30 min,每张切片滴加预杂交液预杂交1 h,然后加入1 mg·L-1DIG-labeled TGF-β1cRNA 探针,50℃杂交16 h,充分洗涤后滴加兔抗DIG/HRP 抗体(1∶250) 室温孵育30 min。缓冲液洗涤后滴加生物素化过氧化物酶,经DAB显色加苏木精复染后脱水封片。
1.4 大鼠肾组织α-SMA和TGF-β1蛋白水平的检测 2 μm厚石蜡切片常规脱蜡至水,用Target retrieval 试剂 (pH 6.0; Dako, 美国) 115~121℃微波6~10 min进行抗原热修复,浸入1% H2O2液20 min消耗内源性过氧化酶,分别滴加兔抗大鼠TGF-β1多克隆抗体(1∶100)和鼠抗大鼠α-SMA单克隆抗体4℃过夜,清洗后滴加相应二抗(羊抗兔或鼠IgG)室温静置30 min,以DAB 底物显色并加苏木精轻度复染后常规脱水封片。
1.5 肾小管间质损害病理学检查 按常规方法进行Masson染色,光镜下观察肾小管间质的病理改变。
1.6 实验结果半定量分析 对各组大鼠肾组织TGF-β1mRNA表达、肾小管间质容量、α-SMA和TGF-β1蛋白水平进行半定量分析。对实验分组不知晓的2名观察者采用经典的point-counting 法[10~12]进行统计计数。具体方法:以带有11×11等距网格线测微尺的目镜观察,400倍镜下随意选取20个连续但不重叠视野(含有肾小球及大血管的视野不纳入观察视野),网格交叉点阳性染色者计数并求其平均值。
2 结果
实验过程中3组大鼠均无死亡。假手术组术后2和4周的实验结果差异无统计学意义,故将其合并作为对照组进行实验结果分析。
2.1 各组大鼠肾组织TGF-β1mRNA表达的比较 假手术组可见TGF-β1mRNA广泛存在于肾小球系膜细胞,肾小管上皮细胞及间质细胞中(图1A、B),在正常情况下杂交信号散在而微弱。UUO组肾组织中TGF-β1mRNA表达水平剧增,尤其在扩张或萎缩肾小管上皮细胞及增生的间质细胞中的表达更为明显(图1C),梗阻终末期肾小管间质细胞中TGF-β1mRNA的杂交信号已呈现堆积现象(图1D);相对而言,肾小球中TGF-β1mRNA表达水平增加并不明显。喹那普利组肾小管间质TGF-β1mRNA的表达较同时期UUO组明显减少(图1E、F,表1)。


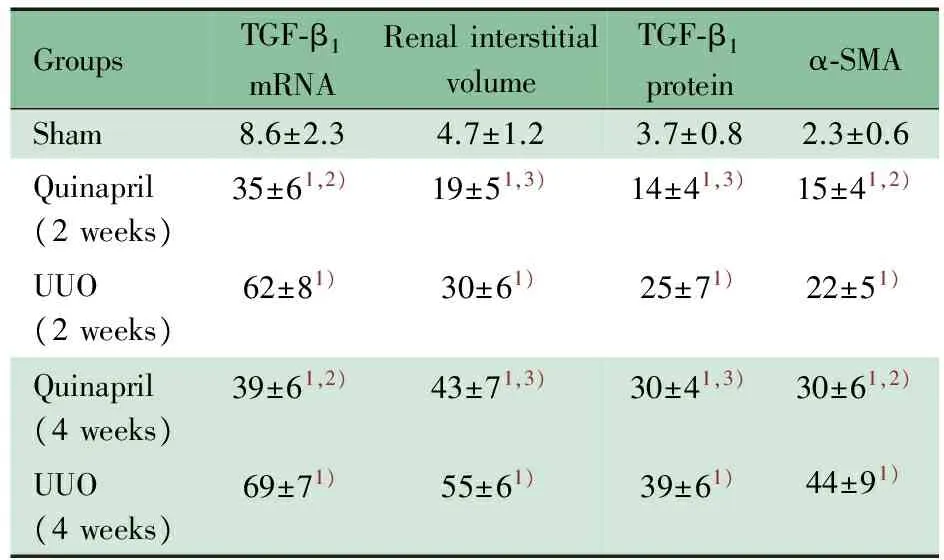
GroupsTGF⁃β1mRNARenalinterstitialvolumeTGF⁃β1proteinα⁃SMASham8.6±2.34.7±1.23.7±0.82.3±0.6Quinapril(2weeks)35±61,2)19±51,3)14±41,3)15±41,2)UUO(2weeks)62±81)30±61)25±71)22±51)Quinapril(4weeks)39±61,2)43±71,3)30±41,3)30±61,2)UUO(4weeks)69±71)55±61)39±61)44±91)
Notes 1)P<0.01,vssham group; 2)P<0.01, 3)P<0.05, Quinapril groupvsUUO group at the same time.n=6 for each group
2.2 各组大鼠肾小管间质病理改变 假手术组显示正常的肾小管间质形态(图2A)。UUO组术后2周时肾小管上皮细胞肿胀,小管明显萎缩或扩张,伴有不同程度的间质增生和胶原形成(图2B);UUO组术后4周时萎缩塌陷的肾小管明显增加,肾间质纤维化程度亦明显加重(图2C)。喹那普利组与同时期的UUO组比较,肾小管萎缩塌陷、小管上皮细胞肿胀及间质扩张的情况明显减少(图2D),尤其在4周时肾间质纤维组织增生程度明显抑制(图2E,表1)。
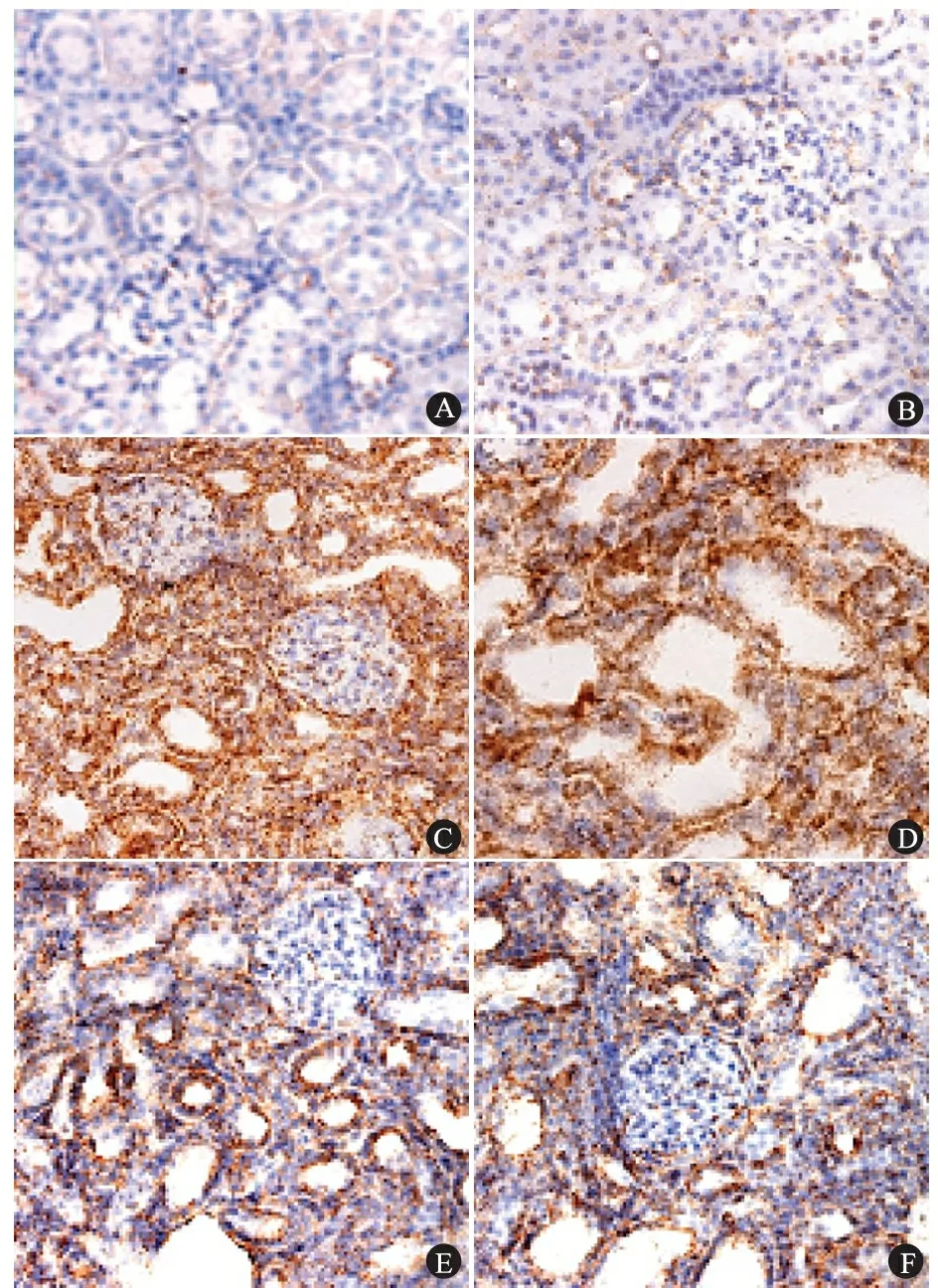
图1 各组大鼠肾组织TGF-β1mRNA的表达(原位杂交,×200)
Fig 1 Expression of TGF-β1mRNA in the experimental rat renal tissues in different groups(in situ hybridization, ×200)
Notes A: sham group at 2 weeks time point; B:sham group at 4 weeks time point;C:UUO group at 2 weeks time point; D:UUO group at 4 weeks time point; E: Quinapril group at 2 weeks time point; F:Quinapril group at 4 weeks time point.TGF-β1mRNA positive signals were detected in glomerular mesangeal cells, tubular epithelial cells and interstitium. The hybridized signals were weak in sham kidney, much stronger in renal tissues both 2 weeks and 4 weeks after UUO operation, no increasing expression of TGF-β1mRNA was found in glomeruli of UUO kidney
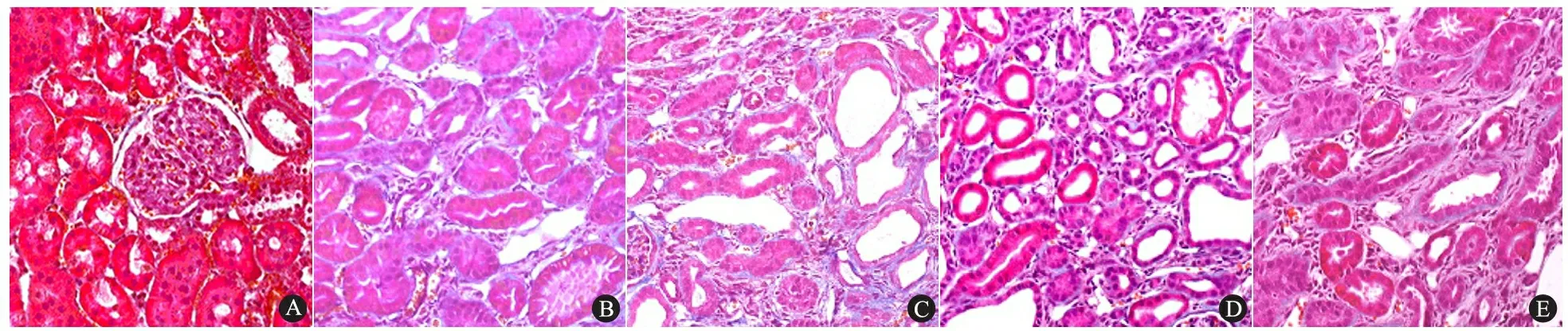
图2 各组大鼠肾小管间质病理改变(Masson染色,×200)
Fig 2 Morphological changes of relative interstitial volume in each group(Masson's trichrome stain,×200)
Notes A: sham group at 2 weeks time point; B:UUO group at 2 weeks time point; C:UUO group at 4 weeks time point; D: Quinapril group at 2 weeks time point; E:Quinapril group at 4 weeks time point. Tubular atrophy or dilation and interstitial fibrosis were obvious in renal tissues of UUO group, especially at 4 weeks time point post-operation. Compared with UUO group, tubulointerstitial fibrosis hallmarked by interstitial volume was markedly decreased in quinapril group
2.3 各组大鼠肾组织TGF-β1蛋白和α-SMA水平 假手术组肾小球系膜细胞,肾小管上皮细胞及间质细胞中可见极少量TGF-β1蛋白阳性染色(图3A)。UUO组肾小管上皮细胞中可见强阳性染色的TGF-β1蛋白表达,在萎缩塌陷的肾小管上皮细胞中其表达尤为明显(图3B)。UUO组术后4周时肾脏中TGF-β1蛋白在小球系膜、极度扩张及萎缩的肾小管及间质细胞中均呈现强阳性表达(图3C),提示TGF-β1蛋白在肾间质纤维化的进程中可能具有非常重要的促进作用。喹那普利组肾小管间质中TGF-β1蛋白的表达明显受抑,间质增生及肾小管萎缩现象亦明显减轻(图3D、E,表1)。
假手术组α-SMA仅在肾小血管壁肌细胞和极少量间质细胞中表达(图4A)。UUO组α-SMA主要存在于肾间质细胞及小血管壁,随着肾纤维化的逐渐加重,肾间质细胞增生,成纤维细胞堆积,α-SMA呈强阳性染色(图4B、C);喹那普利组由于肾间质增生明显受抑,α-SMA表达亦相应明显减少(图4D、E,表1)。
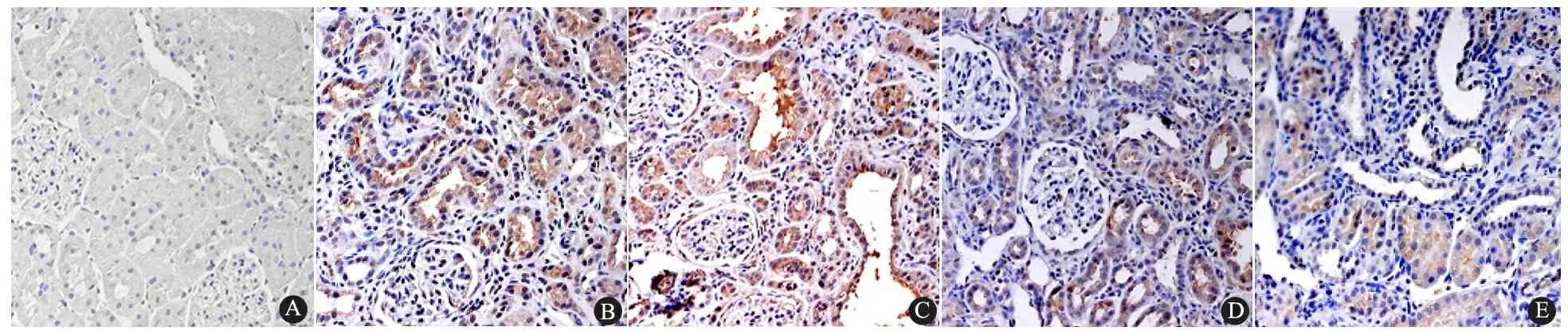
图3 各组大鼠肾组织TGF-β1蛋白的表达(免疫组化,×200)
Fig 3 Expression of TGF-β1protein immunohistochemically in renal tissues of each group(×200)
Notes A: sham group at 2 weeks time point; B:UUO group at 2 weeks time point; C:UUO group at 4 weeks time point; D: Quinapril group at 2 weeks time point; E:Q+UUO group at 4 weeks time point. TGF-β1protein was mainly expressed in tubular cells, and also found in interstitium of kidney at 4 weeks time point afer UUO operation. More positive staining of TGF-β1protein was detected in UUO group than quinapril group
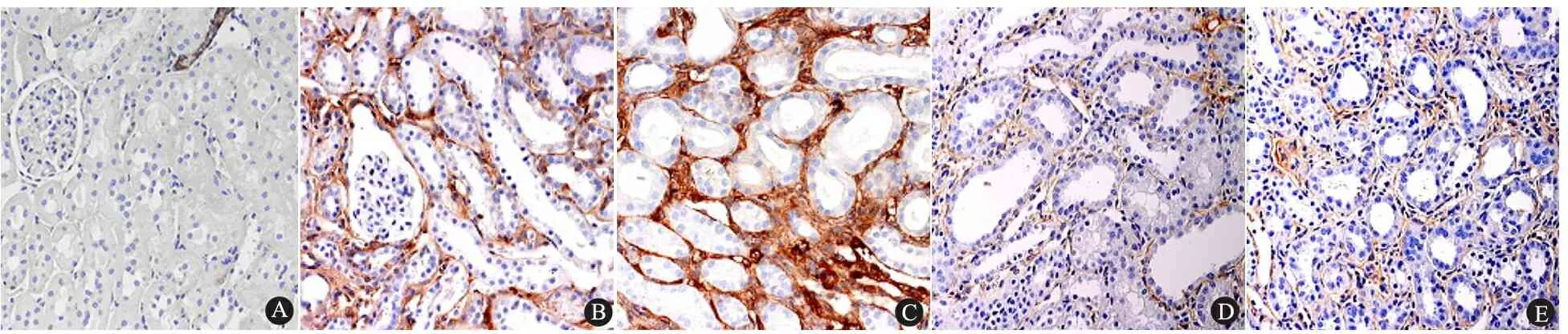
图4 各组大鼠肾组织α-SMA的表达(免疫组化,×200)
Fig 4 Expression of α-SMA immunohistochemically in renal tissues of each group(×200)
Notes A: sham group at 2 weeks time point; B:UUO group at 2 weeks time point; C:UUO group at 4 weeks time point; D: Quinapril group at 2 weeks time point; E:Quinapril group at 4 weeks time point. α-SMA was expressed mainly in interstitium and small vessles. α-SMA positive staining was much stronger in UUO group than quinapril group
3 讨论
自20世纪80年代中期以来,动物实验已证实ACEI比其他类降血压药可更有效地保护肾脏,减轻肾脏损伤。在肾小球肾炎和肾间质纤维化中,不论是否伴有高血压,均可见肾组织中RAS活性增强。可见AngⅡ不仅通过增加肾小球毛细血管内压的单一途径造成肾脏损伤,且据推测AngⅡ具有直接调控多种血管活性因子、细胞因子、生长因子及炎症细胞的作用[13,14],但迄今为止其作用机制尚未阐明。
ACEI种类繁多,与贝那普利、雷米普利、培哚普利、依那普利和卡托普利相比较,喹那普利具有最小的半数抑制量(ID50)值,且具有较强的脂溶性和组织亲和性,故喹那普利与组织中的血管紧张素抑制酶(ACE)亲和力极高,ACE抑制作用相对较强[15]。Wadworth等[16]证实喹那普利的不良反应发生率低于依那普利和卡托普利,同时由于喹那普利不含巯基,故过敏反应及肾毒性均罕见,提示喹那普利具备了高效低毒的特性。
本研究采用经典的慢性肾间质纤维化UUO模型,并选择长期观察(梗阻后2和4周)直至终末肾状态,观察随着肾间质纤维化的进行性加重,可疑致纤维化因子的变化及喹那普利的拮抗作用是否持续有效。
作为一种多功能的多肽生长因子,TGF-β1是目前公认的最重要的致纤维化关键因子之一。如图1、3所示,TGF-β1广泛分布于肾小管上皮细胞、间质成纤维细胞和小球系膜细胞的胞质中。UUO组肾小管上皮及间质细胞中TGF-β1分泌明显活跃,原位杂交结果更明确显示随着梗阻时间的延长,TGF-β1mRNA在扩张或萎缩的肾小管上皮细胞及增生的肾间质细胞中表达逐渐增多,提示TGF-β1在UUO所致慢性肾间质纤维化的进程中具有重要的作用。
TGF-β1致纤维化作用的主要环节为[17~20]:①激发小管上皮细胞和间质细胞向成纤维细胞的转分化;②抑制多种ECM降解酶(如PIA-1和TIMPs等)的活性,发挥抑制ECM降解的作用;③促进胶原蛋白(Ⅰ、Ⅲ及Ⅳ型胶原等)合成,从而刺激ECM沉积;④激活单核/巨噬细胞系统间质浸润基质蛋白沉积,导致间质纤维化。肾小管上皮细胞和系膜间质细胞发生表型转化而成为肌纤维母细胞,而α-SMA阳性标记的肌纤维母细胞丧失上皮黏附性,重新组合肌动蛋白,破坏肾小球基底膜,同时肌纤维细胞可产生大量的Ⅰ、Ⅲ型胶原。因此,肾组织纤维化最显著的特征是肌纤维母细胞的增生和ECM的过度沉积。
以α-SMA为阳性标记的肌纤维母细胞是产生ECM的主要细胞。本研究结果显示,UUO组大鼠肾间质细胞呈现α-SMA强阳性染色,且随着梗阻时间的延长,α-SMA的表达愈加明显,证实了α-SMA是促进梗阻肾ECM沉积的主要因子或主要因子之一。喹那普利的干预明显阻抑了肌纤维母细胞的形成,有效减少了ECM的沉积,从而延缓了肾间质纤维化的发展过程。
有学者提出[21,22],在治疗肾脏疾病时,TGF-β1应被视为除高血压外的重要的治疗靶点。ACEI可能会阻断AngⅡ诱导的TGF-β1高表达,从而干扰肾纤维化的进程,起到肾保护作用。本研究结果表明喹那普利可明显抑制UUO大鼠肾组织中TGF-β1mRNA和蛋白水平的表达,使病变肾组织中成纤维细胞明显减少,进而降低肾间质容量,并通过4周观察证实了ACEI通过抑制TGF-β1高表达的抗肾纤维化作用在终末期肾脏损害中亦持续有效。
本研究的不足之处和局限性:①仅对喹那普利拮抗肾纤维化的作用进行了观察,未与其他ACEI药物在抑制肾纤维化效应方面进行比较;②对喹那普利通过何种途径抑制了TGF-β1表达亦未涉及。均有待于进一步的实验研究。
[1]Kanno Y, Okada H, Yamaji Y, et al. Angiotensin-converting-enzyme inhibitors slow renal decline in IgA nephropathy, independent of tubulointerstitial fibrosis at presentation. QJM, 2005, 98(3): 199-203
[2]Okada H, Watanabe Y, Kikuta T, et al. Bradykinin decreases plasminogen activator inhibitor-1 expression and facilitates matrix degradation in the renal tubulointerstitium under angiotensin-converting enzyme blockade. J Am Soc Nephrol, 2004, 15(9):2404-2413
[3]Koo JW, Kim Y, Rozen S, et al. Enalapril accelerates remodeling of the renal interstitium after release of unilateral ureteral obstruction in rats. J Nephrol, 2003, 16(2): 203-209
[4]Jensen AM, Bae EH, Fenton RA, et al. Angiotensin Ⅱ regulates V2 receptor and pAQP2 during ureteral obstruction. Am J Physiol Renal Physiol, 2009, 296(1): 127-134
[5]Satoh M, Kashihara N, Yamasaki Y, et al. Renal interstitial fibrosis is reduced in angiotensin Ⅱ type 1a receptor-deficient mice. J Am Soc Nephrol, 2001, 12(2): 317-325
[6]Klahr S, Morrissey JJ. Comparative study of ACE inhibitors and angiotensin Ⅱ receptor antagonists in interstitial scarring. Kidney Int, 1997, 52 (S): 111-114
[7]Sawada T, Ishii Y, Nakajima I, et al. An experimental model of encapsulating peritoneal sclerosis. Perit Dial Int, 2009, 29 (S2): 49-50
[8]Sen S, Kanter M, Ustundag S, et al. Effect of angiotensin-converting enzyme inhibition and angiotensin Ⅱ type 1 receptor blockade on streptozotocin-induced diabetic nephropathy. Ren Fail, 2008, 30(10): 1023-1033
[9]Hamar P, Kokeny G, Liptak P, et al. The combination of ACE inhibition plus sympathetic denervation is superior to ACE inhibitor monotherapy in the rat renal ablation model. Nephron Exp Nephrol, 2007, 105(4):124-136
[10]Gao X, Mae H, Ayabe N, et al. Hepatocyte growth factor gene therapy retards the progression of chronic obstructive nephropathy. Kidney Int, 2002, 62(4): 1238-1248
[11]Møller JC, Skriver E. Quantitative ultrastructure of human proximal tubules and cortical interstitium in chronic renal disease (hydronephrosis). Virchows Arch A Pathol Anat Histopathol, 1985,406(4):389-406
[12]Xie Y, Nishi S, Iguchi S,et al. Expression of osteopontin in gentamicin-induced acute tubular necrosis and its recovery process. Kidney Int, 2001,59(3) :959-974
[13]Takamatsu M, Urushihara M, Kondo S, et al. Glomerular angiotensinogen protein is enhanced in pediatric IgA nephropathy. Pediatr Nephrol, 2008, 23(8): 1257-1267
[14]Tunçdemir M, Ozturk M. The effects of ACE inhibitor and angiotensin receptor blocker on clusterin and apoptosis in the kidney tissue of streptozotocin-diabetic rats. J Mol Histol, 2008, 39(6):605-616
[15]Fabris B, Chen BZ, Pupic V, et al. Inhibition of angiotensin-converting enzyme (ACE) in plasma and tissue. J Cardiovasc Pharmacol, 1990,15(S2):6-13
[16]Wadworth AN, Brogden RN. Quinapril. A review of its pharmacological properties, and therapeutic efficacy in cardiovascular disorders. Drugs, 1991, 41(3):378-399
[17]Jung GS, Kim MK, Choe MS,et al. The orphan nuclear receptor SHP attenuates renal fibrosis. J Am Soc Nephrol, 2009, 20(10):2162-2170
[18]Nishikimi T, Inaba-Iemura C, Ishimura K, et al. Natriuretic peptide/natriuretic peptide receptor-A (NPR-A) system has inhibitory effects in renal fibrosis in mice. Regul Pept, 2009,154(1-3): 44-53
[19]Kawai T, Masaki T, Doi S, et al. PPAR-gamma agonist attenuates renal interstitial fibrosis and inflammation through reduction of TGF-beta. Lab Invest, 2009, 89(1):47-58
[20]Chung AC, Huang XR, Zhou L, et al. Disruption of the Smad7 gene promotes renal fibrosis and inflammation in unilateral ureteral obstruction (UUO) in mice. Nephrol Dial Transplant, 2009, 24(5):1443-1454
[21]Wolf G. Renal injury due to renin-angiotensin-aldosterone system activation of the transforming growth factor-beta pathway. Kidney Int, 2006, 70(11):1914-1919
[22]Huang Y, Wongamorntham S, Kasting J, et al. Renin increases mesangial cell transforming growth factor-beta1 and matrix proteins through receptor-mediated, angiotensin Ⅱ-independent mechanisms.Kidney Int, 2006, 69(1):105-113
