中红侧沟茧蜂滞育生理生化指标变化规律研究
2010-01-18李文香郭会婧闫海燕路子云李建成刘小霞张青文
李文香,郭会婧,郭 江,闫海燕,路子云,李建成,刘小霞,张青文
(1.河北北方学院农林科技学院,河北张家口075000;2.河北省农林科学院植物保护研究所,河北农业有害生物综合防治工程技术中心,河北保定071000;3.中国农业大学农学与生物技术学院昆虫系,北京100094)
中红侧沟茧蜂Microplitis mediator(Haliday)属膜翅目,茧蜂科,小蜂茧蜂亚科,侧沟茧蜂属,广泛分布于亚洲与欧洲[1,2].在我国河北、黑龙江、辽宁、内蒙古、山东、山西、河南、陕西、新疆、江苏等地均有分布[3].该蜂是一种寄主非常广泛的内寄生蜂,其寄主涉及到鳞翅目夜蛾科和尺蛾科40多种昆虫[4],其中包括棉铃虫 Helicover pa armigera(Noctuidae)、粘虫M ythimna separata(Walker)、甘蓝夜蛾barathra brassicae等农业上的重大害虫[5],是田间害虫生物控制的重要因子[6].目前,在明确该蜂生物学特性的基础上,以粘虫为寄主在室内已经能够大规模人工繁殖.中红侧沟茧蜂与寄主粘虫之间的生理调控关系,也一直是众多学者关注、研究的热点[7,8].但有关中红侧沟茧蜂滞育过程中各种生理指标的含量变化却至今未见报道,本文的研究为中红侧沟茧蜂滞育生理方面填补了空白.
1 材料与方法
1.1 供试虫源
寄主昆虫为粘虫Mythimna separate,3龄以下用新鲜玉米叶片饲养,3龄以上用人工饲料饲养,实验前已在本实验室繁殖饲养10代以上,本试验所用粘虫均为玉米叶饲养.中红侧沟茧蜂采自河北省保定地区棉田,将被寄生的棉铃虫采回室内继续用人工饲料饲养,蜂羽化后,每天饲喂10%的蜂蜜水,然后在河北省植保所昆虫天敌实验室以粘虫为寄主进行扩繁10代以上.
寄生过程:挑选1龄末-2龄初的健壮粘虫幼虫,放入接蜂箱 (40 cm×30 cm×25 cm)底部的新鲜玉米叶上,用羽化后交配24 h的中红侧沟茧蜂雌蜂进行寄生接蜂,将浸有10%蜂蜜水的脱脂棉球挂在蜂箱的侧面做为成蜂的食源.24 h后去除中红侧沟茧蜂,把粘虫分别转入玻璃瓶内用新鲜玉米苗继续饲养.
滞育条件:16℃和光周期L:D=10∶14;非滞育条件:26℃和光周期L:D=14∶10.将被寄生寄主分别置于两条件的光照培养箱中,环境设置温度误差±1℃,光照强度5 000-6 000Lx,相对湿度RH∶65%±5%.每个处理重复3次.
1.2 中红侧沟茧蜂体内生理指标的提取与测定方法
生理指标的提取方法如下:准备试管并贴好标签.试验将虫体 (60 mg)90℃加热1 h.记录虫体干重,放置试管A中.-80℃保存,待用.向每个样品中加入100μl饱和的Na2SO4和200μl的甲醇.用玻璃棒将虫体研磨.用100μl的水冲洗.再用1 ml的甲醇∶氯仿=1∶1冲洗,液体全部进入试管A中即为糖原.搅拌,2500 rpm/min,离心5 min.将上清液转移至B1中.用1 ml的甲醇:氯仿=1∶1重复抽提A,上清液至B1.剩下的为A,将A置于冰中待用.
将B1中加入2.6 ml的氯仿,使液体体积达到5.0 ml,再加入0.5 ml的水,2 500 rpm/min,离心5 min.下层有机相转移至B2中,水相留在B1.将B1也置于冰中待用.向B2中加入氯仿使体积至5.0 ml,再加入1.0 ml的水,搅拌后2 500 rpm/min,离心5 min.转移下层有机相,先使有机相通过200 mg100网眼的硅胶,过滤至B3即为甘油三酯.再向硅胶中倒入8 ml的氯仿,每次1 ml.将B3低温加热氮气(N2)吹干.将B1+B2,N2吹干.转移水相,使之通过200 mg100网眼的硅胶,过滤至C1即为糖类.再向B1+B2中加入0.5 ml的水,使之再次过滤.
向试管A中加入1 ml66%的乙醇Na2SO4溶液.搅拌,2 500 rpm/min,离心5 min.上清液转移至C即为海藻糖.记录C的量.将试管A55℃加热5 min.加入0.5 ml的30%的 KOH,搅拌,100℃加热20 min.加入1 ml乙醇,搅拌,使液体再次分层.3 000 rpm/min,离心15 min.上清液转移至D中即为蛋白质,用来测定蛋白质含量.加入0.5 ml的水和1 ml乙醇.3 000 rpm/min,离心15 min.上清液也转移至D中.再加入2.6 ml的氯仿.加入1 ml的水后,2 500 rpm/min,离心5 min.转移下层液体至B3中.
糖类物质的测定采用硫酸蒽酮法.以葡萄糖作标准曲线.每个浓度值重复3次.
海藻糖的测定采用硫酸蒽酮法.以海藻糖作标准曲线.每个浓度值重复3次.
脂类的测定采用香兰素硫酸显色法.以甘油三酸酯作标准曲线.每个浓度值重复3次.
蛋白的测定方法:溴酚蓝显色法.以牛血清蛋白作标准曲线.每个浓度值重复3次.
1.3 数据统计分析
本论文用SPSS分析软件进行数据统计分析.
2 结果与分析
2.1 滞育与非滞育条件下中红侧沟茧蜂糖原含量比较
从图1可以看出,两种条件下糖原的含量变化趋势基本相同,糖原的浓度均是由低逐渐增加.滞育条件下蛹期浓度达到155.73μg/mg,非滞育条件下第6 d浓度最大为70.62μg/mg.除滞育条件下发育第16 d与非滞育条件下发育第6 d糖原浓度差异不显著外,其它发育时期的糖原浓度均是显著差异 (P<0.05):滞育条件下中红侧沟茧蜂体内糖原含量一直显著高于非滞育条件下的浓度.
2.2 滞育与非滞育条件下中红侧沟茧蜂海藻糖含量比较
从图2可以看出,两种条件下寄生蜂体内海藻糖含量变化趋势均出现逐渐增加的趋势,均在蛹期出现最高值.滞育条件下104.75μg/mg,非滞育条件下37.86μg/mg.两种条件下中红侧沟茧蜂海藻糖含量从第16 d/6 d-蛹期浓度差异均显著 (P<0.05).由图可以看出,不同发育条件决定寄生蜂的发育速度,同时影响生理指标含量.中红侧沟茧蜂滞育条件下发育慢但海藻糖含量增加快,非滞育条件正好相反.
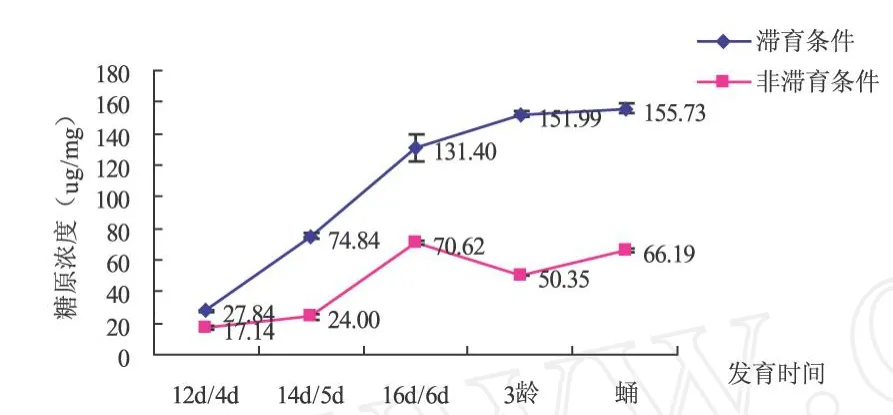
图1 滞育与非滞育条件中红侧沟茧蜂不同发育时间糖原含量比较

图2 滞育与非滞育条件中红侧沟茧蜂不同发育时间海藻糖含量比较
2.3 中红侧沟茧蜂滞育过程中糖原和海藻糖含量比较
从图3可以看出,滞育茧冷藏过程中糖原含量变化总体趋势为先增长后逐渐降低.但糖原浓度一直保持较高水平.保存第10 d、20 d和蛹期的糖原含量无显著差异;保存20~60 d的过程中也无显著差异 (P>0.05).但10~20 d和蛹期与20~60 d的糖原浓度差异显著 (P<0.05).海藻糖含量在滞育茧冷藏过程中前期呈逐渐增加趋势,后期即滞育即将结束时略有下降.在整个滞育过程中糖原含量一直处于较高水平,而海藻糖在滞育的中后期含量较高,滞育结束时,也就是蛹期含量显著下降.
2.4 滞育与非滞育条件下中红侧沟茧蜂甘油三酯含量比较
由图4可以看出,在整个发育过程中,除蛹期外,其他任何时期中红侧沟茧蜂的甘油三酯浓度在滞育条件下一直高于非滞育条件下,且差异均显著.由此可见:低温和短光照可诱导中红侧沟茧蜂甘油三酯的含量增加,有利于向滞育的方向发展.但两种条件下甘油三酯的含量变化趋势大体一致,均在3龄期达到最大值,滞育条件下浓度为9.52μg/mg,非滞育条件下为6.83μg/mg.
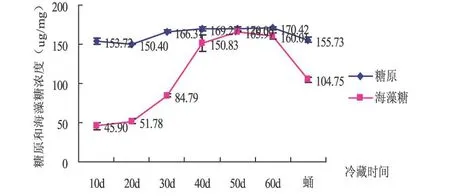
图3 中红侧沟茧蜂滞育过程中糖原和海藻含量比较
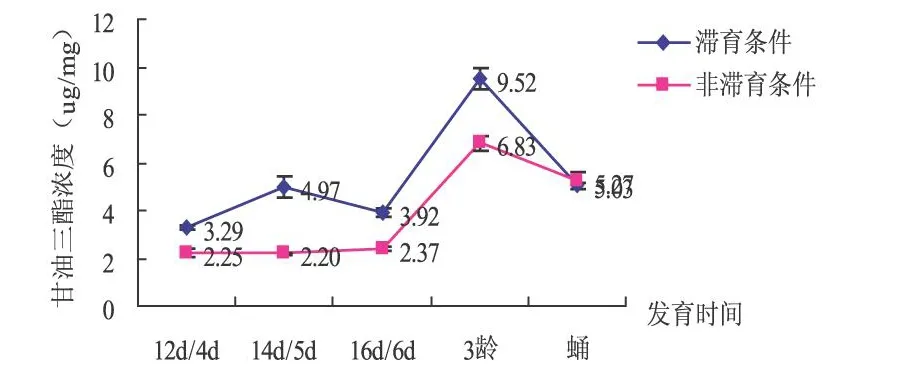
图4 滞育与非滞育条件是红侧沟茧蜂不同发育时间甘油三酯含量比较
2.5 滞育过程中中红侧沟茧蜂甘油三酯含量变化
从图5可以看出,甘油三酯的含量在中红侧沟茧蜂整个滞育过程中没有明显变化,且含量一直较少.储存10~20 d的时候含量较少3.74-3.41μg/mg,后逐渐增多,存50 d时达到最大值7.34μg/mg,蛹期略有降低为5.03μg/mg.
2.6 滞育与非滞育条件下中红侧沟茧蜂蛋白质含量比较
由图6可以看出,两种条件下,中红侧沟茧蜂在发育过程中蛋白含量变化趋势在前期大体相反,后期基本一致.在中红侧沟茧蜂进入滞育之前,非滞育条件下蛋白质含量较高-12 d/4d时:13.89μg/mg;14 d/5d:14.74μg/mg.滞育条件下分别为5.53μg/mg、5.66μg/mg.二者差异显著.

图5 中红侧沟茧峰滞育过程甘油三酯含量比较
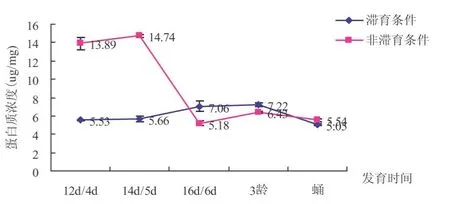
图6 滞育与非滞育条件下中红侧沟茧蜂不同发育时间蛋白质含量比较
2.7 滞育过程中中红侧沟茧蜂蛋白含量变化
由图7可以看出,中红侧沟茧蜂在滞育过程中蛋白质含量变化一直很平缓,数值无显著差异,且含量一直较低.滞育茧冷藏第60 d时达到最大值为8.47μg/mg.蛹期含量最少为5.05μg/mg.

图7 中红侧沟茧蜂滞育过程中蛋白含量变化
3 讨论与结论
昆虫为了顺利的越冬,一般可以通过越冬耐寒锻炼提高其对低温的耐受性.这种低温锻炼过程是通过抗冻保护性物质在体内的累积来灵活地调节虫体的过冷却点、体内降温速度等来达到安全越冬的目的[9-11].抗冻保护性物质如糖原、甘油、海藻糖、山梨醇和肌醇等.
本研究表明:中红侧沟茧蜂滞育条件下的糖原和海藻糖含量均高于非滞育条件下浓度,表明中红侧沟茧蜂进入滞育时糖原和海藻糖是主要的累积物质,为其向滞育方向发展奠定了物质基础.在滞育过程中,糖原的含量从进入滞育状态到滞育解除 (蛹期)一直处于较高水平;而海藻糖滞育的前期10-30 d时含量较少,后期逐渐增加,滞育解除时又降低.此结果显示:糖原在整个滞育过程中起主导作用,海藻糖在滞育后期起一定作用.同样以糖原或海藻糖为主进入滞育的昆虫有:柞蚕Antheraea pernyi,其滞育蛹的血淋巴中所含糖类为海藻糖和葡萄糖[12];麦红吸浆虫在土中滞育的绝大部分时间,海藻糖含量一直维持在一个较高的水平[13];斑蛾 Zygaena trif olii,其滞育幼虫糖原含量是非滞育幼虫的两倍多,糖原是其进入滞育后最重要的能源[14].早在1982年Hayakawa和Chino就已经提出滞育昆虫的糖醇积累型至少可分为两种类型:一类为糖原积累型;另一类为海藻糖积累型.由本试验结果可以看出:中红侧沟茧蜂属于糖原积累型昆虫.海藻糖在滞育后期虽出现上升趋势,但其生理功能目前尚未清楚,有待于进一步研究[15].
有些越冬昆虫通常也利用甘油,山梨醇等来降低过冷却点,提高抗寒能力.许多昆虫在进入滞育前或中均调节血淋巴中甘油三酯的含量,以保证血淋巴不被冻结[16,17].可以看出,昆虫的滞育与甘油三酯的含量有着密切关系[18,19],其中温度和光周期的变化是甘油三酯增多或减少的主要影响因子[17,20].中红侧沟茧蜂在滞育过程中甘油三酯的含量一直高于非滞育条件下的含量,对其度过寒冷的冬季打下良好基础.可见滞育条件-低温和短光照对中红侧沟茧蜂滞育前甘油三酯的积累有重要影响.在整个滞育过程中,滞育前期10-20 d时含量较低,中期30-60 d时含量较高,滞育结束-蛹期时含量又降低.此结果与仵钧祥[13]报道的小麦吸浆虫 (Sitodiplosis mosellana Gehin)滞育时甘油三酯的变化一致.
在滞育过程中,中红侧沟茧蜂的蛋白质含量一直较低,且不同阶段并无显著差异.在滞育后期蛋白质含量略高于非滞育条件下含量.这与赵章武等人研究结果一致即非滞育昆虫脂肪体或血淋巴中的可溶性蛋白质含量低于滞育昆虫脂肪体或血淋巴中的可溶性蛋白质含量[21].
在中红侧沟茧蜂整个滞育发育及滞育过程中,比较几种生理指标数值,糖原含量一直高于海藻糖、甘油三酯、蛋白质的含量,故此研究结果表明中红侧沟茧蜂滞育时的主要抗寒物质是糖原.
[1] Tobias VI.Brakonidy kavkaza(Hemenoptera:braconidae)[M].Nauka:Leningrad,1976:287
[2] Said M K,MustafaǑ.Biology of Microplitis mediator(Hym:Braconidae)a gregarious endoparasite of Agrotis Segetum(Lep:Noctuidae)[J].Bio Control,1988,33(02):211-217
[3] 何俊华,王德安.中红侧沟茧科新记录种:中红侧沟茧蜂 [J].华北农学报,1992,7(03):123
[4] Shenefelt RD.Part 9.Braconidae;5.Macrogasterinae and Ichneutinae[A]Vecht J,Shenefelt RD.Hymenopterum catalogus nova edito[C].WJunk,Gravenhage:The Netherlands,1973:750-751.
[5] Arthur AP,Mason PG.Life history and immature stages of the parasitoid Microplitis mediator(Hymenoptera:Braconidae),reared on the bertha armyworm Mamestra configurata(Lepidoptera:Noctuidea)[J].Can Entom,1986,118(05):487-491
[6] 王德安,南留柱,孙洗,等.棉铃虫低龄幼虫寄生蜂-侧沟茧蜂生物学研究 [J].昆虫天敌,1984,6(04):211-216
[7] Vinson SB,Pennacchio F,Lanzrein B.Interactions between parasitoids and their hosts an introduction and perspective[J].J Insect Physiol,1998,44:701-702
[8] Blumberg D,Navon A,Goldenberg S,et al.Interactions among Helicoverpa armigera(Lepidoptera:Noctuidae),its larval endoparasitoid Microplitis croceipes(Hymenoptera:Braconidae),and Bacillus thuringiensis[J].J Econom Entom,1997,90(05):1181-1186
[9] Salt RW.Role of glycerol in the cold-harding of Bracon cephi(Gahan)[J].Can J Zool,1959,37:59-69
[10] Zachariassen KE.The mechanism of the cryo-protective effect of glycerol in beetles tolerant to freezing[J].J Insect Physiol,1979,25(01):29-32
[11] Liu HX,Li G,Wu WJ.Entomological Biochemical[M].Xi’an :Science and Technology Press of Shanxi,1998 :263
[12] Lu MX.Effect of temperature and p hotoperiod on dynamics of carbohydrate contents in haemolymph and fatty body of pupa of Antheraea pernyi[J].Acta Entomol Sinic,1992,35(01):1-7
[13] 仵均祥,袁峰,苏丽.麦红吸浆虫幼虫滞育期间糖类物质变化 [J].昆虫学报,2004,47(02):178-183
[14] Wipking W,Viebahn M,Neumann D.Oxygen consumption,water,lipid and glycogen content of early and late diapause and non-diapause larvae of the burnet moth Zygaena trifolii[J].J Insect Physiol,1995,41(01):47-56
[15] Hayakawa Y.Growth-blocking peptide:an insect biogenic peptide that prevents the onset of metamorphosis[J].J Insect Physiol,1982,41:1-6
[16] Asahina E.Freezing and frost resistance in insects[A].Meryman HT.Crybiology[C].New York:Academic press 1966,6(05):425-482
[17] Asahina E.Frost resistance in insects[J].Adv Insect Physiol,1969,6:1-50
[18] Wyatt GR.The biochemistry of sugars and polysaccharides in insects[J].Adv Insect Physiol,1967,4:287-360
[19] Mansingh A.Studies on insect dormancy.Ⅱ.Relationship of cold-hardiness to diapause and quiescence in the Eastern tent caterpillar,Malacosoma americanum(Fab.),(Lasiocamnidae:Lepidoptera)[J].Can J Zool,1974,52:629-637
[20] Danks HV.Insect Dormancy:an Ecological Perspective[J].Bio Survey Can(Terrestrial Arthropods),Ottawa,1987,336-339
[21] 赵章武,黄永平.昆虫滞育关联蛋白的研究进展 [J].昆虫知识,1996,33(03):187-191
