河北省2005年~2007年生肉源单增李斯特菌的血清型及脉冲场凝胶电泳分析*
2010-01-13张耀祺王彬师宝忠闫鹤石磊
张耀祺,王彬,师宝忠,闫鹤,石磊
1(华南理工大学轻工与食品学院,广东广州,510640) 2(保定职业技术学院,河北保定,071000)3(河北省生物工程技术研究中心,河北保定,071002)
单核细胞增生李斯特菌(Listeria monocytogenes)简称单增李斯特菌,属于李斯特菌属(Listeria),为细胞内寄生的革兰氏阳性杆菌。单增李斯特菌是重要的人兽共患病病原体,也是食品中常见的,公共卫生学上重要的食源性病原体[1]。WHO和FDA于1986年设立了李斯特菌研究中心,专门协调该菌的病原学、流行病学及临床等研究工作。该菌已被列为20世纪90年代四大食源性疾病致病菌之一[2]。
单增李斯特菌广泛分布在自然环境中,如土壤、污水、饲料、动物、健康人携带者及各种生食和即食食品中包括生肉及熟肉制品、速冻米面食品、奶酪、蔬菜、沙拉和海产品等[3]。近十几年来世界各地,特别是美国、法国、英国、西班牙和日本等发达国家,因单增李斯特菌污染食品而引起食源性疾病爆发日益增多,该菌致病性强、致死率高达30%[4-5]。我国到目前为止,虽未出现有关单增李斯特菌引起食物中毒爆发流行的报道,但从国内多篇调查报道了解,单增李斯特菌多年来在我国猪、羊、鸡、牛、兔等家禽家畜中有流行[6-7],并已经报告的临床散发病例有数十例[8]。目前食品中由单增李斯特菌引起的中毒已引起世界各国的重视。
血清分型法虽已被用于单增李斯特菌的流行病学调查和群体遗传学研究,但是与分子分型方法相比,重复性差且分辨力不高,一般作为分型的辅助方法[9]。脉冲场凝胶电泳分型(Pulsed-Field Gel Electrophoresis,PFGE)具有分型能力强、分辨力高、重复性好、结果易于解释等优点,是目前分子分型方法的黄金标准。20世纪80年代末90年代初,PFGE开始被用于单增李斯特菌的分型研究[10]。单增李斯特菌的血清分型和脉冲场凝胶电泳分型促进了对李斯特菌病暴发的监控和单增李斯特菌污染源的追踪,该领域的进一步研究为李斯特菌病的有效预防与控制奠定重要基础。
1 实验材料
1.1 菌株
53株单增李斯特菌分离自2005年~2007年中国河北省的各种生肉类食品,见表1。
1.2 仪器与试剂
Smart Spec Plus型分光光度计,Bio-Rad公司;CHEF MAPPER型脉冲场凝胶电泳仪及配套设备,Bio-Rad公司;凝胶成像系统,Bio-Rad公司。
脑-心浸萃液态培养基(BHI),广东环凯微生物科技有限公司;单增李斯特菌分型血清,日本デンカ生研株式会社;低熔点琼脂糖、电泳级琼脂糖,Bio-Rad公司;溶菌酶、蛋白酶K,Sigma公司;限制性内切酶ApaⅠ,CHIMERx公司;十二烷基硫酸钠(SDS),北京普博欣生物科技有限公司;细胞裂解液(CLB);1×TE缓冲液;0.5×TBE电泳缓冲液。
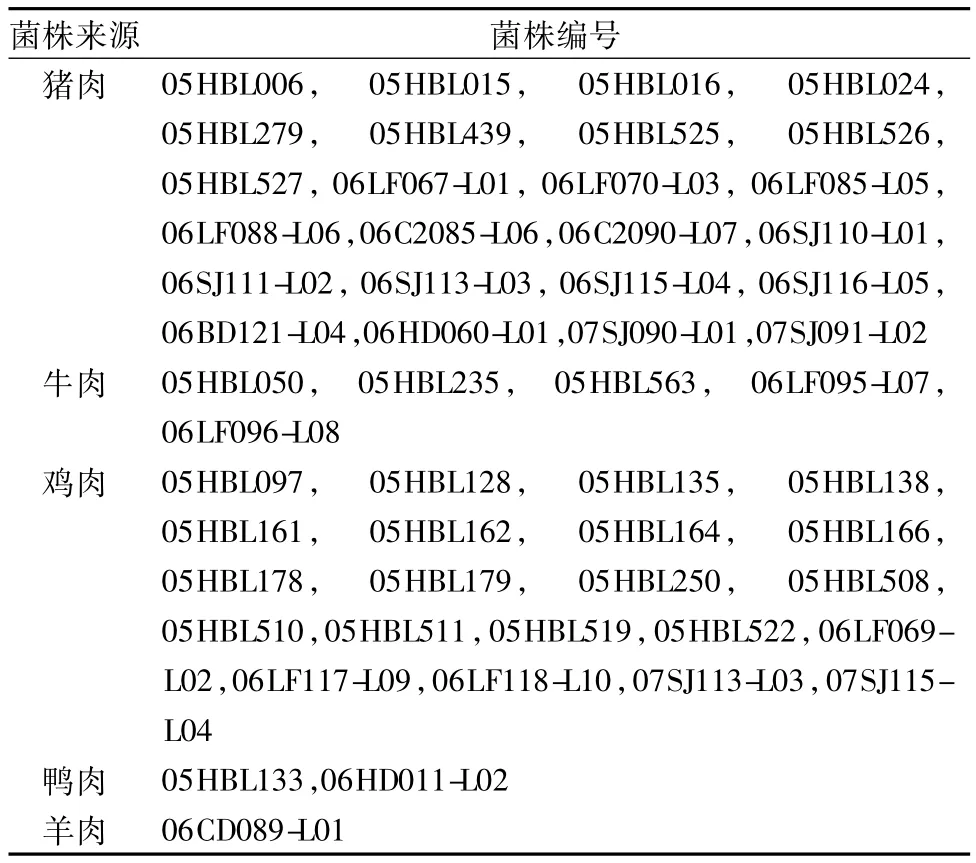
表1 单增李斯特菌菌株来源
2 方法
2.1 血清分型实验
参照单增李斯特菌诊断血清使用说明书,O抗原采用玻片凝集法,H抗原采用试管凝集法。
2.2 PFGE 分型实验
从冻存管中挑细菌接种于BHI培养基中,37℃振荡培养过夜。取2 mL菌液于离心管中,高速离心沉淀细菌,用TE缓冲液洗涤3次。加入适量TE缓冲液重新悬浮细菌,将悬液OD600nm的吸光度调整在1.25 ~1.35之间[11]。取 300 μL 菌液加入工作浓度为20 mg/mL的溶菌酶,混合均匀,37℃温育30 min。加入等体积SSP消化液(1%SDS,1.2%低熔点琼脂糖,0.2 mg/mL蛋白酶K,50℃)混匀后倒入模具制备胶块。将完全凝固的胶栓转入含有2 mL细胞裂液的离心管中,54℃振摇孵育2 h。用54℃预热的双蒸水洗涤胶栓2次,每次浸泡10 min。用54℃预热的TE缓冲液洗涤胶栓4次,每次浸泡15 min。最后每管加入5 mL pH值8.0的TE缓冲液。然后切胶至1.5 mL PE管中,加入300 μL酶切反应体系(其中含ApaⅠ酶200U),于37℃酶切反应过夜[12]。消化后的样品栓置于1.2%的凝胶加样孔中进行脉冲场电泳。电泳条件:电泳温度14℃,电压6 V,脉冲角度120°,脉冲时间4~40 s,电泳时间 22 h[13]。电泳结束后,将凝胶用1 μg/mL的EB溶液染色30 min,在凝胶成像系统读胶。用Quantity One软件对数据进行聚类分析。
3 结果
3.1 血清分型实验结果
本研究分别对53株单增李斯特菌进行血清学分型,结果分属5个血清型。其中 29株为1/2a(54.72%),11 株为 1/2b(20.75%),10 株为 1/2c(18.87%),2 株为 4b(3.77%),1 株为 4c(1.89%)1/2a,1/2b和1/2c属于主要血清型。各菌株对应的血清型详见图1。
3.2 PFGE图谱聚类分析结果
本研究对53株单增李斯特菌进行了PFGE分型,基因组DNA用ApaⅠ酶切后,经电泳DNA片段得到良好的分离,53株均产生清晰的条带,各株细菌DNA条带数目为10~13条。所有单增李斯特菌菌株的PFGE图谱结果用Quantity One软件进行分析,其相似值在52% ~100%。PFGE图谱详见图1。
Tenover等[14]提出了有关菌株同源性的判别标准,按其电泳条带可分为:无差异,说明为相同菌株;有1~3条带的差异说明菌株间有相近关系,且只有单基因的改变;4~6条带的差异说明菌株间可能有相近关系,表示出有2个独立基因的差异;如菌株间有6条带或更多条带差异,说明有3个或更多基因的变化,被视为无相关性。根据实验结果可把53株单增李斯特菌分成17个基因型(A-Q)。主要型别为Q型(12株),占总数的22.64%(12/53),提示该型为河北省生肉类食品主要基因型。其余依次降低的型别为P型15.09%(8/53),L型13.21%(7/53),J型11.32%(6/53)。基因分型结果详见图1。
4 讨论
血清分型是一种传统的细菌分型方法。根据菌体O抗原和鞭毛H抗原,可将单增李斯特菌分为16个血清型:1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e、5、6a、6b 和 7。抗原结构与毒力无关,对人致病的主要为血清型为4b,其次是1/2a和1/2b,3者约占本病的90%[15],其中大多数经由食物污染引起的李斯特菌病属于4b血清型[16]。本次从食品中分离得到的53株单增李斯特菌的血清型主要为1/2a(54.72%),1/2b(20.75%)和 1/2c(18.87%),4b血清型却相对较少,这与国内外的相关报道一致[17-18]。这几种血清型均有较强的致病性,能引起严重的李斯特菌食源性疾病,危害身体健康。因此,应加强相关食品中单增李斯特菌的监测力度,重点防治由上述几种血清型菌株引起的食物中毒。
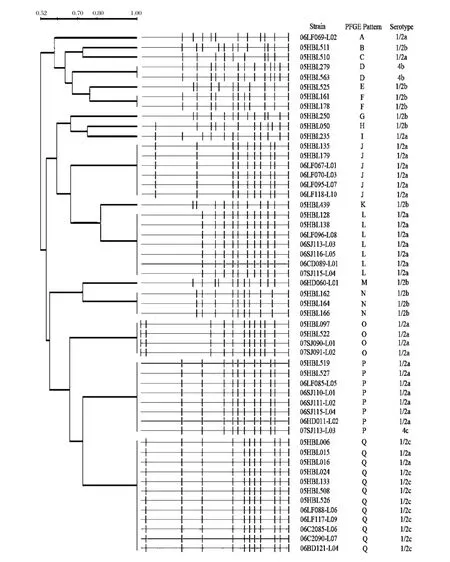
图1 LM菌株的PFGE聚类树状图
PFGE如今已经广泛用于单增李斯特菌的分子流行病学和溯源性追踪研究,并被认为是目前所有分型方法中最为可靠的一种。从本次研究菌株的PFGE聚类分析图谱来看,53株单增李斯特菌分成17个基因型(A-Q),其中Q型为河北省流行的主要基因型,占总数22.64%。17个基因型之间出现了4条以上的差异条带,说明这些菌株的基因型不紧密相关。虽然有一部分菌株之间遗传学表现形式相同,但是大部分菌株在遗传学上有不同的表现形式,即菌株之间的相关性不大,证明各类食品中的单增李斯特菌的污染是来自多方面的,多个克隆株的。
综合血清分型和PFGE分型结果进行分析,在4种主要的PFGE基因型中,Q型(22.64%)包括了血清型1/2a和1/2c;P型(15.09%)包括血清型1/2a、4c;L型(13.21%)和J型(11.32%)都只含血清型1/2a。对人致病的最主要血清型4b有两株,都分布于H基因型(见图1)。血清型和PFGE 2种分型方法各具特色,相互不能替代,两者从不同侧面反映单增李斯特菌的分型特点。结合两种分型方法能更好地了解单增李斯特菌各菌株之间的遗传相关性及流行病学特征,促进了对李斯特菌病暴发的监控和单增李斯特菌污染源的追踪。
[1] Luca Cocolin,Kalliopi Rantsiou,Lucilla Iacumin,et al.Direct indentification in food samples of Listeria spp.and Listeria monocytogenes by molecular methods[J].Applied and Environmental Microbiology,2002,68(12):6 273-6 282.
[2] Nakama A,Matsuda M,Amils Z,et al.Molecular typing of Listeria monocytogenes isolated in Japan by pulsed-field gel electrophoresis[J].Vet Med Sci,1998,60:749 -752.
[3] Gombas D E ,Chen Y,Clavero R S,Survey of Listeria monocytogenes in ready-to-eat foods[J].Food Prot,2003,66:559-569.
[4] Swaminathan B,Gerner P.The epidemiology of human listerosis[J].Microbes and Infection,2007,9(10):1236.
[5] Lynch M,Painter J,Woodruff R,et al.Surveillance for foodborne-disease outbreaks-United States[J].1998 -2002.MMWR Surveill.Summ,2006,55:1-42.
[6] 滕振文,孙让林.由产单核细胞李氏杆菌引起母牛流产和犊牛腹泻的诊断报告[J].中国畜禽传染病,1989,2:25-26.
[7] 郭仰霖,曾凡伟.上杭县禽、畜李斯特氏杆菌携带状况调查[J].海峡预防医学杂志,2002,6:251.
[8] 张秀丽.河南省食品中单核细胞增生李斯特氏菌污染状况的调查[J].中国公共卫生,1998,14(10):616 - 617.
[9] Wiedmanm M.Molecular subtyping methods for Listeria monocytogenes[J].JAOAC Int,2002,85(2):524 -531.
[10] Buchrieser W,Brosch M,Catimel T,et al.Pulsed-field gel electrophoresis applied for comparing Listeria monocytogenes strains involved in outbreak [J].Can J Microbiol,1993,39:495 -500.
[11] 许珂,祝仁发,斯国静,等.杭州市26株单增李斯特菌脉冲场凝胶电泳分型[J].中国卫生检验杂志,2006,16(8):919-920.
[12] Graves L M,Swaminathan B.Pulsenet standardized protocol for subtyping Listeria monocytogenes by ma-crorestriction and pulsed-field gel electrophoresis[J].International Journal of Food Microbiology,2001(65):55 -62.
[13] Graves L M,Swaminathan B,Reeves M H,et al.Comparison of ribotyping and multilocus enzyme electrophoresis for subtyping of Listeria monocytogenes isolates[J].Journal of Clinical Microbiology,1994,32:2 936 -2 943.
[14] Tenover F C,Arbeit R D,Goering R V,et al.Interpreting chromosomalDNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J].Journal of Clinical Microbiology,1995(33):2 233-2 239.
[15] Liu D,Lawrence mL,Gorsk,et al.Listeria monocytogenes serotype 4b strains belonging to lineagesⅠandⅡposses distinct molecular features[J].J Clin Microbiol,2006,44(1):214-217.
[16] Kathariou S.Listeria monocytogenes virulence and pathogenicitv,a food safety perspective[J].J Food Prot,2002,65:1 811-1 829.
[17] 潘军航,梅玲玲,张严峻,等.食品中单增李斯特菌血清型及耐药性监测[J].中国公共卫生,2008,24(1):107-108.
[18] Latorre L,Parisi A,Fraccalvieri R,et al.Low prevalence of Listeria monocytogenes in foods from Italy[J].Journal of Food Protection,2007,70:1 507 -1 512.
