四氯联苯对鸡外源原始生殖细胞迁移的影响
2010-01-13张易祥金秀梅李赞东采克俊丁志丽中国水产科学研究院湖州师范学院细胞工程研究所浙江湖州33000中国农业大学生命科学院北京00094
张易祥,金秀梅,李赞东*,刘 莉,采克俊,丁志丽 (.中国水产科学研究院湖州师范学院,细胞工程研究所,浙江 湖州 33000;.中国农业大学生命科学院,北京 00094)
多氯联苯(PCBs) 是联苯被氯原子取代后的产物,由于其脂溶性强,半衰期长,在环境中不易降解,易通过食物链富集在人和动物体内,已造成全球性的污染[1-2].实验表明,早期胚胎暴露于PCBs中会导致出生后发育异常,引起睾丸、附睾、前列腺和精细管损伤,精子质量下降[3].PCBs家族中的许多种类有雌激素作用,能干扰接触个体或其后代的内分泌功能,导致神经系统、免疫系统、生殖系统障碍[4-5].发育中的组织器官尤其对这类物质敏感,在动物发育的某些关键时期,一旦受到这些物质的影响,往往对其生殖系统造成不可逆转的损害,并具有遗传性[6].2,2',5,5'-四氯联苯(PCB 52)是 PCBs中的一种,被认为具有雌激素活性,可干扰动物的内分泌系统[7].
禽类原始生殖细胞(PGCs)是精子和卵子的祖细胞,其迁移伴随着高速增殖.这些细胞起源于胚胎外胚层,然后经下胚层移动到生殖新月区,最后,这些细胞进入血液循环,在生殖原基附近穿过毛细血管壁定居到生殖原基,在生殖原基分化成精子或者卵子[8].在此过程中数量从几十个增加到一千多个.
利用禽胚研究环境污染物的影响,一直以来的操作方法是直接将污染物注入到卵黄或者受精卵气室中.本研究利用禽PGCs迁移路线长(从起源到定居需100多小时),较哺乳动物易于操作的特点,分离发育至14期的鸡胚PGCs,用PKH26荧光染料进行标记后做为供体细胞,显微注射移植到用 PCB 52处理的受体鸡胚生殖新月中,然后检测血液和生殖原基中的外源 PGCs,研究PCB 52对PGCs迁移和增殖的影响.影响动物原始生殖细胞的发育及增殖的环境因素基本相似[9],所以研究环境污染物对禽类 PGCs发育的影响,对揭示一些鸟类尤其是濒危鸟类数量减少的原因有重要的参考意义.
1 材料与方法
1.1 材料和试剂
白来航种鸡蛋购自中国农业大学养禽场.四氯联苯(PCB 52)和雌二醇(E2)购自美国Accustandard 公司,溶于二甲基亚砜(DMSO),配成 100mg/mL溶液,-20℃储存,使用时用最基础培养基(MEM)稀释.PKH26试剂盒购自Sigma公司,操作按照试剂盒说明书进行.白消安购于Sigma公司,使用时先用DMSO溶解,然后加入花生油充分乳化(油和 DMSO最终体积比为9:1).Nycodenz 购自Nycomed Pharma AS公司.
1.2 实验方法
1.2.1 供体鸡胚血液中 PGCs的采集[10]新鲜白来航鸡种蛋用 70%的酒精擦拭消毒后在38.5℃,相对湿度 70%,90°/h的转蛋条件下培养56h左右,使胚胎发育至14期左右,然后用微玻璃针由胚胎血管中抽取含有 PGCs的血液,悬浮于不含血清的 Dulbecco′s MEM(DMEM)培养液中.800×g离心5min弃上清液,加入10μL培养基.
1.2.2 供体鸡胚血液细胞PKH26标记 PKH26的标记参照试剂盒说明书进行,简要步骤如下:1)取细胞数1×107个/μL胚胎血细胞10μL,加试剂盒稀释液C 200μL,然后加5×10-6mol/L的PKH26 200μL,反复颠倒离心管染色3min;2)加400μL血清,置37℃ 1min使反应停止;3)加800μL含5%血清DMEM, 800×g离心5min,弃上清.重复洗涤3次,每次换新离心管;4)加1mL DMEM重悬.在荧光显微镜下确认细胞的标记率及荧光强度.
1.2.3 供体鸡胚 PGCs 的 PKH26标记后纯化 PGCs的纯化参照文献[11]的方法进行,简要步骤如下:将上述标记好的细胞 1200×g离心后弃上清,加1mL8% Nycodenz.在5mL离心管中底部加入 1mL12%Nycodenz,中部加 8%血液Nycodenz 混合液,上部加0.2mL 2% Nycodenz溶液.800×g 4℃离心 20min.收集 8%和 12% Nycodenz界面处的细胞各约0.3mL,置于离心管中.加1.4mL DMEM混匀,1200×g 4℃离心5min,重复洗涤 3次.弃上清液,加适量 DMEM,调整PGCs数为大约1000个/μL.
1.2.4 受体鸡胚内源性 PGCs的去除 用打孔器在种蛋气室打一小孔,然后用注射器由气室将白消安溶液注入卵黄.白消安使用浓度1.0µg/µL.每枚注射体积50µL.石蜡封口后38.5℃, 相对湿度70%, 90°/h的转蛋条件下孵化.
1.2.5 受体鸡胚的E2和PCB 52处理 将上述用白消安处理后的种蛋用牙钻打一直径大约5mm的窗孔,用微玻璃针将PCB 52或E2注入到靠近胚盘处,石蜡膜封闭窗口.E2剂量为每个鸡胚100μmol/L,PCB 52剂量为每个鸡胚10μmol/L,注射体积为每个鸡胚1μL.对照分为2组,一组鸡胚只注射E2或PCB 52等浓度的DMSO,一组不作任何处理(对照组受体均经过白消安处理).
1.2.6 PKH26标记的供体PGCs注射入处理组受体鸡生殖新月区域 将上述PCB 52或E2处理过的受体种蛋在 38.5℃,相对湿度 70%,90°/h的转蛋条件下培养至8~10期.然后用微注射法把上述标记PGCs 1μL导入受体胚盘生殖新月区域,密封后在相同条件下继续孵化至 13~15期和27~29期.对照组也注射相同数量的标记PGCs.
1.2.7 注射外源 PGCs后的受体胚胎继续孵化至13~15期时血液PGCs的采集和计数 待上述移植了标记PGCs的受体鸡胚孵化至13~15期时,用镊子小心打开蛋壳暴露胚胎,实体显微镜下以微玻璃针经背主动脉采血 1μL,加入培养液中混匀,800×g离心 5min,弃上清,加入 10μL培养基.取 5μL涂片,荧光显微镜下进行 PKH26标记PGCs的计数.PKH26标记细胞在绿光下呈红色荧光.
1.2.8 注射外源PGCs后的受体鸡胚继续孵化至5.5d时性腺PGCs的分离和计数 待上述移植了标记PGCs的受体鸡胚孵化至5.5d,此时鸡胚大部分发育至27期.将1对性腺置于含10%胎牛血清(FBS)的 DMEM(冰浴操作)中,然后置于含250μL 0.02% EDTA的PBS于37℃孵育,15min后用针头轻轻切割性腺.充分切割后的细胞悬液加入1.5mL含20%FBS 的DMEM 450×g离心5min.10μL DMEM重悬.混匀,取 5μL,涂片,荧光显微镜观察计数.
1.3 统计分析
统计分析软件采用 SPSS 11.5.资料在统计分析前均经SPSS的Explorer分析,数据均呈正态分布且方差相等.各组实验数据以均值±标准误表示,显著性水平设置为α=0.05.
2 实验结果
2.1 PCB 52对外源PGCs数量影响
所有受体鸡胚注入 PKH26标记的外源PGCs,在外源PGCs沿生殖新月-血液循环-生殖原基迁移的过程中检测其数量变化.结果表明(表1),PCB 52处理组的PGCs数量明显低于未处理组及等量DMSO处理组,说明PCB 52可明显降低外源PGCs的增殖性迁移(P<0.05).

表1 PCB52对PKH26标记外源PGCs数量的影响Table 1 Effect of PCB52 on proliferative migration of exogenous PGCs labeled PKH26
2.2 E2对外源PGCs数量的影响
为确定PCB 52对鸡胚的影响是否其雌激素作用,特设立E2处理组(表2),将PKH26标记的外源PGCs注入上述3组受体生殖新月,区域继续孵化,检测13~15期和27~29期的标记PGCs数量变化.结果表明,E2对外源PGCs的增殖性迁移无明显影响(P>0.05).
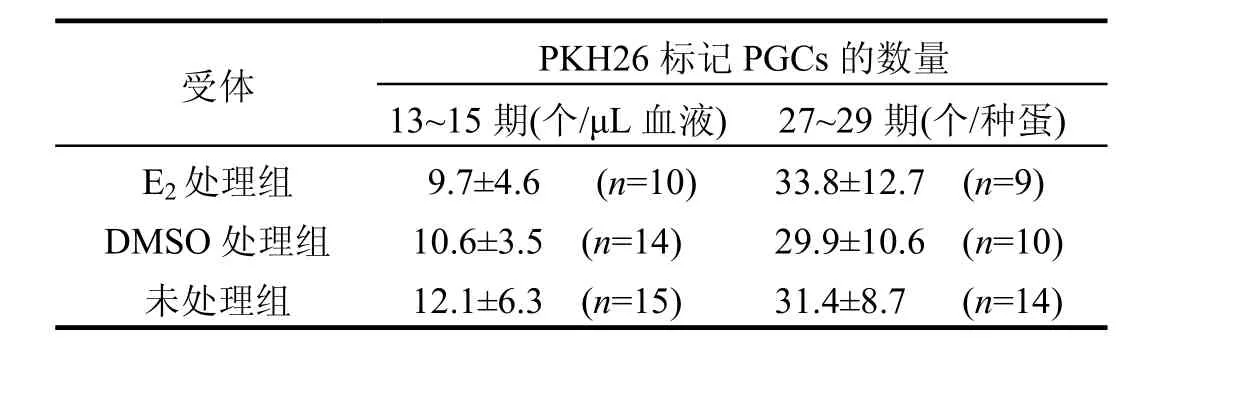
表2 E2对PKH26标记外源PGCs数量的影响Table 2 Effect of E2 on proliferative migration of exogenous PGCs labeled PKH26
3 讨论
本实验中PCB 52的使用剂量采用PCB 52污染地区鸟类体内 PCB 52的浓度[12],以便在实验室条件条件下模拟自然界PCB 52的污染浓度.以往利用鸡胚研究污染物的影响时,通常将污染物注射到卵黄或者受精卵气室,本实验紧邻胚盘导入PCB 52,可使PCB 52立即对PGCs产生影响.因为鸡胚是典型的端黄卵,如果将外源物质注入到气室或者远离胚胎的其他位置,微量外源物质难以对迁移中的PGCs产生作用.
PCB 52被认为具有雌激素活性[7].在受PCBs污染地区,从食虫性鸟类(如大山雀)到食肉性猛禽(如埃及秃鹰)体内都可以检测到 PCB 52[12].尽管体内的PCB 52没有对成年鸟的健康造成明显损害,但对其所产卵有明显影响[12].实验证明,用PCBs处理未孵化鸡胚,对出壳后的鸡胚生殖系统可造成明显损害,影响其卵子和精子的形成[12-15].鸟类PGCs起源于胚胎外胚层,孵化过程中不同发育时期的PGCs均是在此基础上通过增殖性迁移而来.追踪不同发育时期的 PGCs数量,就可揭示环境污染物对PGCs的增殖性迁移影响[8].
本课题组以往的实验证明,PCB 52可明显降低原条期明区和血液中内源性PGCs的数量,并证明PCB 52对血液中PGCs的影响是由于降低了生殖新月明区PGCs的缘故[10].本实验通过显微移植技术,将供体鸡胚PGCs用PKH26荧光染料标记,然后移植到经PCB 52处理的受体鸡胚,随后检测发育至13~15期和27~29期时的PKH26标记的PGCs数量.结果表明,PCB 52可明显降低外源PGCs在血液和性腺中的数量,说明PCB 52对外源性 PGCs迁移有明显的阻碍作用.以往实验[16]和本实验结果表明,E2对内源性及外源性PGCs的增殖性迁移均无影响.E2对内源和外源PGCs的增殖性迁移无明显影响的机制是否与PGCs膜上的受体表达有关,或PGCs膜上受体表达的时空性等问题还有待于进一步探讨.E2对PGCs的迁移无明显影响,揭示PCB 52可能影响的是受体性腺的诱引物质,且这种影响是非雌激素作用.
由于内源性 PGCs的消除可明显提高外源性PGCs移植效率,所以在本实验中除了用PCB 52和E2处理受体鸡胚外,还用白消安进行了受体的处理.Song等[17]的研究表明,用白消安处理鸡胚盘,能明显降低内源性的PGCs数量,但对白消安处理鸡胚继续孵化20多个小时后注入的外源性PGCs的增殖性迁移无明显影响.
本实验所用的PKH26可有选择地嵌入细胞膜脂质层从而细胞被染色.PKH26从细胞溶出的半衰期是100d以上(体内),这种特性使得PKH26在生物体内的跟踪研究细胞时与其他标记物相比,具很大优势.在本实验中,通过PKH26的跟踪研究,发现PCB 52可明显降低外源PGCs的在血液循环中和生殖原基中的数量,这表明 PCB 52在鸡胚体内的半衰期很长,对细胞的毒性影响最少持续100多小时,对胚胎的原始生殖细胞可造成长久的有害影响.
4 结论
4.1 本实验表明, PCB 52对外源性PGCs的增殖性迁移有明显影响.
4.2 E2对外源性PGCs的增殖性迁移无明显影响.
[1] 黄健生,贾晓平,甘居利.珠江口印度洋瓶鼻海豚皮脂的多氯联苯研究 [J]. 中国环境科学, 2007,27(4):461-466.
[2] Clark P F, Mortimer D N, Law R J, et al. Dioxin and PCB contamination in Chinese mitten crabs: human consumption as a control mechanism for an invasive species [J]. Environmental Science and Technology, 2009,43:1624-1629.
[3] Gupta C. Reproductive malformation of the male offspring following maternal exposure to estrogenic chemicals [J]. Proceedings of the Society for Experimental Biology and Medicine, 2000,224:61-68.
[4] Phillips D I, Barker D J, Fall C H, et al. Elevated plasma cortisol concentrations: a link between low birth weight and the insulin resistance syndrome? [J]. The Journal of Clinical Endocrinology and Metabolism, 1998,83:757-760.
[5] Nielsen M, Bjornsdottir S, Hoyer P E, et al.Ontogeny of oestrogen receptor alpha in gonads and sex ducts of fetal and newborn mice[J]. Journal of Reproduction and Fertility, 2000,118: 195-204.
[6] Iguchi T,Watanabe H, Katsu Y.Application of ecotoxicogenomics for studying endocrine disruption in vertebrates and invertebrates [J]. Environmental Health Perspectives, 2006,114(Suppl 1):101-105.
[7] Pukazhenthi B, Comizzoli P, Travis A J, et al. Applications of emerging technologies to the study and conservation of threatened and endangered species [J]. Reproduction, Fertility and Development, 2006,18:77-90.
[8] Kuwana T, Rogulska T. Migratory mechanisms of chick primordial germ cells toward gonadal anlage [J]. Cellular and Molecular Biology, 1999,45:725-736.
[9] Iona S, Klinger F G, Sisti R, et al. A comparative study of cytotoxic effects of N-ethyl-N-nitrosourea, adriamycin, and mono-(2-etnylnexyl)pnthalate on mouse primordial germ cells [J]. Cell Biology and Toxicology, 2002,18:131-145.
[10] 张易祥,金秀梅,李赞东.四氯联苯对鸡胚生殖新月原始生殖细胞分布的影响 [J]. 中国兽医学报, 2008,28(11):1325-1328.
[11] Zhao D F, Kuwana T. Purification of avian circulating primordial germ cells by Nycodenz density gradient centrifugation [J]. British Poultry Science, 2003,44:30-35.
[12] Wiesmüller T, Schlatterer B, Wuntke B, et al. PCDDs/PCDFs, coplanar PCBs and PCBs in barn owl eggs from different areas in the state of Brandenburg, Germany [J]. Bulletin of Environmental Contamination and Toxicology, 1999,63:15-24.
[13] 方昌阁,张才乔,夏国良,等.多氯联苯对鸡胚睾丸结构的损伤作用 [J]. 中国兽医学报, 2002, 22(2):168-70.
[14] 方昌阁,张才乔,夏国良,等.多氯联苯对鸡胚卵巢发育和配子分化的影响 [J]. 中国农业大学学报, 2001,6(1):1-5.
[15] 解美娜,张才乔,曾卫东,等.多氯联苯对鸡胚性腺发育的毒性和雌性激素作用 [J]. 中国兽医学报, 2004,24(3):274-276.
[16] Zhang Y, Jin X, Han H, et al. Effects of 2,2', 5,5'-Tetrachlorobiphenyl on migration of chicken primordial germ cells[J]. Reproduction, Fertility and Development, 2005,17:587-591.
[17] Song Y, D'Costa S, Pardue S L, et al. Production of germline chimeric chickens following the administration of a busulfan emulsion [J]. Molecular Reproduction and Development, 2005,70: 438-444.
