水源水中微囊藻毒素的遗传毒性与健康风险评价
2010-01-13王伟琴金永堂孙肖瑜庞晓露浙江大学公共卫生学院环境医学系浙江杭州30058浙江省环境监测中心浙江杭州300
王伟琴 ,金永堂 *,吴 斌 ,孙肖瑜 ,庞晓露 ,王 静 (.浙江大学公共卫生学院,环境医学系,浙江 杭州30058;.浙江省环境监测中心,浙江 杭州 300)
近年来,一些作为饮用水源的湖泊、水库等水体富营养化及蓝藻水华爆发已严重威胁到人民群众的饮用水安全[1].蓝藻水华爆发不仅造成水质下降,而且还释放出内源性藻毒素,其中微囊藻毒素(MC)是出现频率最高,危害最严重的藻类毒素[2],微囊藻毒素-LR(MC-LR)是我国富营养化水体中毒性较大的常见亚型,能强烈抑制蛋白磷酸酶 1(PP1)和蛋白磷酸酶 2A(PP2A)的活性[3],具有肝脏毒性和肿瘤促进作用[4].常规水处理方法不能完全去除水中的 MC[5],为确保居民饮用水安全,迫切需要对MC污染水体的健康风险进行评价,并提出相应的防制措施.目前对水环境污染物的健康风险评价多使用数学模型和动物模型[6],尽管对水中污染物的遗传毒性研究较多,但是对人体可能具有的远期健康效应的评价却较少.本研究对浙江省101个县级以上集中式饮用水源水中的176种污染物进行了监测,结果显示MC是其中分布最广、且非致癌健康风险最高的污染物.因此,采集 MC污染严重的水源水样,一部分采用树脂对其中的藻毒素进行浓集,另一部分以水源水稀释不同浓度的MC-LR纯毒素模拟了水中MC不同的污染状况,检测与分析了MC对鱼的生态毒性和细菌致突变性及水源水中不同浓度的 MC对人体DNA损伤的远期效应.
1 材料与方法
1.1 仪器与试剂
CO2恒温培养箱(美国 Thermo Fisher Scientific公司),DYY-11B型水平电泳仪(北京市六一仪器厂),BX51型荧光显微镜及 DP50数码摄像头(日本Olympus公司),水族箱(广东日生公司),真空过滤系统(天津津腾实验设备有限公司),Autotrace固相萃取仪(美国Zymark公司),旋转蒸发器(瑞士 Buchi公司),氮吹仪(美国Organomation公司),Oasis HLB 小柱(6mL、500mg, 美国Waters公司).
MC-LR标准品(瑞士Alexis公司),纯度95%,用色谱级甲醇稀释为500µg/mL的母液,-20℃保存;正常熔点琼脂糖(NMA)、低熔点琼脂糖(LMA)、溴化乙锭(EB)、葡萄糖-6-磷酸、2-甲氯基-6氯代-9-[3-(2-氯乙基)氨基丙胺]吖啶-2盐酸(ICR-191) (美国Sigma);RPMI 1640培养基(美国Gibco);柔毛霉素(Pharmacia Italia S.p.A);2-氨基芴(ALDRICH),其余试剂为国产分析纯.
1.2 水样采集和检测
2008年5月丰水期,采集了浙江省101个县级以上集中式饮用水水源地的地表水样(水面下0.5m),检测了水中MC-LR和MC-RR的含量.
太湖是我国第3大淡水湖,是周围城市重要的饮用水源地,近年来蓝藻污染水体事件常有发生,于2008年5月丰水期,采集了该流域湖州地区城北水厂(记为A)和新塘(记为B) 2地水样.
1.3 水环境健康风险评价
根据水源地水样检测结果,基于美国EPA推荐的水环境健康风险评价模型[7]对检出 MC致癌与非致癌健康风险进行综合评价.水健康风险模型将水环境污染与人群健康危害联系起来,通过收集、整理、解释各种健康相关资料,包括毒理学研究资料、人群流行病学资料、环境暴露因素资料,以风险度为指标定量描述环境毒物对健康的影响程度.
1.4 水源水中MC的浓集
根据水源水样监测结果,A、B两水源水中主要的有机成分为 MC(其中分别含 0.094µg/L MC-LR、0.091µg/L MC-LR),按文献[8]方法收集样品,经 0.45µm玻璃纤维滤膜过滤去除悬浮颗粒,通过Oasis HLB小柱进行固相萃取,甲醇、丙酮、二氯甲烷洗柱,洗脱液经旋转蒸发、N2吹干,DMSO定容,使得浓集物中MC-LR浓度为4.5µg/mL,-20℃避光保存备用.
1.5 水源水中MC的致突变性
鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100、TA102由浙江省疾病预防控制中心惠赠,经菌株生物学特性鉴定,均符合实验要求.采用苯巴比妥和 5′6-苯黄酮联合诱导的大鼠肝匀浆作为代谢活化系统(S9),经 Lowry法蛋白定量检测符合实验要求.
按照平板掺入法[9]分别对藻毒素浓集物、藻毒素稀释水样及纯毒素的致突变性进行检测,以DMSO稀释水样浓集物,A、B 2水源水稀释MC-LR纯毒素,各试验组每皿加入不同浓度的藻毒素浓集物和稀释水样,使得浓集物和水样中MC-LR的浓度为0.01,0.10,1.00,10.00,100.00µg/L (不包括水源水中MC-LR本底值),分别记为浓集物A、B和水样A、B,并以MC-LR纯毒素作为标准浓度序列.
在45℃保温的顶层琼脂中加入0.1mL试验菌株增菌液、0.1mL受试物,需要活化时加 10% S9混合液0.4mL,经37℃ 5% CO2培养48h,观察计数产生回复突变的菌落数.每个样品做3个平行皿,同时设阴性对照、阳性对照和自发回变组,重复试验2次.以受试物的回变菌落数为自发回变菌落数2倍以上,并具有剂量-反应关系者定为阳性.
1.6 水源水中微囊藻毒素的染色体损伤检测
健康锦鲤(Cyprinus carpiod)购于花鸟市场,体重 25~40g,体长 20cm左右,实验室水族箱(200L,水温20~25℃)内适应1周后用于实验.
参考王维等[10]提出的30h鱼背肌染毒法,用微量进样器将受试物(受试物含量与 Ames试验相同)分别按1µL/g的鱼体重注射于鱼背肌,2次染毒时间间隔24h,在第2次染毒结束后6h,进行尾静脉采血,制备血涂片,自然晾干,经甲醇固定后Giemsa染色20min.环磷酰胺(80mg/kg)作为阳性对照,每个剂量组从 5尾健康锦鲤中随机抽取2尾,每尾鱼制2张血涂片.每张片子计数2000个清晰完整、染色良好的红细胞,显微镜下计数,计算微核千分率(‰).
微核判断标准:微核位于红细胞胞浆中,与主核完全分开,边缘清晰光滑,染色与主核一致或略浅,大小为主核的1/20~1/3.
1.7 水源水中微囊藻毒素的DNA损伤检测
常规方法从健康成年志愿者全血中分离淋巴细胞,PBS缓冲液制备5×106/mL的细胞悬液,台盼蓝测定细胞存活率.在装有RPMI 1640培养基的离心管内分装细胞悬液100µL/管,分别加入10µL 各浓度受试物(受试物含量与 Ames试验相同),阳性对照组加10µL 5mmol/L重铬酸钾溶液使得最终浓度为 0.1mmol/L,另作阴性对照组和水源水组,37℃ 5% CO2染毒6h.彗星试验采用2层凝胶法[11],染毒完毕用PBS液洗细胞2次,以防止毒物继续影响,台盼蓝测定细胞存活率,进行彗星试验检测,经铺片、碱性解旋、电泳、中和与固定后,40µL EB (20µg/mL)染色,荧光显微镜下观察摄片,每张片子随机拍摄100个细胞,以细胞尾部DNA百分比(%)、彗星尾长(µm)、尾矩和Olive尾距综合反映细胞DNA损伤情况.
1.8 统计学分析
利用SPSS 16.0统计软件进行数据处理和分析,主要统计分析方法为Levene检验、方差分析、LSD-t检验、卡方检验.
2 结果
2.1 基于EPA模型的水源水健康风险度结果
101个县级以上集中式饮用水源地水样共检出MC-LR(13处)、MC-RR(15处),主要分布于湖州、台州和金华地区,最高检出浓度下对应的个人年均致癌与非致癌风险如表1所示.MC-LR的个人非致癌年风险为4.80×10-9,未超过国际辐射防护委员会(ICRP)推荐的最大可接受风险 5.0× 10-5[12],MC-RR无相应参考剂量,其健康风险未予计算.

表1 基于EPA模型的有机污染物健康风险度Table 1 Health risk caused by organic pollutants in drinking water source based on EPA model
2.2 水源水中MC的致突变性作用
藻毒素水源水浓集物A、B,藻毒素稀释水样A、B及MC-LR纯毒素各组致突变结果如表2、表 3所示,无论是否加入代谢活化系统(S9), TA97、TA98、TA100和TA102各菌株回变菌落数均高于空白对照组,且存在一定的剂量反应关系,但结果均未达到自发回变菌落数的2倍,依据Ames试验判定标准,藻毒素浓集物、稀释水样及纯毒素均未显示出明显致突变性.
非代谢活化条件下,浓集物A和水样A多个剂量组TA97、TA98、TA100菌株,浓集物B和水样B多个剂量组TA97、TA98、TA100和TA102菌株回变数高于同剂量纯毒素,差异具有统计学意义(P<0.01;P<0.05).
代谢活化条件下,各菌株回变数较非代谢活化条件下有所上升,浓集物A多个剂量组TA98、TA100菌株回变数明显高于同剂量纯毒素,水样A多个剂量组对TA100菌株回变数明显高于同剂量纯毒素,水样 B和 B浓集物多个剂量组TA98、TA100和TA102菌株回变数明显高于同剂量纯毒素,差异具有统计学意义 (P<0.01; P<0.05).

表2 水源水中微囊藻毒素非代谢活化条件下的所致回变菌落数(个/皿)Table 2 The number of revertant colonies induced by microcystin without metabolic activation (CFU/dish)

表3 水源水中微囊藻毒素代谢活化条件下的所致回变菌落数(个/皿)Table 3 The number of revertant colonies induced by microcystin with metabolic activation (CFU/dish)
2.3 水源水中的MC与染色体损伤效应
水源水中微囊藻毒素对锦鲤外周血红细胞微核率的影响如表4所示,水源水藻毒素浓集物、藻毒素稀释水样及 MC-LR纯毒素均可在一定程度上诱导红细胞产生微核.藻毒素浓集物、稀释水样及纯毒素各组锦鲤外周血红细胞微核率均高于阴性对照,纯毒素最高剂量组(100.00µg/L)微核率达到 2.37‰±0.62‰,与对照组(0.75‰±0.64‰)相比,差异具有统计学意义(P<0.01),表明该剂量下可诱发染色体损伤.浓集物A和水样A多组细胞微核发生率高于对照组,最高剂量下(100.00µg/L)微核率分别达到 2.50‰±1.29‰和3.37‰±1.11‰,与溶剂对照相比,差异具有统计学意义(P<0.01).浓集物B和水样B各组微核率高于水源对照,浓集物 B最高剂量组微核率达到3.18‰±0.41‰,与溶剂对照相比,差异具有统计学意义(P<0.01).
2.4 水源水中MC引起的DNA损伤效应
水源水中MC对人外周血淋巴细胞DNA损伤结果如图1、表5所示.染毒前后,对照组和染毒组细胞存活率均不低于 95%,且差异无统计学意义(P>0.05).图 1A中阴性对照组细胞呈圆形,无彗尾现象,提示DNA链未发生明显断裂;从图1B~图1F可以看出各染毒组均出现明显彗星样拖尾,表明DNA链受损发生断裂,且随着染毒剂量的增加损伤逐渐加重,100.00µg/L组细胞DNA损伤最为严重,图像表现为荧光信号变小,尾部长且尾部面积大(图1F).
纯毒素各组尾部DNA百分比、尾长、尾矩和 Olive尾矩均高于阴性对照组,最高剂量组DNA百分比为 30.13%±23.94%,尾长为(29.52± 23.70)µm,尾矩和 Olive尾矩分别达到 13.50± 18.07和8.23±10.06,与对照组间差异具有统计学意义(P<0.01),表明MC-LR可引起人外周血淋巴细胞DNA链断裂,且DNA损伤各指标随着染毒剂量的增加呈上升趋势.
水源水藻毒素浓集物 A和浓集物 B各组DNA损伤指标均高于阴性对照组,差异具有统计学意义(P<0.01),存在一定的剂量反应关系,最高剂量组(100.00µg/L)尾部DNA百分比、尾长、尾矩和 Olive尾矩等各项指标接近阳性对照水平,表明各剂量组浓集物A均可引起细胞DNA损伤,高剂量染毒条件下损伤最为严重.

表4 水源水中微囊藻毒素对锦鲤红细胞微核率的影响Table 4 Micronuclei induction in carp erythrocytes exposed to microcystin in drinking source water

图1 MC-LR致人外周血淋巴细胞DNA损伤彗星图像 (EB染色,×400)Fig.1 Comet picture of human lymphocytes exposed to MC-LR (×400)
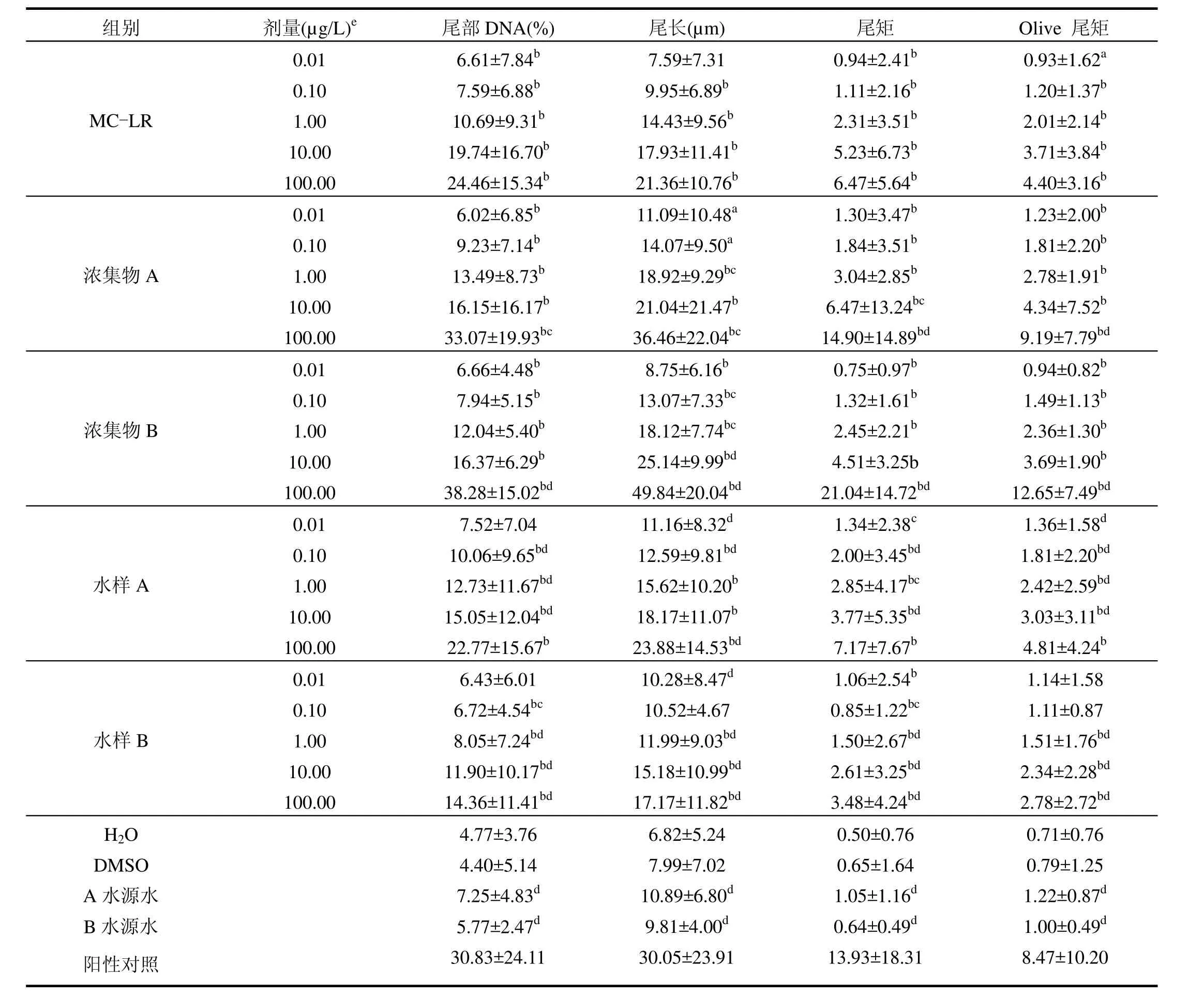
表5 水源水中微囊藻毒素对人外周血淋巴细胞DNA损伤的影响Table 5 DNA damage in human peripheral blood lymphocytes exposed microcystin
稀释水样A中除0.01µg/L组外,各组DNA损伤指标均高于水源对照,差异具有统计学意义(P<0.01),存在一定的剂量反应关系.其中100.00µg/L组DNA百分比为(22.77±15.67)%,彗星尾长达到(23.88±14.53)µm,尾矩和 Olive尾矩分别为7.17±7.67和4.81±4.24,表明水样A中的微囊藻毒素对人外周血淋巴细胞DNA链产生了损伤,且随着染毒剂量的增加,DNA损伤程度呈现加重的趋势.稀释水样 B 中 1.00,10.00, 100.00µg/L组DNA损伤指标均明显高于对照组,差异具有统计学意义(P<0.01),且具有一定的剂量反应关系.这表明水样B中微囊藻毒素引起了淋巴细胞DNA链断裂,具有DNA损伤能力.
3 讨论
对浙江省 101个县级以上饮用水源地水样中的2种MC进行监测,MC-LR引起的非致癌风险达到4.80×10-8a-1,MC-RR无相关毒理学参数,健康风险未予计算,因此水源水中MC的实际风险高于计算值.太湖 MC-LR的浓度较低(0.01~ 0.43µg/L),未超过国家饮用水规范中 MC-LR低于1.0µg/L的限定标准,但蓝藻暴发时期水中MC浓度迅速上升,可高达54.89µg/L[13].
本研究运用树脂对水源水中的 MC进行浓集,同时以水源水为溶剂稀释MC-LR纯品,对天然水体中的不同浓度藻毒素可能存在的遗传毒性进行了检测,分析了可能存在的健康风险.结果显示了水源水藻毒素浓集物、稀释水样和纯毒素各组无论是否加入代谢活化系统,对鼠伤寒沙门氏菌TA97、TA98、TA100和TA102各菌株均未呈现致突变能力,这与 Ding等[14]的研究结果一致.藻毒素浓集物、稀释水样与纯毒素相比,多个剂量组回变菌落数高于纯毒素组,猜测水源水浓集过程同时可能带入一些有机物质,而水源水中除含有藻毒素以外,还可能含有一些其他生物活性成分,本身具有一定的致突变性,或者与藻毒素相互作用增强了致突变性,从而可能导致藻毒素浓集物、稀释水样与纯毒素在菌株回变数上的差异.有研究显示,各个季节的太湖水样Ames试验阳性,可诱导基因突变[15],而宋瑞霞等[16]从太湖蓝藻水华中提取微囊藻毒素显示可导致TA98菌株发生移码突变,考虑可能是由于不同水体中藻群生物性状的差异,MC构型的不同所致.
微核是细胞有丝分裂后期滞留于胞质中的染色体片段或染色单体,主要由于染色体断裂、非整倍体化形成,是染色体损伤的标志之一,目前广泛用于放射损伤和诱变剂检测.有研究显示,MC-LR可以诱发TK6细胞、小鼠骨髓细胞微核率上升[16-17],但是MC对淡水鱼类的遗传毒性的生态毒理学研究仍较少.本研究结果显示高剂量组浓集物、水样A和高剂量组的纯毒素诱发淡水鱼类红细胞微核率增高,可致染色体损伤,对水生生物具有遗传毒性效应.
目前对于MC是否具有DNA水平上的遗传毒性还存在着较大的争议.研究发现,1mg/L MC-LR可以诱导 20%的人外周血淋巴细胞DNA发生明显损伤[18].而本研究中MC-LR纯毒素、浓集物与水样在彗星试验中各项DNA损伤指标均有不同程度上升,显示了较强的损伤作用,其损伤程度随着染毒剂量增加而逐步加重,存在良好的剂量反应关系.目前MC-LR引起DNA损伤机制尚不十分明了,有学者认为 MC-LR导致DNA损伤并不是某个机制的单一作用的结果,氧化应激在藻毒素所致的DNA损伤中发挥重要作用,较短时间暴露就能检测到 DNA链的断裂[19-21].有研究者证明MC-LR可干扰DNA的碱基切除修复[22],这可能是藻毒素的致癌作用的机制之一,而其表现出的 DNA损伤作用是由早期凋亡引起的.研究发现caspase-3、p53、bcl-2和Bax在MC-LR诱导的细胞凋亡中可能具有重要作用[23-24].也有专家认为藻毒素可能并不能直接造成 DNA损伤,而是通过抑制其修复酶的活性所导致的损伤[21].
本研究发现,水源水浓集物及水源水中MC-LR的遗传毒性与纯毒素相比存在一定的差别,Ames试验中水源水浓集物和2地水样多个剂量组引起回变菌落数高于纯的藻毒素组,彗星试验中水源水浓集物、水源水样中MC-LR与纯毒素的 DNA损伤作用大小也具有一定的差异,考虑水源水中除藻毒素以外可能还存在其他的有机毒物,虽然浓度较低,也可能产生一定的遗传毒性效应,仍需进一步深入研究.
4 结论
4.1 浙江省 101个县级以上饮用水源水中MC-LR引起的非致癌风险达到4.80×10-9a-1,未超过ICRP推荐的最大可接受水平(5.0×10-5a-1).
4.2 在本研究条件下,水源水MC浓集物及MC稀释水样可诱导鲤鱼红细胞微核率上升,引发人外周血淋巴细胞 DNA损伤,具有一定的遗传毒性,尚未观察到具有致Ames试验阳性的能力,对人体健康存在潜在威胁.
[1] Van Apeldoorn M E, Van Egmond H P, Speijers G J A, et al. Toxins of cyanobacteria [J]. Molecular Nutrition and Food Research, 2007,51(1):7-60.
[2] Palus J, Dziubaltowska E, Stanczyk M, et al. Biomonitoring of cyanobacterial blooms in Polish water reservoir and the cytotoxicity and genotoxicity of selected cyanobacterial extracts [J]. International Journal of Occupational Medicine and Environmental Health, 2007,20(1):48-65.
[3] Mackintosh C, Beattie K A, Klumpp S, et al. Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatase 1 and 2A from both mammals and higher plants [J]. FEBS Letters, 1990,264(2):187-192.
[4] Falconer I R. Tumor promotion and liver injury caused by oral consumption of cyanobacteria [J]. Environmental Toxicology and Water Quality, 1991,6(2):177-184.
[5] 张可佳,殷娣娣,高乃云,等.水中两种微囊藻毒素的臭氧氧化及其影响因素 [J]. 中国环境科学, 2008,28(10):877-882.
[6] 许 川,舒为群,罗财红,等.三峡库区水环境多环芳烃和邻苯二甲酸酯类有机污染物健康风险评价 [J]. 环境科学研究, 2007,20(5):57-60.
[7] 乔 敏,王春霞,黄圣彪,等.太湖梅梁湾水体和沉积物中有机污染物的遗传毒性 [J]. 中国环境科学, 2006,26(2):224-227.
[8] US EPA. Superfund public health evaluation manual [R]. Washington D C: Office of Research and Development. US EPA,EPA/540/1.86/060, 1986.
[9] Maron D M, Ames B N. Revised methods for the salmonella mutagenicity test [J]. Mutation Research, 1983,113(3/4):173-215.
[10] 王 维,赵 影,黄晓沐,等.巢湖水有机污染物的遗传毒性及对饮用水水质的影响 [J]. 癌变.畸变.突变, 2004,16(6):352-354.
[11] 于立群,蒋守芳,冷曙光,等.甲醛暴露工人外周血淋巴细胞遗传物质损伤水平的研究 [J]. 中华预防医学杂志, 2005,39(6):392-395.
[12] 钱家忠,李如忠,汪家权,等.城市供水水源地水质健康风险评价[J]. 水利学报, 2004,8:90-93.
[13] 穆丽娜,陈传炜,俞顺章,等.太湖水体微囊藻毒素含量调查及其处理方法研究 [J]. 中国公共卫生, 2000,16(9):803-804.
[14] Ding W X, Shen H M, Zhu H, et al. Genotoxicity of microcystin cyanobacteria extract of a water source in China [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 1999,442(2):69-77.
[15] Wu J Y, Shen L, Gao G, et al. A season-dependent variation of genotoxicity of surface water samples from Taihu Lake, Yangzte delta [J]. Environmental Monitoring and Assessment, 2004,98 (1-3):225-234.
[16] 宋瑞霞,刘征涛,沈萍萍.太湖中微囊藻毒素的遗传毒性研究 [J].环境科学研究, 2003,16(2):51-53.
[17] Zhan L, Sakamoto H, Sakuraba M, et al. Genotoxicity of microcystin-LR in human lymphoblastoid TK6 cells [J]. Mutation Research, 2004,557:1-6.
[18] Lankoff A, Krzowski L, Glab J, et al. DNA damage and repair in human peripheral blood lymphocytes following treatment with microcystin-LR [J]. Mutation Research, 2004,559:131-142.
[19] Žegura B, Lah T T, Filipic M. The role of reactive oxygen species in microcystin-LR-induced DNA damage [J]. Toxicology, 2004, 200:59-68.
[20] Nong Q, Komatsu M, Izumo K, et al. Involvement of reactive oxygen species in microcystin-LR-induced cytogenotoxicity [J]. Free Radical Research, 2007,41(12):1326-1337.
[21] Žegura B, Sedmak B, Filipic M. Microcystin-LR induces oxidative DNA damage in human hepatoma cell line HepG2 [J]. Toxicon, 2003, 41(1):41-48.
[22] Lankoff A, Bialczyk J, Dziga D, et al. Inhibition of nucleotide excision repair (NER) by microcystin-LR in CHO-K 1 cells [J]. Toxicon, 2006,48:957-965.
[23] 傅文宇,陈加平,徐立红,等. Caspase-3在微囊藻毒素诱导的细胞凋亡中的作用 [J]. 中国环境科学, 2004,24(1):6-8.
[24] 陈加平,傅文宇,王秀敏,等.微囊藻毒素LR对BRL-3A凋亡相关蛋白表达的影响 [J]. 中国环境科学, 2004,24(4):460-463.
