酶解液相色谱法检测硫酸软骨素含量及物种来源鉴定
2010-01-12王伟王虎易琼梅祥
王伟 王虎 易琼 梅祥
(1.烟台出入境检验检疫局 山东烟台 264006;2.烟台东诚生化股份有限公司)
1 前言
硫酸软骨素 (Chondroitin Sulfate,CS)是广泛存在于高等动物结缔组织中的酸性黏多糖,是我国出口的大宗产品。CS是一种多糖类药物,临床主要用于防治关节炎[1,2]、高血脂[3]、肿瘤、心绞痛、偏头痛[4]、抗动脉粥样硬化[5]、耳聋和耳鸣等疾病。CS由 D-葡萄糖醛酸和 N-乙酰 -D-氨基己糖以 1,3糖苷键连接形成重复二糖,二糖单位之间以β -1,4糖苷键连接形成糖链,氨基己糖糖环的 4位 C或 6位 C可硫酸化,硫酸化后分别形成硫酸软骨素A(CS-A)和硫酸软骨素 C(CS-C),不同动物软骨中 CS硫酸化差异较大。由于分子的不均一性特征,CS的来源、制备方法、纯度和相对分子量等因素均可影响其质量。虽然目前人们已经开发出了 CS的检测分析方法[6],但是现有的方法大部分都存在着弊端,适用性有待提高。
CS的来源有陆地动物和海洋动物两大类。陆地动物主要是牛、猪、和禽;海洋动物包括软骨鱼的软骨、海参和贝类等。陆地动物的 CS中,CS-A是主要组成组分,而海洋动物则以 CS-C为主。USP-NF 2003年第一增补版颁布的 CS标准中对其来源作了认定:健康的、适合人类食用的牛、猪和禽的软骨,而对海洋动物来源未予认定。
本课题系统地研究了 CS含量及物种来源的分析方法,开发了一种新的分析方法:酶解—液相色谱法检测 CS含量及物种来源。新方法利用 CS酶ABC在一定的条件下将 CS酶解成 CS-A,CS-B,CS-C,然后通过离子交换色谱分析 3组分的含量,CS含量为 3组分含量相加;比较 CS-A与 CS-C含量,可鉴定 CS来源。实验证明,本方法的精密度、准确度均较好,能够满足出口快速检测要求。
2 材料与方法
2.1 材料
2.1.1 试验材料
CS产品:烟台东诚生化股份有限公司生产,来源主要分为海洋和陆地。
2.1.2 试剂
CS酶 ABC:0.83 I U/mg,Sigma公司产品;
牛软骨 CS标准品:含量 99.9%以上,美国 USP标准品;
氯化钠:分析纯;
三水乙酸钠:分析纯;
三羟甲基氨基甲烷 (Tris):分析纯;
盐酸:配制成 1mol/mL;
Tris缓冲液:称取 Tris 6.0550g与三水乙酸钠8.1650g,加水溶解成 900mL,加入盐酸试液,将 pH调为 8.0,最后加水定容到 1000mL。CS酶 ABC液:用 Tris缓冲液稀释成 0.001 units/μL后使用。
标准品溶液:称取一定数量的 CS标准品置于水分测定仪托盘内,在 105℃干燥 4h至恒重,然后称取 100mg,加水溶解成 10mL,用 0.45μm的微孔滤膜过滤,准确量取滤液 100μL至 5mL离心管中,加入 Tris缓冲液和 CS酶 ABC液反应,然后在100℃准确加热 5min,停止酶解,冷却后进行离心分离 (10000rpm离心 20min),上清液用 0.45μm的微孔滤膜过滤,滤液即为标准品溶液。
供试品溶液:称取 100mg CS样品,处理步骤同前述标准品溶液,即得到供试品溶液。
实验用水:去离子水。
2.2 仪器
HB43水分测定仪、Delta 320 pH计:瑞士梅特勒 -托利多公司;
UV-1601紫外分光光度计:日本岛津公司,检测波长范围 190-1100nm;
Hypersil-SAX强阴离子交换柱:美国赛默飞世尔科技公司,I D 4.6 mm×250 mm;
高效液相色谱系统:爱尔兰沃特世公司,1525二元梯度泵、2487紫外可见波长检测器、手动进样器、Breeze色谱工作站。
2.3 实验方法
2.3.1 检测波长的测定
取 CS标准品溶液适量,以去离子水为参比溶液,用 1cm光程长的比色皿扫描测定 190-1100nm的紫外可见吸收曲线,得到化合物的紫外可见光谱。CS的最大吸收在 232nm,因此本实验选择232nm为 CS的检测波长。
2.3.2 酶解条件的确定
CS酶ABC能特异地降解细胞外基质成分中糖胺多糖,产物为不饱和二糖,是研究糖胺多糖结构的工具酶。CS酶是一种包内酶,从某些特定种类的微生物体内提取分离纯化而来,例如粘质沙雷氏菌。由于这类微生物体内环境以及生活的外界条件决定了 CS酶 ABC作用的条件,所以酶解时的最佳温度、pH值等这些条件都是根据酶来源的微生物生活习性所确定。查阅相关文献资料,得到以下最优酶解条件:100μL样品溶液或者标准品溶液中加入 Tris缓冲液 800μL,充分混合后,加入 CS酶 ABC液 100μL,在 37℃反应 1h,于 100℃准确加热 5min,停止酶解。
2.3.3 色谱条件的确定
为了能同时检测 CS酶解后 3组分的含量以及获得较好的分离度,在查阅相关的文献资料和大量的实验基础上,得到以下最优色谱条件:
色谱柱:Hypersil-SAX,I D 4.6×250 mm,填料粒径 5μm;
紫外可见检测器:检测波长 232nm;
流动相:A-去离子水 (用盐酸调 pH为 3.5),B-2mol/L氯化钠溶液 (用盐酸调 pH为 3.5);
进样量:20μL;
流速:1mL/min;
柱温:35℃;
流动相梯度如下表所示。
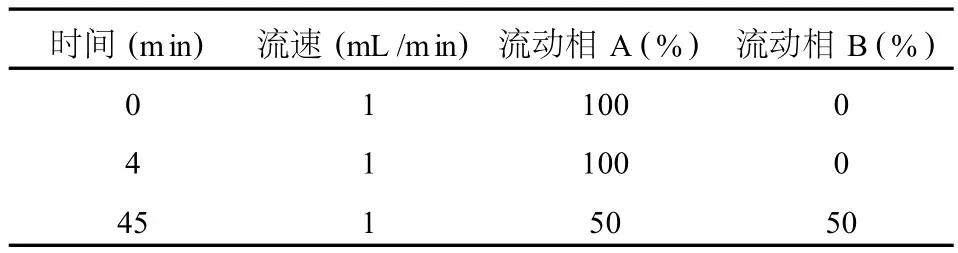
表 1 流动相梯度
2.4 结果处理
2.4.1 CS含量的计算:
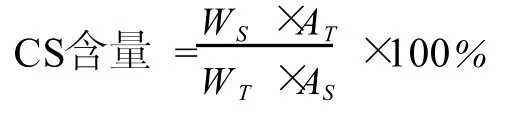
式中:WS——称取标准品的量 (mg)
WT——称取样品的量 (mg)
AT——样品溶液的峰面积之和 (μV·S)
AS——标准溶液的峰面积之和 (μV·S)
2.4.2 CS-A和 CS-C含量比值计算:
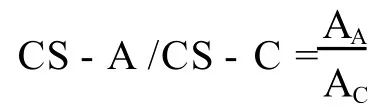
式中:AA——CS-A的峰面积 (μV·S)
AC——CS-C的峰面积 (μV·S)
3 结果与讨论
3.1 CS含量线性曲线
称取一定数量的 CS标准品,按照 2.1.2配制系列浓度梯度的 CS标准溶液,按照 2.3.3进行色谱分析,最后得到的实验数据见表 2。以峰面积对浓度,使用最小二乘法拟合直线,得到工作曲线 Y=0.823915X+0.0623(r=0.9992),其中 X为浓度(103μg/mL),Y为峰面积 (106μV·S),见图 1。
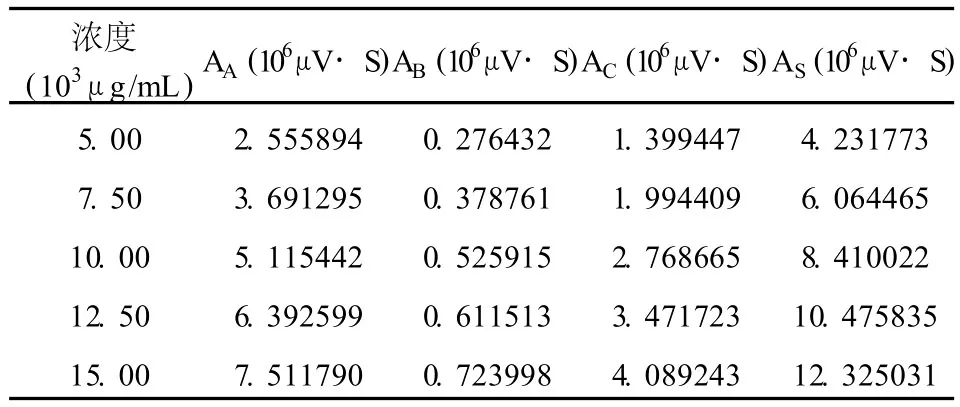
表 2 CS标准溶液色谱分析实验数据
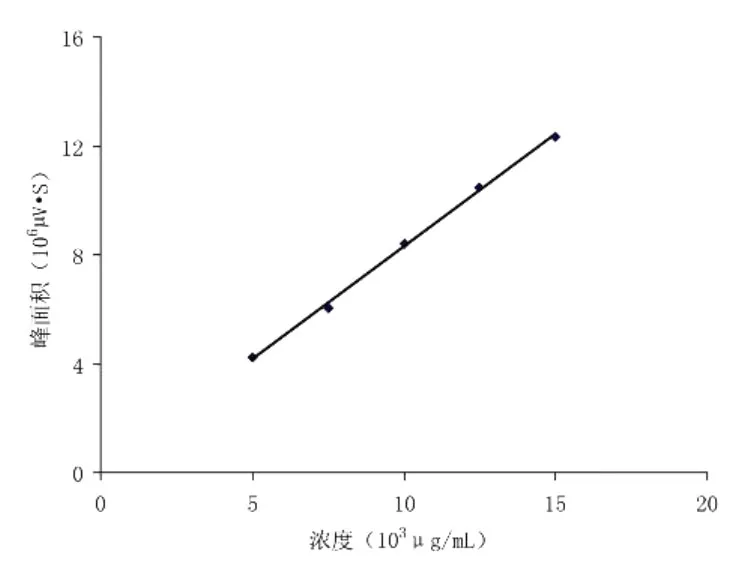
图 1 CS峰面积与浓度之间的关系图
图 1显示,在 5000~15000μg/mL浓度范围内,CS的浓度和峰面积线性关系良好,能满足检测要求。
3.2 方法的精密度
分别选取来源于鱼、牛、猪、鸡的 CS样品以及来源于牛的 CS标准品,按照上述方法分析含量,平行测定 6次,结果见表 3。
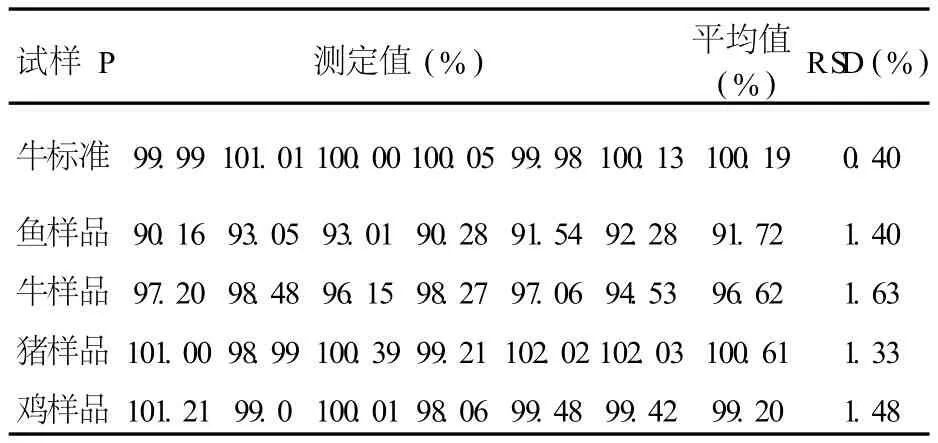
表 3 CS含量精密度测定结果
从表 3中的数据可以看出,4种不同物种来源的 CS样品和 CS标准品的 RSD在 0.40%~1.63%之间,说明本方法具有良好的精密度。
3.3 加标回收实验
为了考察方法的可靠性,我们用不同动物来源的 CS做了加标回收实验,结果见表 4。
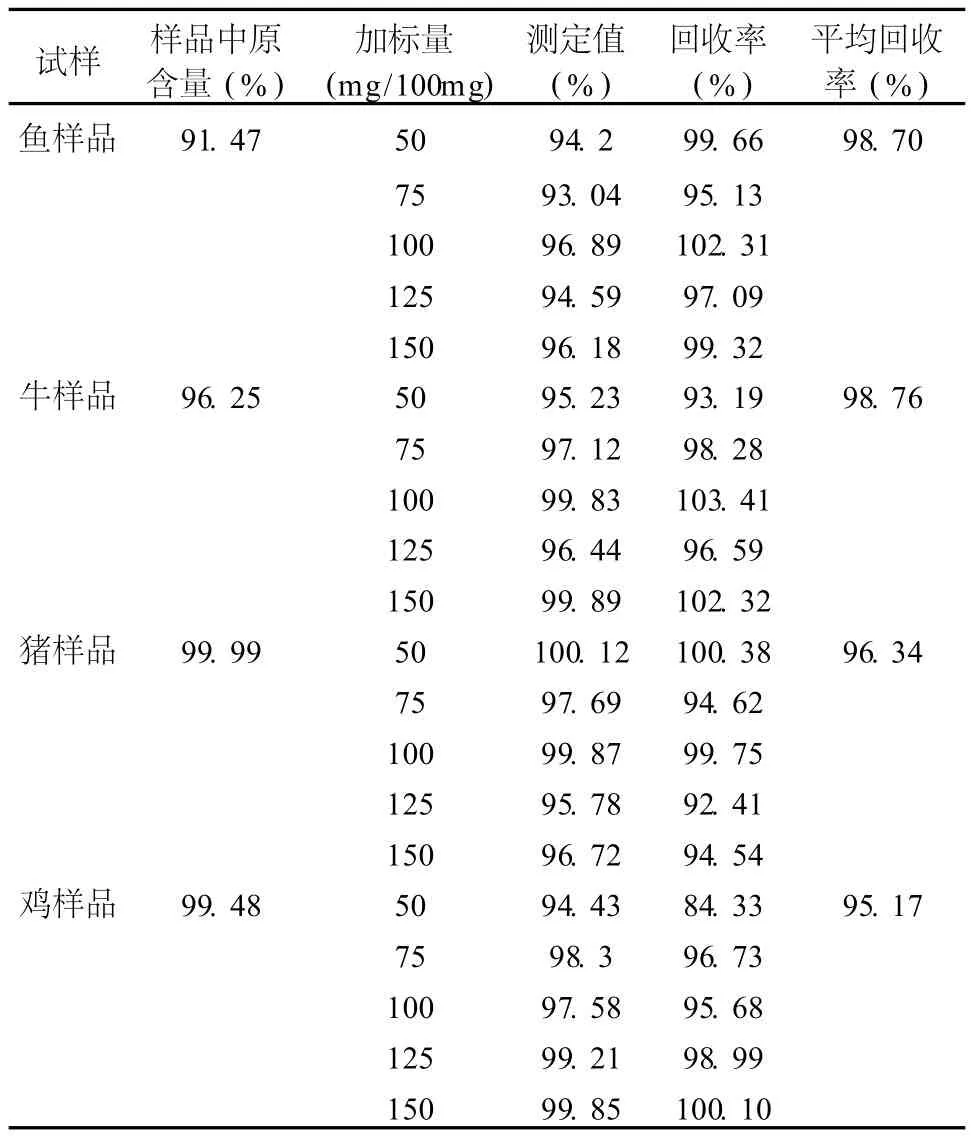
表 4 不同来源 CS的加标回收率
表 4中数据表明,4种不同动物来源 CS的回收率在 92.41%~103.41%之间,说明该方法准确、可靠。
3.4 样品含量分析
按本方法对 4种不同动物来源的 CS产品进行检测分析,结果见表 5。
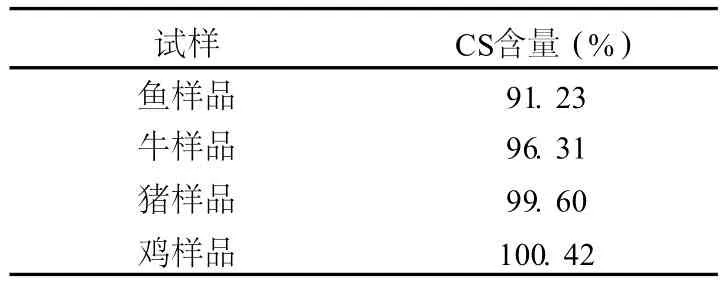
表 5 不同来源 CS样品的测定结果
3.5 不同物种来源的 CS-A/CS-C比较
在 2.3.3中的色谱条件下,CS酶解得到的 CS-A、CS-B和 CS-C能同时检出,CS-A与 CS-C能基线分离,二者的分离度能满足检测要求。
实验检测了 4种不同来源的 CS,它们分别来源于鲨鱼、牛、鸡、猪。虽然来源不同,但是对于同一组分 (CS-A或 CS-B或 CS-C),在相同的色谱条件下,保留时间基本保持一致,这说明系统适用性能满足检测要求。来源于鲨鱼软骨的 CS-A和 CS-C对应的峰面积之比为 0.52,接近于 0.5,见图 2;来源于牛软骨的 CS-A和 CS-C对应的峰面积之比为 1.92,接近于 2,见图 3;来源于鸡软骨和猪软骨的 CS-A和 CS-C对应的峰面积之比分别为 4.42和 4.75,接近于 4.5,见图 4和图 5。
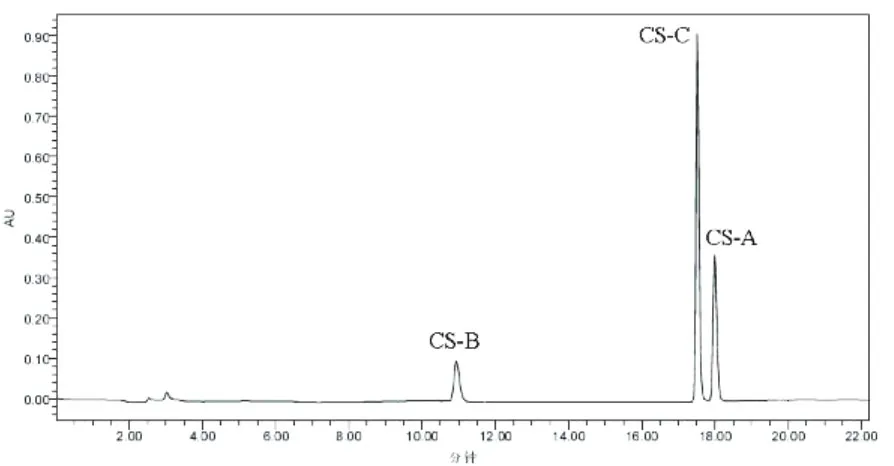
图 2 来源于鲨鱼 CS的色谱图谱
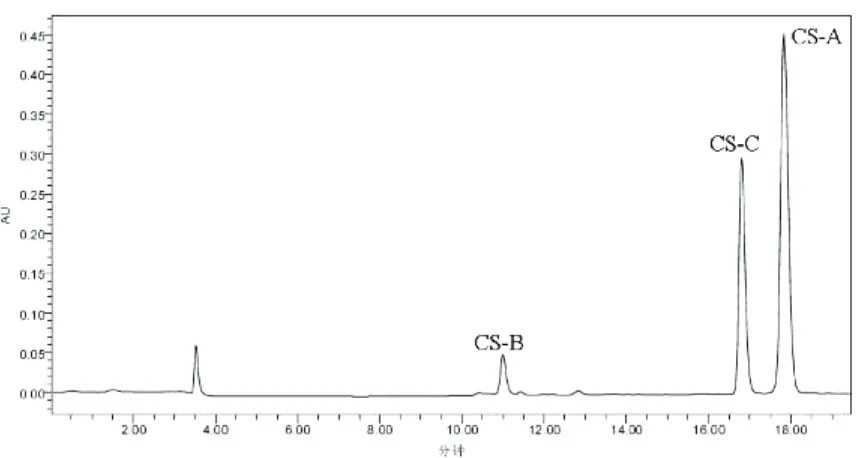
图 3 来源于牛 CS的色谱图谱
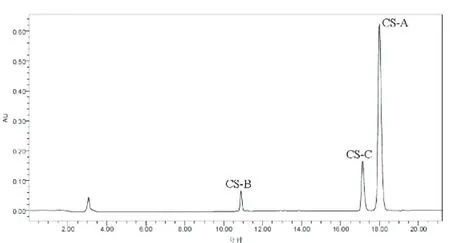
图 4 来源于鸡 CS的色谱图谱
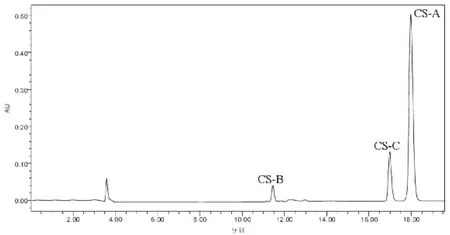
图 5 来源于猪 CS的色谱图谱
为了验证分析不同物种来源的 CS-A/CS-C可以确定 CS的物种来源,我们选取了与上述实验同一批次的样品,即来源于牛、鸡、猪的 CS进行了PCR检测,将检测的结果作为验证,见表 6。
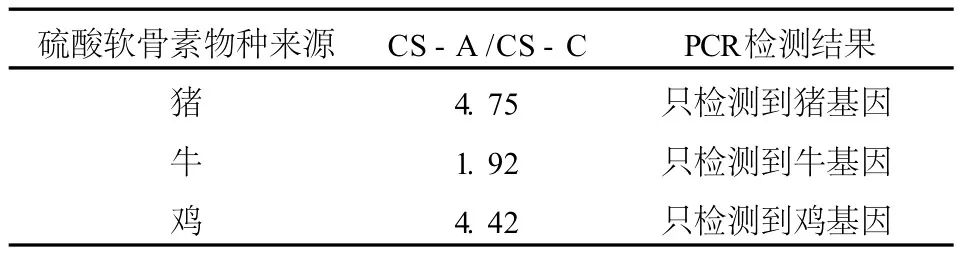
表 6 CS物种来源 PCR鉴定实验
4 结论
本课题系统地研究了 CS含量和物种来源的分析方法。利用 CS酶 ABC在最适的 pH值、温度、酶解时间、酶浓度和样品浓度等酶解条件下,将 CS酶解成 CS-A、CS-B、CS-C,利用 HPLC在最佳的流动相种类及梯度、色谱柱类型、柱温、进样量等色谱条件下,分析 3组分各自的含量,通过求和 3组分含量计算 CS含量以及比较 CS-A与 CS-C的峰面积比值,确定 CS来源。线性实验结果表明 CS在5000~15000μg/mL浓度范围内线性关系良好;精密度实验数据显示分析方法具有良好的精密度,RSD在 0.40%-1.63%之间。不同动物来源的 CS加标回收回收率在 84.33%~103.41%之间,说明该方法准确、可靠。
鉴定 CS的物种来源一般需要使用生物技术,操作繁琐,资金投入大,而且检测周期长,不利于实际应用。而该方法用于检测 CS的含量及鉴定 CS的物种来源,具有准确、快速、方便等优点,克服了传统检测方法的弊端,应用前景良好,已建议中国药典收载,作为药品标准采用。
[1] SUGIURA N,IWASAKI S,AOKI S,et a1.Suppression of pannus-like extenuation of synovial cells by lipid-derivatize chondroitin sulfate:In vitro and in vivo studies using Escherchia coli-induced arthritic rabbits[J].Int J Exp Pathol,1995,76(5):369.
[2] TAKAN ISHI G C,BORST C A.Glucosamine and chondroitin in the treatment of osteoarthritis[J].Women’S Health Primary Care,2001,4(1):61.
[3] MOURANO P A S,PEREIRA M S,PAVAO M S G,et a1.Structure and anticoagulant activity of fucosyated chondroitin sulfate from echinoderm[J].J Bio Chem,1996,271(39):23973.
[4] Japan Pharmaceutical Information Center.Drugs in Japan(Ethical Drugs)[M].9th ed.Tokyo:Yakugyo Jiho,1985:344.
[5] MAKSI MENKO A V,GOLUBYKH V L,TISCHENKO E G.Catalase and chondroitin sulfate derivatives against thrombotic effect induced by reactive oxygen species in a rat artery[J].Metab Eng,2003,5(3):177~182.
[6] 齐敬总,王凤山,闫晓玲.硫酸软骨素含量测定方法介绍[J].中国生化药物杂志,2002,23(3):162~163.
