鸡枞菌菌丝体皂甙含量测定方法的研究
2010-01-11聂晓东许泓瑜陆震鸣许正宏
聂晓东, 许泓瑜, 陆震鸣, 许正宏 *
(1.江南大学医药学院,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
鸡枞菌菌丝体皂甙含量测定方法的研究
聂晓东1,2, 许泓瑜1, 陆震鸣2, 许正宏*1
(1.江南大学医药学院,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
采用分光光度法测定鸡枞菌发酵菌丝体中皂甙含量。以人参皂甙Rg1为对照品,在吸收波长为550 nm下,标准浓度在10~240μg范围内,浓度与吸光度呈良好的线性关系,回归方程为:Y=0.003 0X-0.0405,R2=0.998 4。加样平均回收率为 99.4%,相对标准偏差(RSD)为1.97%,精密度的RSD为1.89%,鸡枞菌丝体皂甙类含量为2.69 m g/g菌丝体。方法操作简单快速,灵敏度高且比较准确。
鸡枞菌;菌丝体;皂甙;测定
鸡 枞 菌 (Termitomycesalbuminosus(Berkeley&Broome)Heim)是与白蚁共生的真菌[1],主要分布于非洲热带、亚洲热带、南太平洋岛屿和亚洲的亚热带地区[2]。鸡枞菌肉质细嫩,气味浓香,味道鲜美,营养丰富。现代医学研究证明,鸡枞菌有增强人体免疫功能、预防肠癌、养血润燥健脾胃等功效,适用于食欲不振、虚劳怔忡、痔疮下血者等[3],为古今中外颇受赞美的名贵食用菌,对其鸡枞发酵产品做详细的研究[4],为近年所关注。
皂甙是鸡枞菌中的主要活性成分,是极具潜力的天然产物资源之一,受到人们广泛的关注。目前,常用正丁醇来萃取中药材和植物中的总皂甙,然后采用香草醛-高氯酸比色法来测定其含量,该法具有灵敏性高,稳定性好的特点[5]。但是由于该法在香草醛-高氯酸显色前需要将沸点较高的溶剂正丁醇加热挥发干,需要较长时间,而且长时间在高温下烘干可能引起皂甙的结构变化,从而影响结果的准确性。本文在原有香草醛-高氯酸法的基础上改进条件,采用无水硫酸镁吸去正丁醇溶液中含有的水份,以避免水对显色反应的影响,然后对皂甙的正丁醇溶液直接用香草醛-高氯酸法测定皂甙含量。本实验为研究发酵过程中鸡枞皂甙的变化规律提供了简便快速的测定方法,为鸡枞的进一步开发和综合利用提供理论依据和科学参考。
1 材料与方法
1.1 材料与仪器
人参皂甙 Rg1:中国药品生物制品检定所产品,≥97.7%)。高氯酸、冰醋酸、香草醛等均为分析纯。DK-8K型电热恒温水槽:上海精宏实验设备有限公司产品;UV-2100紫外可见光光度计:UN ICO;数显鼓风干燥箱:上海博迅实业有限公司医疗设备厂产品。
1.2 菌株与培养方法
鸡枞菌菌种(JNPF-TA 01):保藏于江南大学医药学院制药工程实验室;
种子培养基:葡萄糖2 g/dL、酵母粉0.2 g/dL、硫酸镁0.075 g/dL、磷酸二氢钾0.15 g/dL,p H值用柠檬酸调为4.5。500 m L摇瓶装液量为100 m L培养基,在150 r/min,28℃条件下培养3 d。
发酵培养基:葡萄糖3 g/dL、酵母粉0.2 g/dL、硫酸镁0.1 g/dL、磷酸二氢钾0.2 g/dL,p H值用柠檬酸调为4.5。接种体积分数为5%,500 m L摇瓶装液量为100 m L培养基,在150 r/min,28℃条件下培养8 d。发酵结束后发酵液中菌丝体质量分数为1.1%。
1.3 实验方法
1.3.1 比色条件的选择
1)最大吸收波长的确定 准确称取干燥至恒重的人参皂甙Rg1标准品20.0 mg于100 m L的容量瓶中,甲醇溶解并稀释至刻度,即配制为质量浓度0.2 mg/m L的标准品溶液。
取人参皂甙Rg1标准品溶液0.4 mL于10 m L具塞磨口试管中,水浴加热蒸干,加0.4 mL用硫酸镁干燥后的正丁醇,加新鲜配制的体积分数为5%香草醛-冰醋酸溶液0.2 m L和高氯酸0.8 m L,摇匀,60℃水浴加热15 min,取出后立即用冰水冷却,加入5 mL冰醋酸稀释,摇匀,在400~700 nm处扫描,确定最大吸收波长。
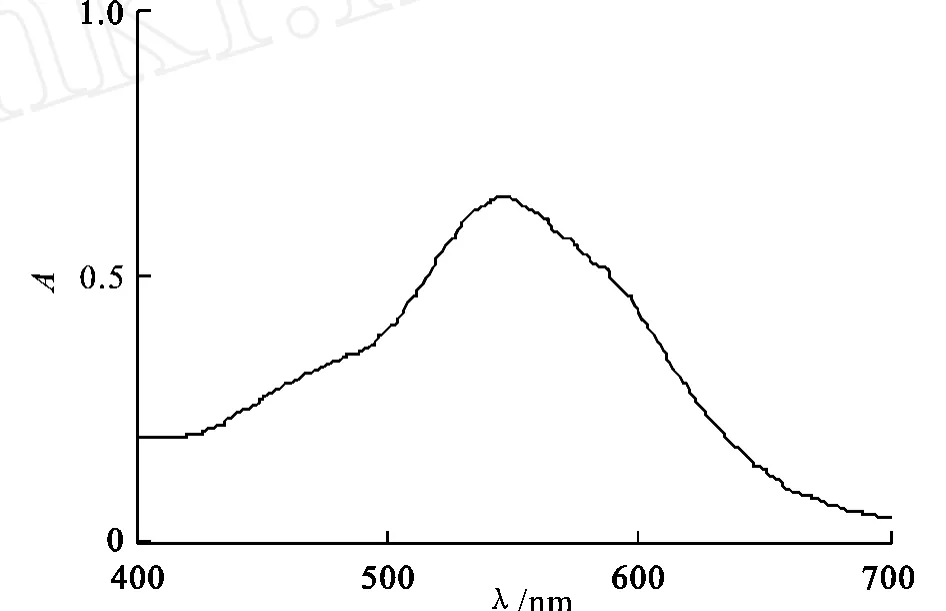
图1 显色体系的吸收光谱图Fig.1 Absorption spectrum of color system
将显色溶液在400~700 nm范围内进行扫描,如图1所示,在550 nm处有最大吸收峰,所以选用此波长为比色分析的波长。
2)香草醛用量的选择 取人参皂甙Rg1标准品溶液0.4 m L于10 mL具塞磨口试管中,水浴加热蒸干,加0.4 m L用硫酸镁干燥后的正丁醇,加不同体积新鲜配制的体积分数5%香草醛-冰醋酸溶液和高氯酸0.8 m L,摇匀,60℃水浴加热15 min,取出后立即用冰水冷却,加入5 mL冰醋酸稀释,摇匀,在550 nm波长下测定吸光度。
如图2所示,当体积分数为5%香草醛-冰醋酸溶液用量达到0.2 mL后,反应的吸光度变化很小,所以选用0.2 m L体积分数5%香草醛冰醋酸溶液用量为香草醛-冰醋酸溶液的最适用量。
3)高氯酸用量的选择 取人参皂甙Rg1标准品溶液0.4 m L于10 mL具塞磨口试管中,水浴加热蒸干,加0.4 m L用硫酸镁干燥后的正丁醇,加新鲜配制的体积分数5%香草醛-冰醋酸溶液0.2 m L和不同体积的高氯酸,摇匀,60℃水浴加热15 m in,取出后立即用冰水冷却,加入5 m L冰醋酸稀释,摇匀,在550 nm波长下测定吸光度。
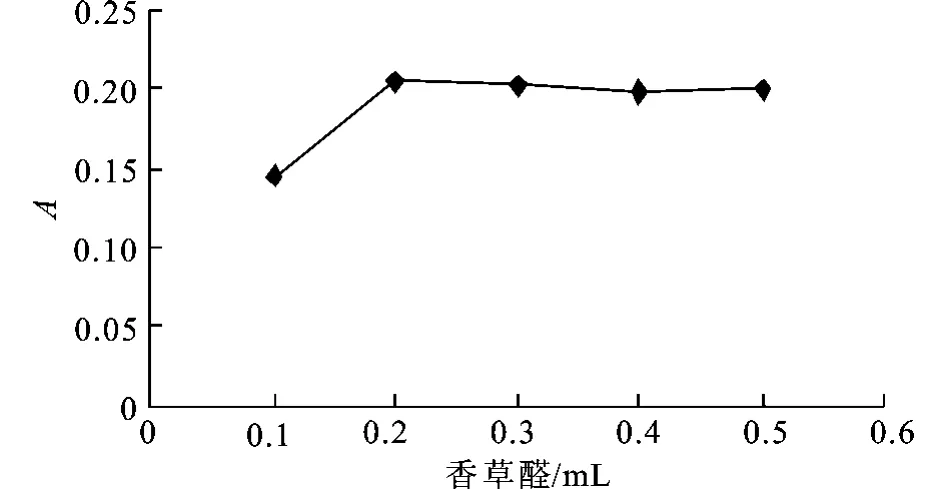
图2 体积分数5%香草醛-冰醋酸溶液用量对显色反应的影响Fig.2 Effect of 5%van illin-acetic acid dosage on the color reaction
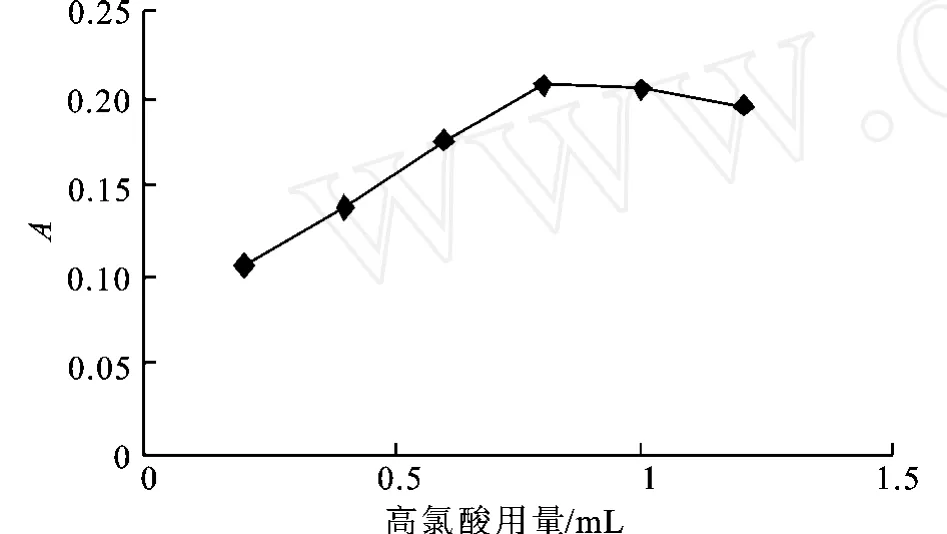
图3 高氯酸用量对显色反应的影响Fig.3 Effect of perchloric acid dosage on the color reaction
如图3所示,当高氯酸用量大于0.8 m L时,反应的吸光度变化很小,所以选用0.8 mL高氯酸用量为高氯酸的最适用量。
4)显色温度的选择 取人参皂甙Rg1标准品溶液0.4 m L于10 mL具塞磨口试管中,水浴加热蒸干,加0.4 m L用硫酸镁干燥后的正丁醇,加新鲜配制的体积分数5%香草醛-冰醋酸溶液0.2 m L和高氯酸0.8 m L,摇匀,不同温度下水浴加热15 min,取出后立即用冰水冷却,加入5 m L冰醋酸稀释,摇匀,在550 nm波长下测定吸光度。
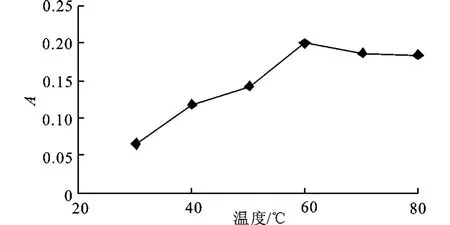
图4 显色温度对显色反应的影响Fig.4 Effect of color temperature on the color reaction
如图4所示,反应的吸光度随着温度的提高而增加,当温度超过60℃后,反应的吸光度下降很小,所以选用60℃为反应的最适温度。
5)显色时间的选择 取人参皂甙Rg1标准品溶液0.4 mL于10 m L具塞磨口试管中,水浴加热蒸干,加0.4 m L用硫酸镁干燥后的正丁醇,加新鲜配制的体积分数5%香草醛-冰醋酸溶液0.2 m L和高氯酸0.8 m L,摇匀,60℃水浴加热不同时间,取出后立即用冰水冷却,加入5 mL冰醋酸稀释,摇匀,在550 nm波长下测定吸光度。
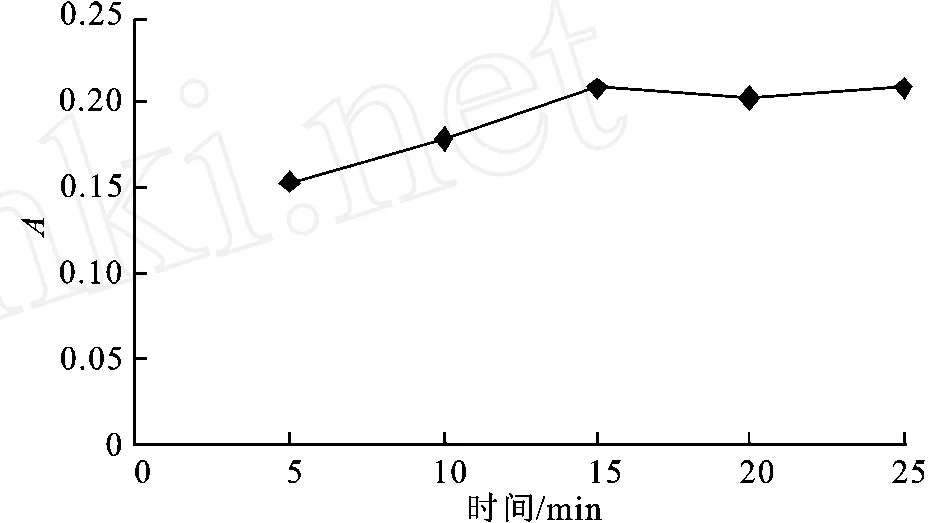
图5 显色时间对显色反应的影响Fig.5 Effect of color time on the color reaction
如图5所示,反应的吸光度随着时间的增加而增加,当时间超过15 min后,反应的吸光度增加减慢,所以选用15 min为反应的最适时间。
1.3.2 标准曲线的测定 依次精确吸取人参皂甙Rg1标准品溶液 0.00、0.05、0.10、0.20、0.40、0.60、0.80、1.00 、1.20 mL 至 10 m L 的具塞试管中,加热挥尽溶剂,加0.4 mL用硫酸镁干燥后的正丁醇,按前述方法显色,550 nm处测定吸光度,并以人参皂甙 Rg1质量(μg)为横坐标,吸光度为纵坐标,。以试剂空白为参比液,绘制成标准曲线,求出回归方程、相关系数以及线性范围。
1.3.3 测定方法的评价
1)测定方法的稳定性 取人参皂甙Rg1标准品溶液0.4 m L于10 mL具塞磨口试管中,水浴蒸干,加0.4 m L用硫酸镁干燥后的正丁醇,加入体积分数5%的香草醛-冰醋酸溶液0.2 mL,加入高氯酸0.8 mL,摇匀,60℃恒温水浴加热15 min,取出后立即冷却,加入5 mL冰醋酸稀释,同时做空白,在550 nm波长下测定吸光度在不同时间的变化。
2)测定方法的精密度 采用Lu的方法提取鸡枞菌丝体皂甙类化合物[6]。分别准确称取6份烘至恒重的鸡枞菌丝体0.6 g,加10 m L水80℃浸提2 h,过滤,滤液用5 m L石油醚萃取2次。弃去石油醚相,水相用5 m L水饱和正丁醇萃取两次,合并正丁醇相,用无水硫酸镁干燥至无水,定容至10 m L。取样品溶液0.4 mL于10 m L具塞磨口试管中,按前述方法显色并测定吸光度,同时做空白,在550 nm波长下测定吸光度。
3)加样回收率 将样品准确测定后,加入已知量人参皂甙Rg1标准品溶液进行测定,以实际测得的样品中皂苷含量的增加量除以加标量即为加标回收率。
1.3.4 鸡枞快速测定方法与原来测定方法的比较
采用Lu的方法提取鸡枞菌丝体皂甙类化合物[6]。取0.6 g烘至恒重的鸡枞菌丝体,加10 m L水80℃浸提2 h,过滤,滤液用5 m L石油醚萃取2次。弃去石油醚相,水相用5 mL水饱和正丁醇萃取两次,合并正丁醇相,用无水硫酸镁干燥至无水,定容至10 m L。取样品溶液0.4 m L于10 mL具塞磨口试管中,按前述方法显色并测定吸光度,计算皂甙的含量。另外,按照传统的香草醛-高氯酸法测定吸光度,计算皂甙的含量,比较两种方法测定的结果。
1.3.5 鸡枞菌丝体和子实体中总皂甙的提取和含量的分析 采用Lu的方法分别提取鸡枞菌丝体和子实体的皂甙类化合物[6]。分别取0.6 g烘至恒重的鸡枞菌丝体和鸡枞子实体,加10 mL水80℃浸提2 h,过滤,滤液用5 m L石油醚萃取2次。弃去石油醚相,水相用5 m L水饱和正丁醇萃取两次,合并正丁醇相,用无水硫酸镁干燥至无水,定容至10 mL。取样品溶液0.4 m L于10 m L具塞磨口试管中,按前述方法显色并测定吸光度,计算皂甙的含量。
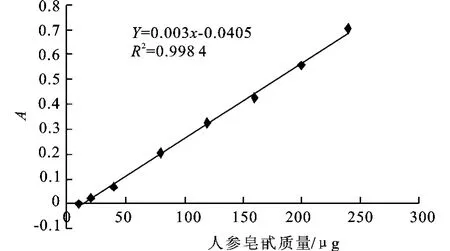
图6 人参皂甙的标准曲线Fig.6 Standard curve of the sapon in
如图6所示,以人参皂甙Rg1的微克数为横坐标,吸光度为纵坐标,得到标准曲线,其回归方程为:Y=0.003 0X-0.040 5,其中:X为质量(μg),Y为吸光度,R2=0.998 4。说明在10~240μg范围内呈良好的线性关系。
2 结果与讨论
2.1 测定方法的评价
2.1.1 测定方法的稳定性 图7为人参皂甙标样经显色反应后反应溶液的吸光值随时间变化曲线。从图中看出,显色反应后20 m in内反应溶液的吸光度变化很小,而20 min以后则溶液吸光度缓慢下降,所以吸光度测定应该在显色后20 min内进行。

图7 显色反应的稳定性Fig.7 The stability of color reaction
2.1.2 测定方法的精密度 测定方法的精密度如表1所示,6次实验所得样品的平均吸光度为0.155,RSD=1.89%,说明该测定方法具有较好的精密度。
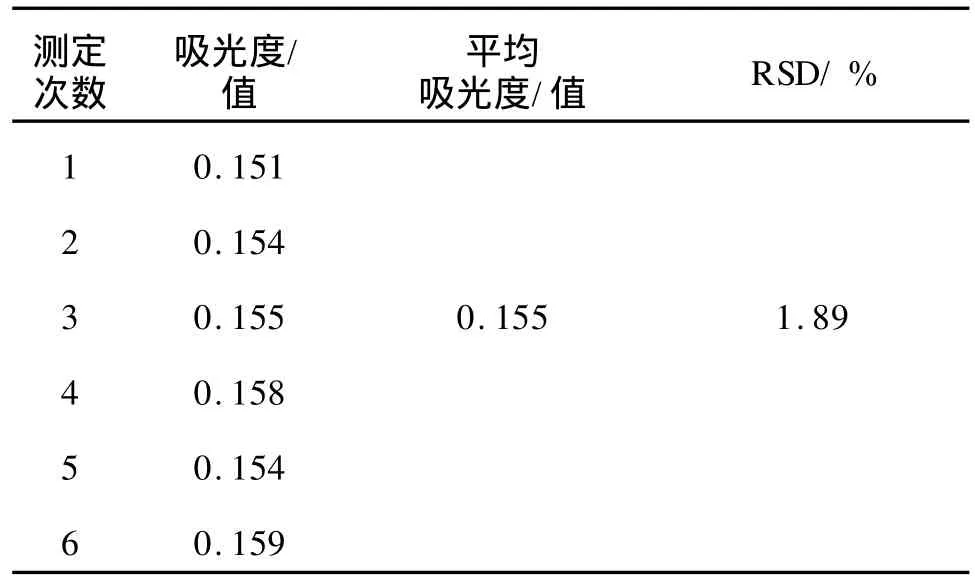
表1 测定方法的精密度Tab.1 Determ ination of precision
2.1.3 加样回收率 不同加样量的加样回收率测定结果如表2所示。6次加样回收率实验的回收率在97.6%~102.2%范围内,加样回收率的平均值为99.4%,RSD=1.97%,表明加样回收率符合要求,该测定方法的准确度较高。
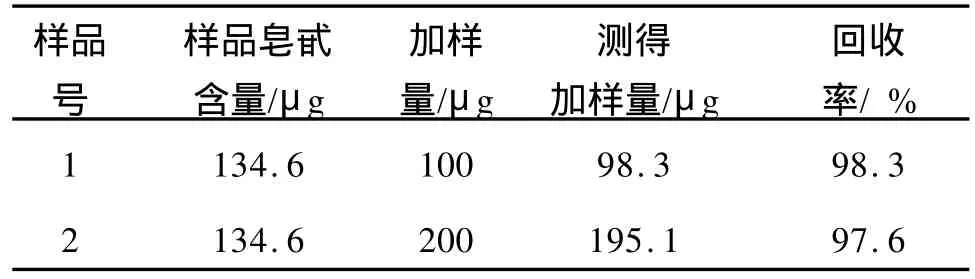
表2 测定方法的回收率Tab.2 Determination of recovery
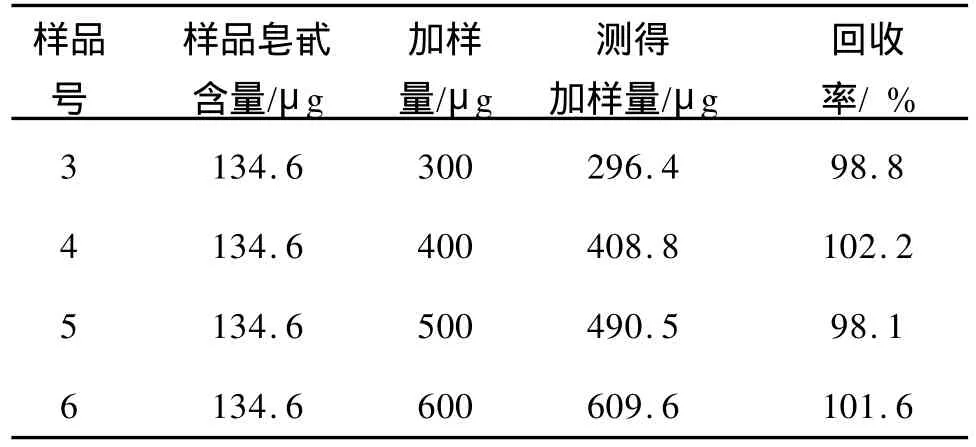
续表2
2.1.4 鸡枞皂甙测定方法比较 本实验将优化后的皂甙测定方法与传统的香草醛-高氯酸显色法进行比较,结果如表3所示。与香草醛-高氯酸显色法相比,本实验的皂甙快速测定方法测得的的皂甙含量略低,但是相差不明显。考虑到本实验优化的皂甙测定方法不需要将正丁醇加热挥发干,所用时间大大减少,因此皂甙快速测定方法可以替代传统香草醛-高氯酸显色法进行鸡枞皂甙类化合物的测定。

表3 鸡枞菌皂甙快速测定方法与香草醛-高氯酸显色法测定皂甙含量的比较Tab.3 Determination of saponin content in comparison between rapid determination and vanillin-perchloric acid method
2.1.5 鸡枞菌菌丝体和子实体中皂甙含量的分析
本实验将优化后的皂甙测定方法用于测定鸡枞菌菌丝体皂甙类化合物的含量,并与鸡枞子实体皂甙含量进行比较,比较结果如表4所示。鸡枞菌菌丝体中皂甙类化合物的含量为2.69 mg/g菌丝体,RSD=2.91%;鸡枞菌子实体中皂甙类化合物的含量为5.56 mg/g菌丝体,RSD=1.66%。由此可见,鸡枞菌菌丝体的皂甙含量要低于鸡枞子实体,这可能是由于皂甙类化合物为真菌次级代谢产物,而鸡枞菌菌丝体深层培养的时间较短(8 d),皂甙类化合物尚未大量形成所致。
3 结 语
皂甙含量测定的方法主要有重量法、比色法、薄层层析法(TLC)和高效液相色谱法(HPLC)[7-10]。重量法主要利用皂甙在某些试剂中的最大溶解性或不溶性,而采取萃取或沉淀的方法来制取样品。其缺点是操作过程较长,误差较大不够精确,同时在溶液的转移和沉淀的转移上都容易损失。薄层层析法和高效液相色谱法一般是以人参皂甙Rb1等极少数几种物质作为标准,相应地测定原料或产品中某几种皂甙含量,而无法测定总皂甙含量。目前香草醛-高氯酸比色法被认为是较方便、准确测定总皂甙含量的方法,适用于少量样品的测定。常规的香草醛-高氯酸比色法需要在皂甙溶液和显色剂进行显色反应前将待测皂甙溶液中的水分和沸点较高的正丁醇加热挥发干,其目的是为了避免用于萃取总皂甙的水饱和正丁醇溶液中含有的微量水分对于显色反应所产生的较大影响。但是该法在样品溶剂挥发时需要较长时间,而且长时间在高温下挥发可能引起皂甙的结构变化,从而影响结果的准确性。因此本实验考虑采用无水硫酸镁吸去正丁醇溶液中含有的水份,以避免水对显色反应的较大影响,进一步研究在正丁醇溶液中进行香草醛-高氯酸法反应的各种反应条件。本方法为研究鸡枞菌丝体发酵过程中总皂甙的变化规律提供了简便快速的测定方法。
本文在香草醛-高氯酸比色法的基础上改进条件,确定的最佳实验条件为:依次加入待测试样0.4 m L正丁醇溶液,新制的体积分数5%香草醛-冰醋酸溶液0.2 m L及高氯酸0.8 m L,60℃水浴15 min,取出后立即用冰水冷却,摇匀,在波长为550 nm处测定鸡枞菌丝体皂甙,加样平均回收率为99.4%,其RSD为 1.97%,精密度的RSD为1.89%,鸡枞菌丝体皂甙类含量为2.69 mg/g菌丝体。结果表明,结果稳定,重现性好,且操作简便快捷。
(References):
[1]Abe T,Matsumoto T.Studieson the distribution and ecological role of termites in a low land rain forest of west Malaysia,3.Distribution and abundance of termites in Pasoh Fo rest Reserve[J].Japanese Journal of Ecology,1979,29,337-351.[2]Jouquet P,Bottinelli N,Lata JC,et al.Role of the fungus-growing termitePseudacanthotermes spiniger(Isoptera,Macrotermitinae)in the dynamic of clay and soil organic matter content.An experimental analysis[J].Geoderma,2007,139:127-133.
[3]胡清秀,邓华平.鸡枞菌研究现状[J].食用菌学报,2001,8(1):54-58.
HU Qing-xiu,DENG Hua-pin.The present research situation of termitomyces sp.[J].Acta Edulis Fungi,2001,8(1):54-58.(in Chinese)
[4]赵呈裕,杨抚华,王化远,等.鸡枞菌的液体发酵研究和化学成分分析[J].华西医科大学学报,1997,28(4):40-411.
ZHAO Cen-yu,YANG Fu-hua,WANG Hua-Yuan,et al.Studies on the liquid fermentation of termitomyces albuminosus and its chemical composition analysis[J].Journal of West China University of Medical Sciences,1997,28(4):40-411.(in Chinese)
[5]谷利伟,谷文英.比色法测定大豆中的总皂甙[J].中国粮油学报,2000,15(6):38-42.
GU Li-wei,GU Weng-yin.Spectrophotometric determination of soyasaponins[J].Journal of the Chinese Cereals and oils association,2000,15(6):38-42.(in Chinese)
[6]Lu Y Y,Ao Z H,Lu ZM,et al.Analgesic and anti-inflammatory effects of the dry matter of culture broth ofTermitomyces album inosusand its extracts[J].Journal of Ethnopharmacology,2008,5:1-5.
[7]Ha YW,Na Y C,Seo J J,et al.Qualitative and quantitative determination of ten major saponins inPlatycodi Radixby high performance liquid chromatography with evaporative light scattering detection and mass spectrometry[J].Journal of Chromatography A,2006,1135:27-35.
[8]Theunis M H B L,Foubert K,Pollier J,et al.Determination of saponins inMaesalanceolataby LC-UV:Development and validation[J].Phytochemistry,2007,68:2825-2830.
[9]Oleszek W,Bialy Z.Chromatographic determination of plant saponins-An update(2002-2005)[J].Journal of Chromatography A,2006,1112:78-91.
[10]M uller A,Ganzera M,Andrea M,Markus G,Hermann S.Analysis of phenolic glycosides and saponins inPrim ula elatiorandPrimula veris(primula root)by liquid chromatography,evaporative light scattering detection and mass spectrometry[J].Journal of Chromatography A,2006,1112:218-223.
Determination of Saponins from the Mycelia of Termitomyces albuminosus in Submerged Culture
NIE Xiao-dong1,2, XU Hong-yu1, LU Zhen-ming2, XU Zheng-hong*1
(1.School of Medicine and Pharmaceutics,Jiangnan University,Wuxi 214122,China;2.The Key Lab of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
In this study,the spectropho tometric method was used for determining the content of saponins from the mycelia in submerged culture.Ginsenoside Rg1 as the standard,at 550 nm,the linear range of the saponins concentration was from 10μg to 240μg,and the regressive equation wasY=0.003 0X-0.040 5,R2=0.998 4.The recovery rate was 99.4%and the relative standard deviation(RSD)w as 1.97%.The relative standard deviation(RSD)of the accuracy was 1.89%.The content of saponins from the mycelia in submerged culture was about 2.69 mg/g.The method presented here has been proven to be convenient to operate and the result is accurate and highly sensitive.
Termitomyces albuminosus,mycelia,saponins,determination
Q 939.9
A
1673-1689(2010)02-0288-06
2008-09-17
国家863资助项目(2007AA 021506);国家973资助项目(2007CB707800);教育部新世纪优秀人才支持计划(NCET20720380)。
*
许正宏(1971-),男,江苏姜堰人,工学博士,教授,博士生导师,主要从事生物制药方面的研究。Email:zhenghxu@163.com
book=293,ebook=452
(责任编辑:杨萌)
