蚯蚓对植物修复永久性有机污染物的影响
2010-01-10潘声旺
潘声旺,李 玲,袁 馨
(1.成都大学环境科学与工程研究所,四川成都 610106;2.西南大学资源环境学院,重庆 400715)
0 引 言
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是环境中普遍存在的持久性有机污染物(persistent organic pollutants,POPs),性质稳定、水溶性差,其在环境中的含量逐年上升[1].因环境中PAHs多数具有“三致”效应,严重威胁着人类健康和农产品质量安全,修复土壤PAHs污染已成为环境领域的焦点问题之一.
蚯蚓是土壤中普遍存在的一类广谱性动物,蚯蚓活动不仅能改善土壤理化性质,活化微生物活性[2],还能促进修复植物的生长[3].因PAHs的生物降解主要在好氧条件下进行[4-5],蚯蚓活动引发的土壤—植物系统理化性质与生态功能的改变,尤其是通气状况的改善,能否对植物修复PAHs污染土壤产生促进作用呢?相关研究鲜见报道.本研究拟以环毛蚓(Pheretima sp.)、紫花苜蓿(Medicago sativa)为材料,对比研究蚯蚓活动对土壤—植物系统中PAHs去除效果的影响,以期为PAHs污染土壤的生态修复提供试验依据.
1 材料与方法
1.1 试验材料
1.1.1 土 壤.
试验用土壤为紫色土,采自旱地表层0~20 cm处,无污染史.其理化性质为:有机质22.3 g·kg-1, CEC 27.43 cmol·kg-1,pH值为7.19,速效N、P、K分别为114.6、24.7、94.8 mg·kg-1.
1.1.2 植 物.
以2周龄紫花苜蓿为试验材料.种子经双氧水处理后,无菌条件下催芽、培养14 d后备用.
1.1.3 蚯 蚓.
试验用蚯蚓为为人工培育的环毛蚓,培育方法如下:风干的牛粪经脱氨、灭菌(虫)后,重新碾碎,以60 g·kg-1(干重比)的比率与未污染的试验土壤混匀后,分装于底部有滤孔的瓷盆中(20 kg·pot-1).母蚓经双氧水浸润10 min后,均匀引入培养盆中,20± 2℃、40%田间持水量下室内培育30 d后,选择同等大小(鲜重:0.5~0.6 g;体长:7~8 cm)、无环带个体待用.
1.1.4 化学品.
菲(Phe,phenanthrene)是燃油和汽车尾气排放PAHs的标志物,在污染土壤中检出浓度较高.本研究以菲为PAHs代表物(购自德国Fluka公司,纯度>98%).
1.2 试验方法
盆栽试验在温室内进行,试验周期70 d.土壤采集后,风干、过3 mm筛.将一定量的菲经丙酮溶解后,均匀洒在土壤表层,待丙酮挥发后,多次搅拌、混匀,制备6个污染水平(T0~T5).40%田间持水量下平衡7 d后,测得土壤中菲的初始浓度分别为:0(T0)、20.05(T1)、40.88(T2)、81.05(T3)、161.44(T4)、322.06(T5)mg·kg-1.
试验分为A、B两组.
(1)A组包括4个处理、重复5次:处理1(CK1),土壤中加入0.1%NaN3(抑制微生物活性)[6],无植物;处理2(CK2),无植物,无NaN3;处理3(TR3),种植物,加0.1%NaN3;处理4(TR4),种植物,无NaN3.土壤装盆后(2 kg·pot-1),除 CK1、CK2外,每盆移栽并保留紫花苜蓿幼苗12株.试验期间,白天室温维持在25℃,350 μmol·(m2·s)-1光照强度下持续光照16 h,夜间室温控制在12℃左右;田间持水量维持在40%.
(2)B组中,除每盆添加8条蚯蚓外,试验设计和试验条件与A组相同,没有额外投加食物(试验期间,对照土样(CK2)中蚯蚓体重较初始引入时平均减轻15.03%,各污染水平(T1~T5)下体重生长率与无污染的 T0组(-13.38%)间差异不显著(n= 40,p>0.05),其他处理(CK1、TR3、TR4)中生长状况与 CK2类似,说明试验条件适合蚯蚓生长[7]).
1.3 样品测定与质量控制
70 d后采样,土壤、植物组织中菲的提取与净化方法参照文献[8].蚯蚓组织中菲的提取、净化参照Johnson[9]方法,并略有改进:洗净后活体蚯蚓在去离子水中培养12 h后,转移到活化硅胶中埋置48 h,待充分排净体内杂质后,洗净、用滤纸吸干、称重;液氮真空干燥后,充分碾碎;与3倍重量的无水硫酸钠混合,用正己烷索氏提取12 h;将提取液浓缩至1 mL后,用凝胶渗透色谱法(GPC)进一步去除少量的油脂残余;滤液经旋转蒸发器蒸干后甲醇定容2 mL,过0.22μm孔径滤膜后待测.
经上述前处理后,HPLC(Waters600)测定,DAD检测器(λ=246 nm)、流动相为甲醇加水(83∶17).在此条件下,检出限为54.2 pg·L-1,土壤中菲的加标(外标法、下同)回收率为 95.9%(n=7,RSD<5.5%)、植物组织为94.5%(n=7,RSD<4.7%)、蚯蚓组织为91.9%(n=7,RSD<5.5%).
1.4 数据处理
试验数据处理采用SPSS 13.0进行Duncan’s多重比较.土壤中菲的去除率(R)计算式为,
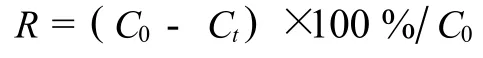
式中,C0为初始浓度,Ct为取样时残留浓度.
去除因子 i对菲去除的贡献率(Ti,即因子 i对菲的实际去除量与初始添加量的百分比)计算式为,

式中,Ri为因子i对菲的实际去除量,W为土壤质量.很明显,所有生物、非生物因子的贡献率之和理论上应等于去除率 R.
2 结果与分析
2.1 蚯蚓活动对植物生长的影响
图1展示了A、B组土壤(无NaN3)中紫花苜蓿的生长状况.结果显示,试验浓度范围内,紫花苜蓿在菲污染土壤中能够正常生长.无蚯蚓活动(A组)时,其单株生物量、根冠比与 T0水平(0.635 g、0.341 g)间差异不显著(n=60,P>0.05);有蚯蚓(B组)时,单株生物量较同一污染水平A组间增加16.63%~21.78%(平均值m=19.98%),其中,T1~T4水平的单株生物量与A组间差异显著(n=60, p<0.05).根冠比增加 20.58%~24.62%(m= 22.52%),与同一污染水平A组间差异显著(n=60, p<0.05).实验数据说明,蚯蚓活动对菲污染土壤中植物生长具有一定的促进作用.

图1 不同污染水平下紫花苜蓿的生长状况示意图
2.2 蚯蚓活动对土壤—植物系统中菲去除的影响
表1显示,添加蚯蚓后,土壤—植物系统(TR4)中菲的残留量明显低于同一污染水平A组:试验结束时,B组土壤中残留量与种植紫花苜蓿的A组(TR4)间差异显著(n=5,p<0.05),但与无紫花苜蓿生长的A组(CK2)间差异达到极显著水平(n=5,p<0.01).此实验数据表明,蚯蚓活动促进了土壤中菲的去除.
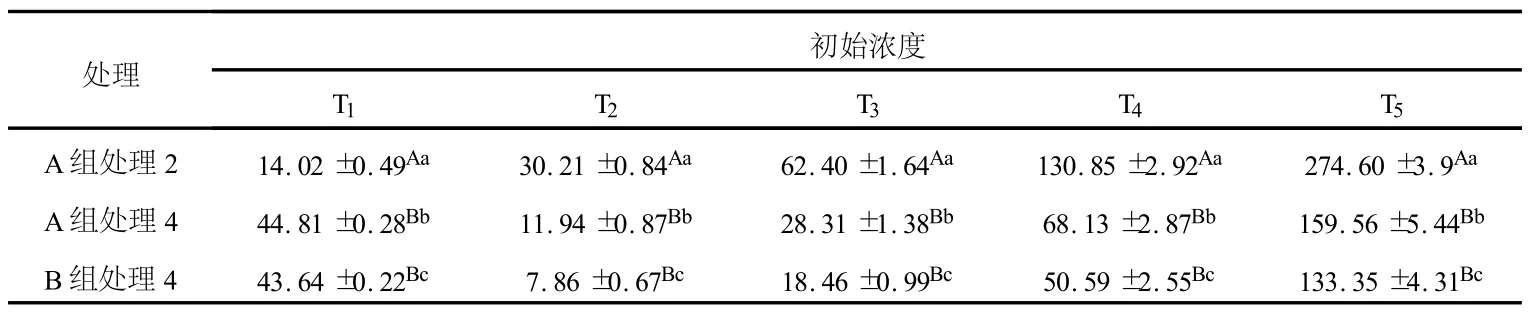
表1 不同处理条件下土壤中菲的残留量
依照去除率(R=(C0-Ct)×100%/C0),可推算土壤中菲的去除情况.计算结果显示,种植紫花苜蓿的土壤中菲去除率普遍高于同一污染水平的其他处理.T1~T5范围内,B组土壤(TR4)中平均去除率高达73.42%(58.60%~81.82%);A组(TR4)去除率为64.02%(50.45%~76.01%),而无植物对照组(CK2)中仅为22.57%(14.73%~30.08%).
此外,相同处理条件下,同一污染水平A、B组土壤中菲的去除率差异反映了蚯蚓活动对土壤菲污染修复效果的影响程度(见图2).从图2可以看出,不同污染水平下,蚯蚓活动对菲去除的强化程度也不一样.中度污染(T3)时强化程度最高(12.16%),重污染(T5)时次之(8.14%),低污染(T1)时仅为5.82%.
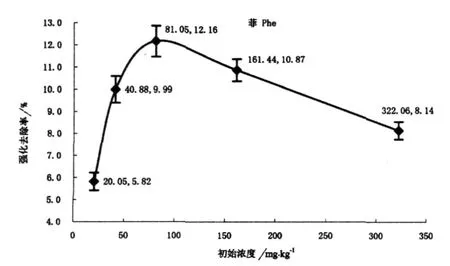
图2 不同污染水平下菲的强化去除差异
2.3 蚯蚓活动对植物富集菲的影响
基于土壤残留浓度与植物积累浓度,可推算植物对菲的根系浓缩系数与茎叶浓缩系数(RCFs or SCFs,root or shoot concentration factors)(见图3).从图3可以看出,随着初始添加浓度的递增,积累浓度逐渐增大,而RCFs、SCFs则逐渐减小;相同污染水平下,有蚯蚓作用时植物组织中的积累浓度与浓缩系数均小于无蚯蚓时.如 T1~T5范围内,无蚯蚓作用时根系、茎叶部积累浓度为35.13(8.94~85.22)、6.92(1.90~16.58)mg·kg-1,有蚯蚓作用时分别为25.45(5.96~68.33)、4.92(1.21~12.98)mg·kg-1;无蚯蚓作用时RCFs、SCFs为1.02(0.54~1.86)、0.21(0.11~0.40),有蚯蚓作用时分别为0.92(0.51~1.63)、0.18(0.09~0.33).

图3 植物组织对菲的积累作用
在图3中,RE、SE和RN、SN分别代表有蚯蚓和无蚯蚓作用时菲在根系、茎叶部的积累浓度,同一污染水平上不同字母表示浓度差异显著(p<0.05); RCFs-E、SCFs-E和RCFs-N、SCFs-N分别为对应的根系、茎叶部菲浓缩系数.
2.4 蚯蚓对菲去除的强化途径
土壤中菲的去除主要源于各种非生物因素(如吸附、光解、挥发等)和生物因素(如植物代谢、积累、微生物降解、植物—微生物交互作用等)的共同作用[8].如果用 Ta、Td、Tc、Tm、Tpm分别代表非生物损失、植物代谢、积累、微生物降解、植物—微生物交互作用在菲去除过程中的贡献率,用R1、R2、R3、R4代表未添加蚯蚓时 CK1、CK2、TR3、TR4处理中菲的表观去除率,则有:

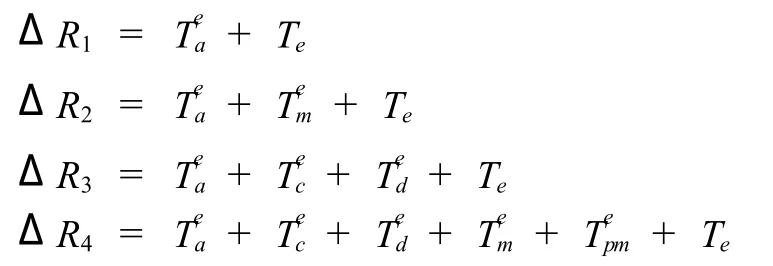
B组土壤中,因蚯蚓组织对菲的直接吸收作用以及蚯蚓活动对各种生物、非生物因子可能产生的强化去除作用,B组 CK1、CK2、TR3、TR4处理中菲的表观去除率变化可分别表述为:式中:ΔR1、ΔR2、ΔR3、ΔR4分别代表添加蚯蚓后CK1、CK2、TR3、TR4中菲去除率与相同处理条件下A组土壤中去除率的变化值;Tea、Tec、Ted、Tem、Tepm代表蚯蚓活动所引起的Ta、Tc、Td、Tm、Tpm变化量,Te代表蚯蚓组织直接吸收作用对菲去除的贡献率.
由不同处理条件下土壤、蚯蚓组织、植物组织中菲含量,得出各修复因子在菲去除过程中的贡献率如表2所示.
与A组相比,蚯蚓活动使土壤—植物系统(TR4)中菲的平均去除率提高了9.40%,其中被蚯蚓组织积累部分仅占总添加量的0.06%,这说明蚯蚓的直接吸收作用并不是菲被强化去除的主要途径.试验过程中,非生物性损失、植物代谢对菲去除的平均强化率仅为0.15%、0.39%,二者也不是菲被强化去除的主要途径.相比之下,微生物降解、植物—微生物交互作用对菲去除的贡献率变化较大,前者较A组(17.47%)提高了2.66%,后者较A组(37.97%)提高了 6.12%,分别占强化去除部分的28.39%、65.14%.

表2 生物、非生物因子在修复菲污染土壤过程中的贡献率/‰
3 讨 论
研究表明[10-11],植物—微生物交互作用是土壤—植物系统中 PAHs去除的主要途径.因根系分泌物的种类、性质、生理活性存在一定的种间差异,其根际降解效应可能也不一样[12-13];对污染物的忍耐性、污染环境中根系活动状态是筛选修复植物的重要参数.本研究中,紫花苜蓿能够在菲污染土壤中正常生长,其单株生物量、根冠比与对照组间无明显差异,说明紫花苜蓿是适合用作菲污染土壤的修复植物[6].
试验期间,土壤—植物系统(TR4)中菲的平均去除率由64.02%上升至73.42%,强化去除率高达9.40%.其中,28.39%的强化部分源于微生物降解, 65.14%的强化部分源于植物—微生物交互作用.这说明蚯蚓在植物修复土壤菲污染过程中所表现出的强化效应主要是通过植物—微生物交互作用实现的.Schaefer等[14]认为,蚯蚓活动不仅能提高土壤养分的有效性和周转率,蚓粪中 N、P成分及其他营养盐对促进土壤微生物的种群数量的增长、提高其代谢活性也具有重要作用.Singleton[15]等证实,蚯蚓肠道中假单胞菌(Pseudomonas)、乳杆菌(Acidobacterium)以及青霉菌(Penicillium)、毛霉菌(Mucor)以及曲霉菌(Aspergillus)对 PAHs具有明显的降解作用.本研究也显示:中等污染水平(81.05 mg·kg-1)下蚯蚓活动对菲去除的强化效果最好(12.16%).这可能与低污染条件下环境中污染物的生物可利用性较低[13],高污染条件下微生物受污染物的毒害作用,降解活性被抑制[7]有关.
尽管被蚯蚓组织所积累的菲相当有限(0.06%),但蚯蚓活动改善了土壤的理化性质、生态功能[16],尤其是土壤中通气状况的改善[17]对促进土壤—植物系统中菲的生物降解至关重要.Mallakin等[4]认为,对于具有较稳定π键结构的PAHs分子而言,充足的氧气供给不仅能促进PAHs的起始氧化过程,也能间接地促进土壤中好氧微生物的生长,并强化其降解活性.此外,蚯蚓活动对紫花苜蓿生长的促进,尤其是对其根系生长的促进作用,对扩大其根际效应范围,强化植物—微生物交互作用也具有十分重要的作用.
值得注意的是,与相同污染水平下土壤—植物系统相比,添加蚯蚓后菲在植物组织中积累浓度均明显低于A组(n=5,p<0.05),植物积累对菲去除的贡献率也略小于A组,这可能与蚯蚓活动促进了土壤—植物系统对菲的去除、残留浓度较低、可供根系吸收利用的菲资源相对较少有关.该现象也说明,蚯蚓活动能在一定程度上减少植物组织对污染土壤中菲的积累,降低其生态风险.
4 结 论
在20.05~322.06 mg·kg-1菲污染土壤中,蚯蚓活动促进了修复植物紫花苜蓿的生长,提高了污染土壤的修复效果:70 d后,土壤—植物系统中菲的平均去除率(73.42%)比无蚯蚓活动时(64.02%)提高9.40%,中度污染(81.05 mg·kg-1)时强化效应最显著(12.16%);但被修复植物积累的菲少于相同污染水平无蚯蚓活动时,所有修复因子中,植物—微生物交互作用对菲去除的贡献率(44.09%)较无蚯蚓时提高6.12%,占总强化部分的65.14%.试验表明,土壤动物(蚯蚓)的活动可借助植物—微生物交互作用进一步强化植物(紫花苜蓿)修复永久性有机污染物(菲)污染土壤的去除作用.
[1]Li X H,Ma L L,Liu S F,et al.Polycyclic Aromatic Hydrocarbon in Urban Soil from Beijing,China[J].Journal of Environmental Sciences,2006,18(5):944-950.
[2]Scheu S.Effects of Earthworms on Plant Growth:Patterns and Perspectives[J].Pedobiologia,2003,47:846-856.
[3]Eriksen-Hamel N S,Whalen J K.Earthworms,Soil Mineral Nitrogen and Forage Production in Grass-based Hayfields[J].Soil Biology&Biochemistry,2008,40:1004-1010.
[4]Mallakin A,Dixon D G,Greenberg B M.Pathway of Anthracene Modification under Simulated Solar Radiation[J].Chemosphere, 2000,40(12):1411-1435.
[5]Brauner J S,Widdowson M A,Novak J T,et al.Biodegradation of a PAH Mixture by Native Subsurface Microbiota[J].Bioremediation,2002,6(1):9-24.
[6]Gao Y Z,Zhu L Z.Plant Uptake,Accumulation and Translocation ofPhenanthrene and Pheene in Soils[J].Chemosphere, 2004,55(9):1169-1178.
[7]Bonnard M,Eom I C,Morel J L,et al.Genotoxic and Reproductive Effects of an Industrially Contaminated Soil on the Earthworm Eisenia Fetida[J].Environmental and Molecular Mutagenesis, 2009,50(1):60-67.
[8]Pan S W,Wei SQ,Yuan X,et al.The Removal and Remediation of Phenanthrene and Pheene in Soil by Mixed Cropping of Alfalfa and Rape[J].Agricultural Sciences in China,2008,7(11): 1355-1364.
[9]Johnson D L,Jones KC,Langdon C J,et al.Temporal Changes in Earthworm Availability and Extractability of Polycyclic Aromatic Hydrocarbons in Soil[J].Soil Biology&Biochemistry, 2002,34(9):1363-1370.
[10]Chen YC,Banks M K,Schwab A P.Pheene Degradation in the Rhizosphere of tall Fescue(Festuca arundinacea)and Switchgrass(Panicum virgatum L.)[J].Environmental Science& Technology,2003,37(24):5778-5782.
[11]Liste H H,Alexander M.Plant-promoted Pheeme Degradation in Soil[J].Chemophere,2000,40(1):7-10.
[12]Y i H,Crowley D E.Biostimulation of PAH Degradation with Plants Containing High Concentrations of Linoleic Acid[J].Environmental Science&Technology,2007,41(12):4382-4388.
[13]Siciliano SD,Germida J J,Banks K,et al.Changes in Microbial Community Composition and Function During a Polyaromatic Hydrocarbon Phytoremediation Field Trial[J].Applied and Environmental Microbiology,2003,69(1):483-489.
[14]Schaefer M,Petersen S O,Filser J.Effects of Lumbrucus Terrestris,Allolobophora Cholorotica and Eisenia Fetida on Microbial Community Dynamics in Oil-contaminated Soil[J].Soil Biology &Biochemistry,2005,37(5):2065-2076.
[15]Singleton D R,Hendrix B F,Coleman D C,et al.Identification of Uncultured Bacteria Tightly Associated with the Intestine of the Earthworm Lumbricus Rubellus(Lumbricidae,Oligochaeta) [J].Soil Biology&Biochemistry,2003,35(2):1547-1555.
[16]Contreras-Ramos SM,Alvarez-Bernal D,DendoovenL.Removal of Polycyclic Aromatic Hydrocarbons from Soil Amended with Biosolid or Vermicompost in the Presence of Earthworms(Eisenia fetida)[J].Soil Biology&Biochemistry,2008,40(7):1954 -1959.
[17]Eijsackers H,Bruggeman J,Harmsen J,et al.Colonization of PAH-contaminated Dredged Sediment by Earthworms[J].Applied Soil Ecology,2009,43(3):216-225.
