荧光光谱法研究全氟辛酸与牛血清白蛋白的相互作用
2010-01-07谢显传王晓蓉张幼宽吴颖欣薛银刚污染控制与资源化研究国家重点实验室南京大学环境学院水科学研究中心江苏南京210093
谢显传,王晓蓉,张幼宽,吴颖欣,薛银刚 (污染控制与资源化研究国家重点实验室,南京大学环境学院,水科学研究中心,江苏 南京 210093)
全氟辛酸(PFOA)是典型的全氟化合物(PFCs).由于含有高能量的C-F共价键,因而具有优良的热稳定性、高表面活性及疏水疏油性能,PFOA被大量应用于聚合物添加剂、表面活性剂、电子工业、电镀等多种行业[1-2].在1951~2004年期间,全球 PFOA 的总生产量大约在 3600~5700t,其中约有400~700t排入环境[3].PFOA可能通过食物链传递产生生物富集[4-5],对动物可能造成肝脏、神经、生殖遗传及致癌性等多种毒性[6-7].美国国家环保局(USEPA)在有关报告中把全氟辛酸认为是“可能的(1ikely)致癌物”或“提示性(suggestive)致癌物”[8].
PFOA由于疏水又疏油的特点,与一般持久性有机污染物(POPs)不同,进入生物体内不易在脂肪组织中积蓄,而是优先和生物体内的蛋白质结合后发生生物蓄积[9].血清白蛋白是哺乳动物血浆中含量最丰富的载体蛋白, 能与外源性化合物结合,起到存储和运输的作用[10].由于与人血清白蛋白的结构相似且廉价易得,牛血清白蛋白(BSA)常被选为模型蛋白质以研究小分子有机物与蛋白质的相互作用.本实验在模拟生理条件下,研究 PFOA 与 BSA 的相互作用, 对了解PFOA在生物体内迁移、代谢及致毒机理等有重要意义.
1 实验部分
1.1 仪器与试剂
仪器:F-700型荧光光谱仪(日本日立Hitachi公司),Millipore Q超纯水系统.
试剂:牛血清白蛋白(BSA)购于 Fluka公司,全氟辛酸(PFOA)购自 Sigma-Aldrich公司,其他所有试剂均为分析纯产品,购于国药集团上海化学试剂有限公司和南京化学试剂公司.
1.2 实验方法
溶液配制:以0.1mol/L磷酸缓冲液(pH7.4,含0.1mol/L NaCl)为溶剂,配制 1.0×10-5mol/L PFOA溶液,同时配制4.0×10-6mol/L BSA溶液.置于4℃冰箱中保存.
荧光光谱测定:10mL聚丙烯离心管中加入2mL4.0×10-6mol/L BSA 溶液和2mL不同浓度PFOA稀释液混匀,在不同温度条件下(277,298和310K)反应10min后,测定荧光光谱.荧光比色皿光径为1cm,荧光扫描的固定激发波长为280 nm,激发和发射通带均为5nm,扫描 300~450nm的荧光光谱.同步荧光光谱扫描测定时固定激发和发射波长间隔Δλ分别为15nm和60nm.
2 结果与讨论
2.1 PFOA对BSA荧光猝灭作用
因分子中含有色氨酸、酪氨酸和苯丙氨酸等残基,BSA能在紫外光激发下产生内源荧光.当激发光波长为280nm时,BSA荧光发射峰位置在340nm附近.由于无荧光活性基团,PFOA不会产生与BSA相互干扰的荧光.由图1可见,当反应体系中BSA浓度固定时,随着PFOA浓度的增加,BSA内源荧光产生有规律的猝灭,且其最大发射波长有明显逐渐蓝移现象,由此可判断它们发生了相互作用.这种作用可能造成蛋白质的荧光发色团微环境及分子构象行为变化,从而发生荧光猝灭.
2.2 PFOA对BSA荧光猝灭机理
蛋白质荧光猝灭机理主要可分为动态猝灭和静态猝灭.动态荧光猝灭是指猝灭剂分子与荧光分子在分子运动发生碰撞而引起荧光猝灭.动态猝灭受反应温度影响大,随着反应温度升高,分子运动加快,动态猝灭加剧.各类猝灭剂的最大动态猝灭常数为2.0×1010L/(mol·s).荧光静态猝灭是指猝灭剂与荧光物质相互结合生成无荧光特性的复合物而造成荧光猝灭.与动态猝灭相比,荧光静态猝灭受反应温度影响较小[11].

图1 全氟辛酸对BSA荧光光谱影响Fig.1 Effect of PFOA on florescence spectra of BSA
分别测定了在277,298和310K温度条件下PFOA对BSA的荧光猝灭作用.假设 PFOA对BSA为动态猝灭,则采用Stern-Volmer方程可得式(1):

式中:F0和F分别表示无猝灭剂和有猝灭剂时BSA的荧光强度;[Q]为猝灭剂即 PFOA的浓度;KSV为荧光动态猝灭常数;Kq为荧光动态猝灭速率常数;τ0为无猝灭剂时荧光分子的平均寿命(约10-8s).由表1可见,PFOA对BSA在277、298、310K时荧光猝灭速率常数Kq分别是9.3×1012,6.8×1012,6.2×1012L/(mol·s), 远大于最大动态猝灭常数为2.0×1010L/(mol·s);且随着温度升高,Kq值降低.说明PFOA对BSA的荧光猝灭是静态猝灭而非动态猝灭.
2.3 PFOA与BSA的结合常数及结合位点数
当PFOA对BSA产生静态猝灭时,它们将形成新的复合物.假设PFOA在BSA上有n个相同且独立的结合位点,那么PFOA与BSA的关系可由式(2)表达:
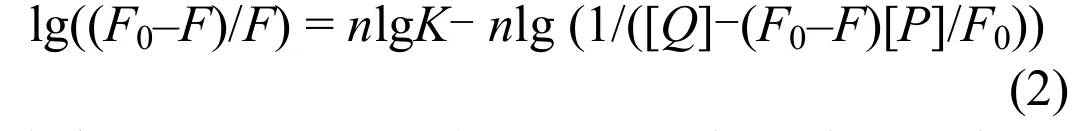
式中:F0和F分别表示无猝灭剂和有猝灭剂时BSA的荧光强度;[Q]为猝灭剂即PFOA的浓度;[P]为BSA的浓度;K为结合常数;n为结合位点 数[12].以lg((F0–F)/F)为纵坐标(y轴),以lg(1/([Q]-(F0–F)[P]/ F0))为横坐标(x 轴)作图(图2),即可求出PFOA与BSA的结合常数及结合位点数.

表1 全氟辛酸对牛血清白蛋白的荧光动态猝灭常数Table 1 Florescence dynamic quenching constants of PFOA-BSA system

图2 全氟辛酸与牛血清白蛋白的lg((F0–F)/F)-lg(1/([Q]-(F0–F)[P]/F0))图Fig.2 The pots of lg((F0–F)/F)-lg(1/([Q]-(F0–F) [P]/F0))of PFOA-BSA system
从表 2可见,PFOA与 BSA的结合常数在104L/mol数量级以上,结合位点数约为1,说明二者形成较稳定的1:1复合物,同时也意味着PFOA进入生物体内后,能被血清蛋白携带着在体内进行运移.此外,随着温度的增加结合常数降低,进一步验证PFOA对BSA的荧光猝灭是一静态过程.有研究表明,BSA在134和212位有2个色氨酸残基[13],Laura等[14]根据 Stern-Volmer二级方程曲线形状推测 BSA的两个色氨酸残基都是PFOA 结合位点,其中一个是强结合位点,一个是弱结合位点.然而,本文采用改进的双对数方程方法分析得到只有一个强结合位点,是否还存在一个弱结合位点,需要进一步深入研究.
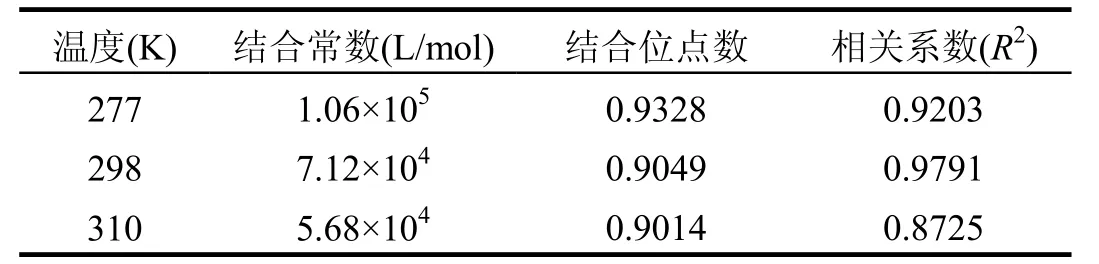
表2 全氟辛酸与牛血清白蛋白结合常数及结合位点数Table2 The binding constant and binding site number of PFOA-BSA system
2.4 PFOA与BSA相互作用力类型

表3 全氟辛酸与牛血清白蛋白结合的热力学参数Table 3 The thermodynamic parameters of PFOA-BSA system
根据3个热力学公式:1)ln(K2/K1)=ΔH(1/T1-1/T2)/R,2) ΔG=-RTlnK,3) ΔS=(ΔH-ΔG)/ T.分别计算出PFOA与BSA的反应焓变ΔH、自由能变ΔG和熵变ΔS.从表3中可以看出PFOA与BSA的相互结合是一个自发的(ΔG>0)、放热的(ΔH<0=过程,也是一个熵增过程(ΔS>0),因此它们的相互作用是熵和焓共同驱动完成. 有机小分子与蛋白质、DNA等生物大分子之间主要通过疏水力、氢键、范德华力和静电引力等非共价力相互作用.Ross等[15]实验总结出了小分子与生物大分子结合作用力类型的热力学规律,即:当ΔH>0,ΔS>0 时,主要作用力是疏水作用力;当ΔH>0,ΔS<0 时,主要作用力是氢键或范德华力;当ΔH<0,ΔS>0时,主要作用力是静电引力.由表3可见,PFOA与BSA 反应的ΔH<0, ΔS>0,因此它们的相互作用力主要是静电引力.在水相中PFOA电离成酸根离子可能是静力引力产生的主要原因.然而,由于PFOA具有一定的疏水性,所以疏水力对它们相互结合也有不可忽略的作用.
2.5 PFOA对BSA分子构象的影响

图3 酪氨酸和色氨酸的同步荧光光谱Fig.3 Effect of PFOA on the synchronous fluorescence spectra of tyrosine and tryptophan.
蛋白质中色氨酸、酪氨酸和苯丙氨酸这3种有荧光的芳香族氨基酸的荧光光谱发射峰严重重叠,常规荧光扫描光谱难以把它们的特征光谱区分,所以需要采用同步荧光光谱扫描才能对这些氨基酸进行特征扫描.同步荧光光谱是指固定激发波长与发射波长的间距Δλ,同时扫描激发波和发射波所测的扫描光谱.它可提供荧光发射基团附近微环境的变化信息.血清蛋白分子中酪氨酸残基和色氨酸残基的同步荧光特征光谱分别是Δλ=15nm 和Δλ=60nm[16].当固定BSA浓度时,随着PFOA浓度的增大,酪氨酸残基的荧光强度被激活升高,而色氨酸残基荧光强度显著猝灭(图3),说明PFOA与BSA的结合位点接近于色氨酸残基.色氨酸最大发射波长均发生了蓝移,表明BSA与PFOA相互作用后,色氨酸附近的极性减弱,疏水环境增强,蛋白质分子结构趋于折叠状态.酪氨酸残基荧光强度被激活升高的原因可能是靠近酪氨酸附近的极性和亲水环境增强,蛋白质分子结构的趋于松散,从而使酪氨酸更容易受到紫外光激发下产生荧光效应.
3 结论
3.1 全氟辛酸(PFOA)对牛血清白蛋白(BSA)内源荧光具有强烈的静态猝灭作用,两者反应生成无荧光的复合物是导致BSA荧光猝灭的主要原因.
3.2 PFOA与BSA的结合常数在104L/mol数量级以上,结合位点为1个,结合位点接近于色氨酸残基.
3.3 热力学参数表明,FOA与BSA的相互结合可能是静电引力和疏水力共同作用的结果.
3.4 与PFOA相互作用后,BSA的色氨酸残基附近的疏水环境增强,蛋白质分子结构趋于折叠状态;而酪氨酸残基附近的亲水性环境增强,蛋白质分子结构趋于松散状态.
[1]祝凌燕,林加华.全氟辛酸的污染状况及环境行为研究进展 [J].应用生态学报, 2008,19(5):1149-1157.
[2]John P Giesy, Kurunthaehaam Kannan. Global distribution of pefluorooetane sulfonate in wild life [J]. Environ. Sci. Technol.,2001,35:1339-1342.
[3]Prevedouros K, Cousins I T, Buck R C, et a1. Sources, fate and transport of perfluorocarboxylates [J]. Environ. Sci. Technol.,2006,40:32-44.
[4]Kurunthachalam K, Jaana K, Kimberlee B, et al. Accumulation of perfluorooctane sulfonate in marine mammals [J]. Environ. Sci.Technol., 2001,35:1593-1598.
[5]Magali H, Trevor A D, Bujas J S, et al. Biomagnification of perfluoroalkyl compounds in the bottlenose dolphin (Tursiops truncatus) food web [J]. Environ. Sci. Technol., 2006,40:4138-4144.
[6]OECD. Co-operation on existing chemicals: Hazard assessment of perfluorooctane sulfonate and its salts, environment directorate joint meeting of the chemicals committe and the working party on chemicals, pesticides and biothechnology [M]. Paris: Organisation for Economic Co-operation and Development, 2002-11-21.
[7]EU. Proposal for a Directive of the European Parliament and of the Council relating to restrictions on the marketing and use of perfluorooctane sulfonates (amendment of Council Directive 76/769/ EEC) [M]. 2006-10-25.
[8]U. S. EPA’s Science Advisory Board Science.Advisory board process backgrounder l EB/0L 1 [M]. 2005-09-22.
[9]Luebker D J, Hansen K J. Interactions of fluroehemicals with rat liver fatty acid-binding protein [J]. Toxicology, 2002,176:175-185.
[10]Gelamo E L, Silva C H T P, Imasato H, et al. Interaction of bovine (BSA) and human (HSA) serum albumins with ionic surfactants: spectroscopy and modeling [J]. Biochimica Biophysica Acta, 2002, 1594:84-99.
[11]Brotati Chakraborty, Samita Basu. Interaction of BSA with proflavin: A spectroscopic approach [J]. Journal of Luminescence,2009,29:34-39.
[12]梁彦秋,臧树良,邓 斌,等.2,4-二硝基苯胺与牛血清白蛋白相互作用的研究 [J]. 分析试验室, 2009, 28(3):74-77.
[13]Bi S Y, Song D Q,Tian Y, et al. Molecular spectroscopic study on the interaction of tetracyclines with serum albumins[J].Spectrochimica Acta Part A 2005,61:629–636.
[14]Laura A MacManus-Spencer, Monica L Tse, Paul C Hebert, et al.Luthy Binding of perfluorocarboxylates to serum albumin: a comparison of analytical methods [J]. Anal. Chem. 2010, 82:974-981.
[15]Ross P D, Subramanian S. Thermodynamics of protein association reactions:forces contributing to stability [J].Biochemistry, 1981,20:3096–3102.
[16]Timasheff S N, Peeters H. Protein of biological fluids [M].Oxford: Pergamon Press, 1972:511-519.
[17]Zhang Guowen, Wang Anping, Jiang Ting, et al. Interaction of the irisflorentin with bovine serum albumin: A fluorescence quenching study [J]. Journal of Molecular Structure, 2008,891:93-97.
