负重训练和补肽对衰老大鼠骨骼肌α-actin mRNA和MHC异形体mRNA表达影响的研究
2010-01-03刘丰彬王洪丹
刘丰彬,王洪丹,贾 华
负重训练和补肽对衰老大鼠骨骼肌α-actin mRNA和MHC异形体mRNA表达影响的研究
刘丰彬1,王洪丹2,贾 华2
目的:探讨负重训练和补充大豆多肽对D-半乳糖衰老大鼠骨骼肌α-actin mRNA和MHC异形体mRNA表达的影响。方法:56只3月龄雄性SD大鼠随机分为7组、每组8只、成年组、模型组、小负重组、大负重组、补肽组、补肽小负重组、补肽大负重组。除成年组外,其余各组进行6周D-半乳糖造模同时施加相应大、小负重的跑台训练和补肽干预,6周后处死大鼠,测试各项指标。结果:与成年组相比,模型组大鼠骨骼肌α-actin、MHC-I、MHC-IIa、MHC-IIx mRNA表达量显著下降(P<0.01),MHC-IIb mRNA的表达量显著升高(P<0.01),负重训练或补肽干预均可以有效缓解这种骨骼肌衰老性的表现,两种方法具有显著的交互作用(P<0.01或P<0.05)。结论:负重训练或补充大豆多肽均可以有效缓解衰老大鼠骨骼肌α-actin和MHC异形体mRNA表达量的衰老性表现,并且两种方法联合应用效果好于单一干预因素。
负重训练;大豆多肽;骨骼肌;α-肌动蛋白;肌球蛋白重链异形体
衰老是一个十分复杂的多环节生物学过程,由于衰老而引发的医疗、社会保障、老年人生活等一系列社会和经济问题,也使世界各国对老年人的健康问题引起了普遍关注[1-3]。面对人体最先开始衰老的组织之一,骨骼肌衰老的研究已经逐渐引起各国学者特别是体育科研人员的重视[4-5]。研究骨骼肌衰老的真正原因和作用机制,并通过合理有效的方法或措施来干预骨骼肌的衰老,延缓因此而引发的一系列人体退行性的变化,值得深入研究。
本研究运用医学衰老研究中常用的D-半乳糖皮下注射的方法,建立大鼠亚急性骨骼肌衰老模型,并选取负重训练和补充大豆多肽两种方式在模型形成过程中进行干预,通过测试各组α-actin mRNA和MHC异形体mRNA的变化,分析两种方式干预骨骼肌衰老的作用效果,并初步探讨其干预骨骼肌衰老过早出现可能的分子机制。
1 材料与方法
1.1 实验动物及分组
3月龄SD纯系雄性健康大鼠56只,平均体重300 g,清洁级,由河北省动物实验中心提供(许可证编号:SCXK(冀)2003-1-003)。大鼠分笼饲养,每笼 3~4 只,室温(22±2)℃,相对湿度55%左右,每天自然光照,自由饮水摄食。动物饲料选用国家标准啮齿类动物混合饲料,由河北省动物实验中心提供。大鼠购回后随机分 7组:成年组(C)、模型组(M)、小负重组(S)、大负重组(B)、补肽组(P)、补肽小负重组(PS)和补肽大负重组(PB),每组8只。
1.2 动物模型建立及各组动物具体处理
除成年组常规饲养6周外,其余各组进行大鼠亚急性骨骼肌衰老模型的复制[6],D-半乳糖溶液按200 mg/(kg·d)(5%)进行颈背部皮下注射,每天一次,连续6周。跑台负重跑训练方案参考 Bedford 等[7]和闫万军等[8]的方法,跑速 15 m/min,坡度 0°,跑2 min,休息2 min为一组,每天连续6组,每天一次,周日休息,共6周。大、小负重分别相当于大鼠最大负重70%和30%。大豆多肽主要含五肽、六肽和八肽,分子量在200~600 Da之间,经质谱法测定多肽的氨基酸序列为:(1)Leu Ala Pro Glu(2)Met Ser Leu Pro Thr Asn(3)Arg Leu Met Leu His Leu Ala Pro,由山东中食都庆生物技术有限公司提供。各补肽组在每次运动后30 min内进行灌胃,每日一次,连续6周,大豆多肽灌胃剂量按0.15 g/100 g(15%)进行,运动对照组灌胃等量生理盐水[9]。
1.3 动物取材及样本处理
实验6周末,最后一次运动后所有组大鼠禁食12 h进行取材。腹腔注射1%戊巴比妥钠溶液(50 mg/kg)麻醉处死,无菌条件下取大鼠左侧股四头肌股直肌深层肌肉约200 mg,-70℃冰箱保存,待测骨骼肌分子生物学指标。
1.4 测试指标及方法
以内对照半定量反转录聚合酶链式反应(RT-PCR)方法分析骨骼肌肌动蛋白(α-actin)mRNA和肌球蛋白重链(MHC)异形体mRNA表达。相应试剂由美国Promega公司提供。
1.4.1 细胞总RNA的提取 采用Trizol法提取细胞总RNA。
1.4.2 cDNA合成 逆转录反应体系20 μL,包括细胞总RNA 2 μL,随机引物(500 ng/μL)1 μL,5×buffer缓冲液 4 μL,10 mM dNTP 1 μL,RNasin (50 u/μL)1 μl,M-MLV 逆转录酶(300 u/μL)1 μL,去离子水 10 μL。
1.4.3 RT-PCR扩增 引物序列检索自NCBI-Nucleotide数据库,采用Primer5.0软件设计,由大连宝生物工程有限公司合成。α-actin(115bp) 上下游引物:5'- TGCCTGCTATGTATGTGGC TATTCA -3'和 5'- CTCATAGATGGGCACGTTGTGG-3',MHC-I(537bp)上下游引物:5'- GCCAACTATGCTGGAGCTGAT -3'和5'-CCATTCTGGAAAGTACACCTCGG-3',MHC-IIa(488bp)上下游 引 物 :5'- ATGCTAACTGACCGGGAGAATC -3'和 5'-AT CAATGCTGGCCACACTGAT-3',MHC-IIb(382bp)上下游引物:5'- TGTACCAGAAGTCCGGGTTGAAG -3'和 5'-GGGATAG CACTTGCATTGAGAACT -3',MHC-IIx(463bp)上下游引物:5'-CTAAAGGCAGACTCTCCCACTG -3'和 5'- CACCTCTGCAT TATACACTGGC -3',β -actin (500 bp) 上 下 游 引 物 :5'-CAGGGTGTGATGGTGGG -3'和 5'-GGAAGAGGATGCGGCAG -3'。反应体系25 μL,包括逆转录产物1 μL,各检测指标上下游引物(10 pmol/μL)2 μl,β-actin 上下游引物(10 pmol/μL)1 μL,Red Taq DNA 聚合酶扩增体系(1U/μL)12.5 μL,双蒸水 9.5 μL。α-actin、MHC-I、MHCIIa 、MHCIIb、MHCIIx、β-actin 均先采用95℃预变性5 min,95℃变性30 s,分别在57℃、4个53℃和56℃退火30 s,72℃延伸5 min,进行35个循环。
产物分析:取15 μL扩增产物,在2%琼脂糖凝胶上进行电泳(100 V,30 min),应用凝胶成像分析系统观察结果,读取各条产物带的光密度值并分析照相。目的基因条带光密度参数与内参基因(β-actin)条带光密度参数的比值作为目的基因mRNA的表达水平。
1.5 统计学处理
数据用平均值±标准差表示,用SPSS for Windows 13统计软件进行分析。针对单一因素多组间数据比较,采用单因素方差分析(One-Way ANOVA);各因素对指标的主效应以及各因素间交互作用对指标的影响,采用双因素方差分析。显著性水平为 P<0.05,非常显著性水平为 P<0.01。
2 结 果
2.1 骨骼肌组织α-actin mRNA表达的比较
与C组相比,M组大鼠骨骼肌中α-actin mRNA表达显著下降(P<0.01)。双因素方差分析,负重训练或补肽均能使衰老大鼠骨骼肌中 α-actin mRNA 表达显著升高(P<0.01),负重联合补肽可使 α-actin mRNA 表达进一步升高(P<0.01),两者具有显著的交互作用(见表1)。
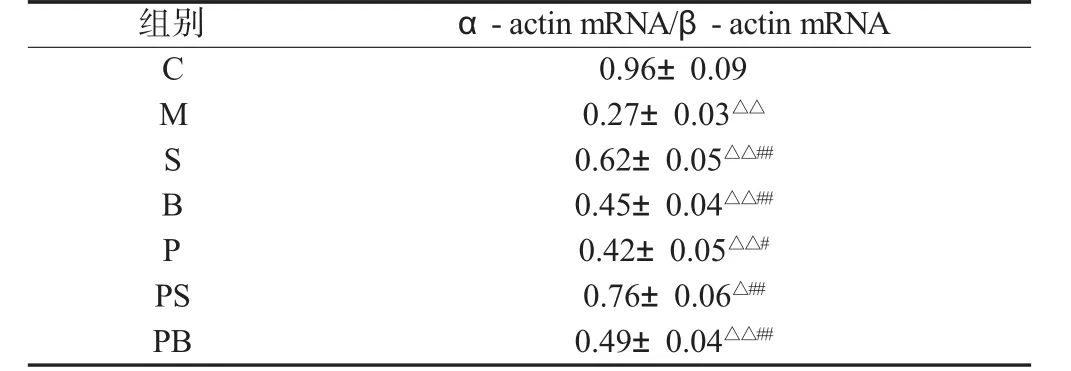
表1 骨骼肌组织α-actin mRNA表达的比较(n=8)Table 1 Comparisons of α-actin mRNA expression of skeletal muscle(n=8)
2.2 骨骼肌组织MHC-I mRNA表达的比较
与C组相比,M组大鼠骨骼肌中MHC-I mRNA表达显著下降(P<0.01)。双因素方差分析,负重训练或补肽均能使衰老大鼠骨骼肌中 MHC-I mRNA 表达显著升高(P<0.01),负重联合补肽可使 MHC-I mRNA 表达进一步升高(P<0.01),两者具有显著的交互作用(见表2)。
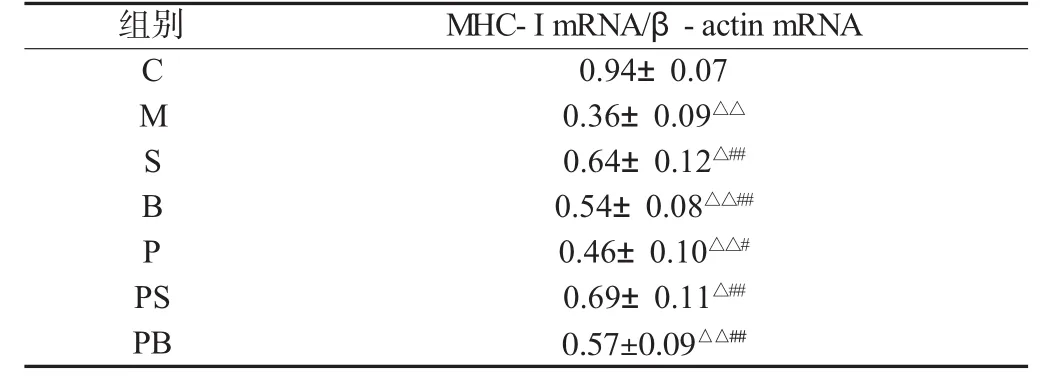
表2 骨骼肌组织MHC-I mRNA表达的比较(n=8)Table 2 Comparisons of MHC-I mRNA expression of skeletal muscle(n=8)
2.3 骨骼肌组织MHC-IIa mRNA表达比较
与C组相比,M组大鼠骨骼肌中MHC-IIa mRNA表达显著下降(P<0.01)。双因素方差分析,负重训练或补肽均能使衰老大鼠骨骼肌中 MHC-IIa mRNA 表达显著升高(P<0.01),负重联合补肽可使 MHC-IIa mRNA 表达进一步升高(P<0.01),两者具有显著的交互作用(见表3)。
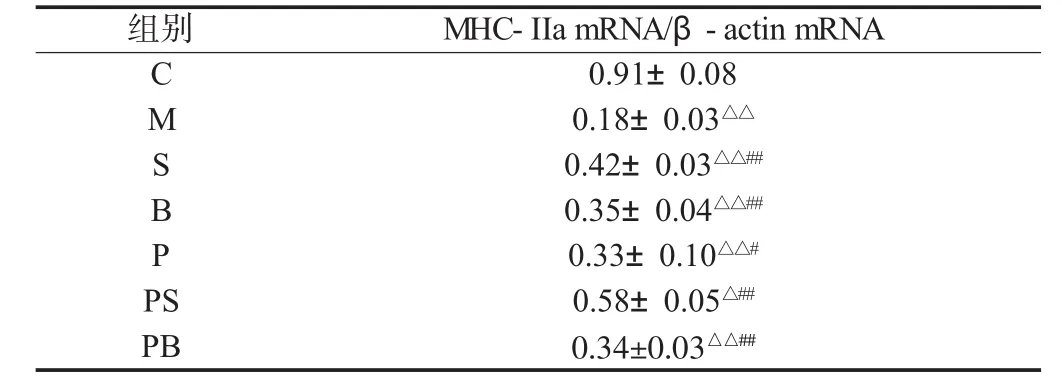
表3 骨骼肌组织MHC-IIa mRNA表达的比较(n=8)Table 3 Comparisons of MHC-IIa mRNA expression of skeletal muscle(n=8)
2.4 骨骼肌组织MHC-IIb mRNA表达的比较
与C组相比,M组大鼠骨骼肌中MHC-IIb mRNA表达显著升高(P<0.01)。双因素方差分析,负重训练或补肽均能使衰老大鼠骨骼肌中 MHC-IIb mRNA 表达显著降低(P<0.05),负重联合补肽可使 MHC-IIb mRNA 表达进一步降低(P<0.01),两者具有显著的交互作用(见表4)。
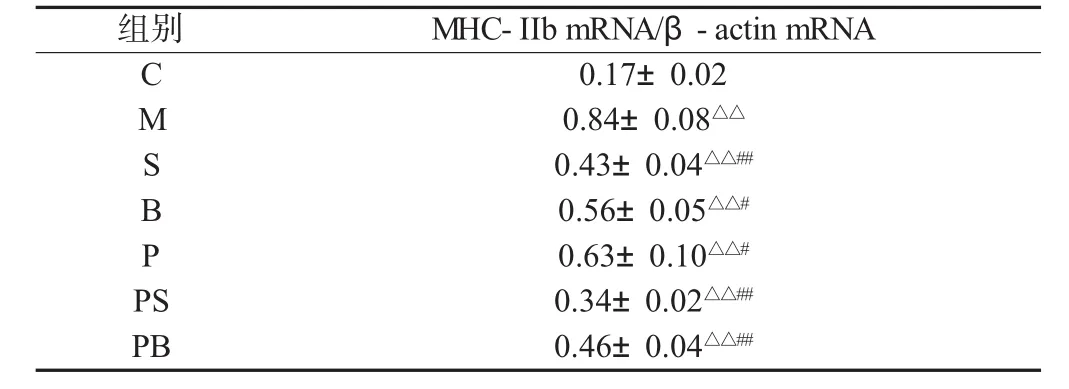
表4 骨骼肌组织MHC-IIb mRNA表达的比较(n=8)Table 4 Comparisons of MHC-IIb mRNA expression of skeletal muscle(n=8)
2.5 骨骼肌组织MHC-IIxmRNA表达的比较
与C组相比,M组大鼠骨骼肌组织中MHC-IIx mRNA表达显著下降(P<0.01)。双因素方差分析,负重训练或补肽均能使衰老大鼠骨骼肌中 MHC-IIx mRNA 表达显著升高(P<0.01),负重联合补肽可使 MHC-IIx mRNA 表达进一步升高(P<0.01),两者具有显著的交互作用(见表5)。
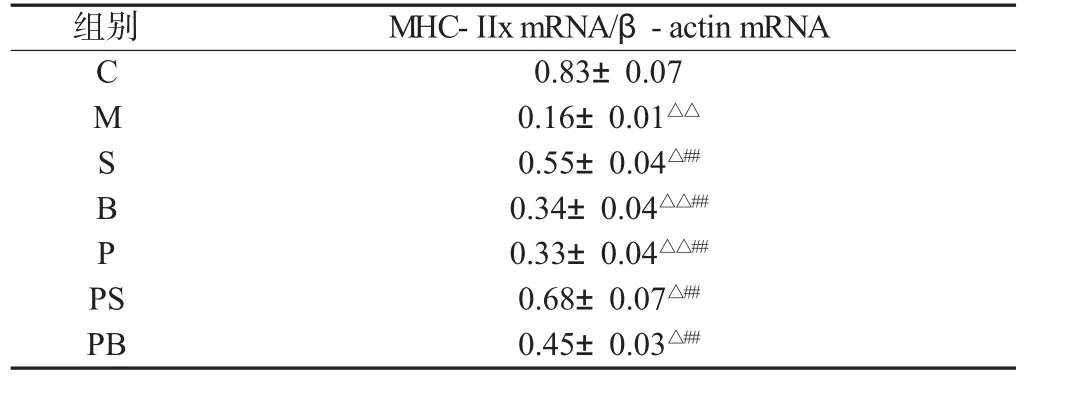
表5 骨骼肌组织MHC-IIx mRNA表达的比较(n=8)Table 5 Comparisons of MHC-IIx mRNA mRNA expression of skeletal muscle(n=8)
3 讨论与分析
关于衰老和抗衰老的研究历来都是国际性的医学难题,国内外学者也在尝试各种方法和手段来对抗衰老,研究领域也涉及多个层面[9-12]。如何将运动和营养干预这两种更为经济和安全的方式结合起来,使身体各器管、各系统的功能产生良好的效应,以对抗机体衰老,特别是骨骼肌的衰老,值得深入研究和探讨。
借鉴以往的研究成果和相关动物实验的经验[8,13-14],本研究采用在大鼠背部负重物的方式模拟人类的抗阻训练,并确定了本实验的动物负重训练方案。同时参考有关动物营养实验的结果和实验方法[15-17],本研究采用经大鼠口腔灌胃补充大豆多肽的营养干预方法。
研究表明,骨骼肌α-actin是肌动蛋白亚类的一种,其基因表达与骨骼肌结构和功能关系密切[18-19]。随着年龄的增长,下丘脑-垂体-性腺及其相应神经控制系统的活动减弱,使骨骼肌αactin基因的表达降低[20]。本研究也证实了这种观点,与C组相比,M组大鼠骨骼肌α-actin mRNA的表达显著降低。提示:D-半乳糖造成衰老大鼠神经和内分泌系统的调节能力减退,下丘脑-垂体-性腺活动减弱,进而影响到基因的转录水平和翻译水平,使骨骼肌α-actin的合成速率减慢,α-actin mRNA表达量下降。
而6周的负重训练可以使衰老大鼠骨骼肌α-actin mRNA表达量显著性的提高。提示:负重训练对可能会使骨骼肌产生一种慢性的微损伤,骨骼肌代偿性调动各种途径加强收缩蛋白的合成,使骨骼肌处于不断的运动刺激与蛋白质的不断降解和修复的状态,导致α-actin mRNA表达量的升高。6周大豆多肽的补充也可以显著提高衰老大鼠骨骼肌α-actin mRNA表达量,但作用效果不及负重训练。提示:大豆多肽可以纠正衰老导致的mRNA合成和分解代谢的不平衡,提高mRNA在体内含量和活性,从转录水平上影响α-actin基因的表达,同时其也可能影响α-actin的合成速率,从翻译水平上影响α-actin的合成,但具体机制还有待于进一步的研究。
同时,本研究还发现负重联合补肽比单独运用其中一种方法更能够提高D-半乳糖衰老大鼠骨骼肌α-actin mRNA的表达量。
肌球蛋白重链异形体(MHC)是肌纤维收缩特性的主要决定因素。研究表明,MHC合成的速率随年龄的增加而有所下降,这种下降可能和MHC mRNA表达的减少有关[21-22]。本研究得到了相似的结果,与C组相比,M组大鼠骨骼肌MHC-I、MHC-IIa、MHC-IIx mRNA的表达显著降低,但MHC-IIb mRNA表达显著升高。提示:随着大鼠衰老程度的加深,出现了骨骼肌机能下降以及肌肉萎缩的现象,可能是由于支配肌纤维的运动神经元出现了萎缩和退化,并在MHC转录水平上发挥作用,影响了mRNA的合成。至于MHC-IIb mRNA表达的结果似乎与先前的研究有所不同,也可能是衰老导致骨骼肌MHC异形体的构成比例发生变化,即从 MHC-IIa、MHC-IIx 向 MHC-IIb的转变,但具体的原因还需进一步研究。
大量的研究证实,体育锻炼,特别是规律的力量训练可以延缓因增龄而引起的骨骼肌机能的下降,并且在基因水平上也有所表现[4,23]。本研究结果显示:与M组相比,各负重组大鼠骨骼肌 MHC-I、MHC-IIa、MHC-IIx mRNA 的表达显著提高,MHCIIb mRNA表达显著降低,这与以往的研究基本一致[21]。提示:6周的负重训练,增加了对衰老骨骼肌的神经-肌肉刺激,对MHC各种亚型mRNA的合成产生积极的作用,导致与骨骼肌功能密切的 MHC 构成比例发生变化,即从 MHC-IIb,MHC-IIx,MHCIIa向MHC-I转变。但有研究认为,力量训练使MHC-I和MHCII之间的相互转化比较复杂和困难,而MHC-II各亚型之间的转化则较为容易和常见[19],其中涉及负重训练可能导致骨骼肌卫星细胞的激活、运动单位的重组和ATP酶活性调节等原因有待深入的研究。
关于营养补充对MHC异形体mRNA表达的影响,也有不少的报道,但缺少对衰老骨骼肌MHC异形体mRNA表达的研究[9]。本研究发现,与M组相比,P组大鼠骨骼肌MHC-I、MHCIIa、MHC-IIx mRNA的表达显著提高,MHC-IIb mRNA表达显著降低,但效果不及负重组明显。提示:在衰老的过程中补充大豆多肽,可以有效的改善体内蛋白质代谢,并可能增加ATP酶和MHC相关调节因子的活性,提高MHC含量和合成速率,在转录、翻译或者翻译后等多个水平上影响MHC mRNA的表达,但大豆多肽影响MHC mRNA表达的确切原因还不十分清楚。同时,本研究还发现负重联合补充大豆多肽比单独运用其中一种方法更能够改善大鼠骨骼肌MHC mRNA的衰老性表现,但由于影响MHC蛋白水平和mRNA表达水平的因素较多,真正弄清其中的调控机制,有待进一步的深入研究。
4 结 论
(1)6周D-半乳糖皮下注射,可以使大鼠骨骼肌出现αactin、MHC-I、MHC-IIa、MHC-IIx mRNA 表达量下降和 MHCIIb mRNA的表达量提高等衰老性表现。(2)在造模的同时进行6周的负重训练或补充大豆多肽干预,可以有效缓解骨骼肌αactin和MHC异形体mRNA表达量的衰老性表现。(3)负重训练联合补充大豆多肽干预大鼠骨骼肌α-actin和MHC异形体mRNA表达量的衰老性表现的效果好于单一干预因素。
[1]Haus J M,Carrithers J A,Trappe S W,et al.Collagen,cross-linking,and advanced glycation and products in aginghuman skeletal muscle[J].J Appl Physiol,2007,103(6):2 068-2 076.
[2]Best H.Educational systems and the continuum of care for the older adult[J].J Dent Educ,2010,74(1):7-12.
[3]王凯珍,王庆峰,王庆伟.中国城市老年人体育组织管理体制的现状调查研究[J].西安体育学院学报,2005,(1):1-5.
[4]Liu Y,Heinichen M,Wirth K,et al.Response of growth and myogenic factors in human skeletal muscle to strength training[J].Br J Sports Med,2008 ,42(12):989-993.
[5]Johnston A P,De Lisio M,Parise G.Resistance training,sarcopenia and the mitochondrial theoryof aging[J].Appl Physiol Nutr Metab,2008 ,33(1):191-199.
[6]徐智,吴国明,钱桂生,等.大鼠衰老模型的初步建立[J].第三军医大学学报,2003,25(4):312-315.
[7]Bedford T G,Tipion C M,Nilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedure[J].J Appl Physiol,1979,47(6):1 278-1 283.
[8]闫万军,赵斌,刘丰彬,等.负重跑训练对老龄大鼠肌肉丢失的影响[J].中国体育科技,2009,45(4):120-124.
[9]Aguiar A F,Aguiar D H,Felisberto A D,et al.Effects of creatine supplementation duringresistance training on myosin heavy chain(MHC)expression in rat skeletal muscle fibers[J].J Strength Cond Res,2010 ,24(1):88-96.
[10]HolmL,Reitelseder S,Pedersen T G,et al.Changes in muscle size and MHC composition in response to resistance exercise with heavy and light loadingintensity[J].J Appl Physiol,2008 ,105(5):1 454-1 461.
[11]Raue U,Slivka D,MinchevK,et al.Improvements in whole muscle and myocellular function are limited with high-intensity resistance training in octogenarian women[J].J Appl Physiol,2009,106(5):1 611-1 617.
[12]Sallinen J,Pakarinen A,Fogelholm M,et al.Dietary intake,serum hormones,muscle mass and strength during strength training in 49-73-year-old men[J].Int J Sports Med,2007,28(12):1 070-1 076.
[13]Santtila M,Keijo H,Laura K,et al.Changes in cardiovascular performance during an 8-week military basic training period combined with added endurance or strength training[J].Mil Med,2008,173(12):1 173-1 179.
[14]闫万军,赵斌,刘丰彬,等.衰老肌细胞的组织学特征研究[J].天津体育学院学报,2009,24(3):212-215.
[15]William J.Protein nutrition,exercise and aging[J].Journal of the American College of Nutrition,2004,23(6):S601-609.
[16]Tang J E,Moore D R,Kujbida G W,et al.Ingestion of whey hydrolysate,casein,or soy protein isolate:effects on mixed muscle protein synthesis at rest and following resistance exercise in young men[J].J Appl Physiol,2009,107(3):987-992.
[17]Elia D,Stadler K,Horváth V,et al.Effect of soy-and whey protein-isolate supplemented diet on the redox parameters of trained mice[J].Eur J Nutr,2006,45(5):259-266.
[18]Aleksei Krasnov,Heli Teerijoki,Yuri Gorodilov,et al.Cloningofrainbow trout α-actin,myosin regulatory light chain genes and the 5'-flanking region of α-tropomyosin.Functional assessment of promoters[J].The Journal of Experimental Biology,2003,206:601-608.
[19]Pandorf C E,Haddad F,Roy R R,et al.Dynamics of myosin heavy chain gene regulation in slow skeletal muscle:role of natural antisense RNA[J].J Biol Chem,2006,281(50):38 330-38 342.
[20]LaDoraV,DavidDurand,NicoleA,etal.Myosin and actin expression and oxidationinagingmuscle[J].J Appl Physiol,2006,101:1581-1587.
[21]Short K R,Vittone J L,Bigelow M L,et al.Human skeletal muscle with age and endurance exercise training[J].J Appl Physiol,2005,99(1):95-102.
[22]Slivka D,Raue U,Hollon C,et al.Single muscle fiber adaptations to resistance training in old (>80 yr)men:evidence for limited skeletal muscle plasticity [J].Am J Physiol Regul Integr Comp Physiol,2008,295(1):R273-280.
[23]Wilborn C D,Taylor L W,Greenwood M,et al.Effects of different intensities of resistance exercise on regulators of myogenesis[J].J Strength Cond Res,2009,23(8):2 179-2 187.
Effect of Weight Training and Soy Polypeptide Supplement on α-actin mRNA and MHC Isoforms mRNA of Aging Rat Skeletal Muscle
LIU Fengbin1,WANG Hongdan2,JIA Hua3
(1.School of PE,Dalian University,Dalian 116622,China;2.Dept.of Graduate,Jilin Institute of Physical Education,Changchun 130022,China;3.School of PE,Hebei Normal University,Shijiazhuang 050016,China)
Objective:To study of the effect of weight training and soy polypeptide supplement on α-actin mRNA and MHC isoforms mRNA of D-galactose of aging rat skeletal muscle.Method:56 3-month male SD rats were randomly divided into 7 groups,8 in each group:adult group,model group,small load exercise group,big load exercise group,peptide group,peptide and small load exercise group,peptide and big load exercise group.All the groups were modeled in 6-week D-galactose injection and interfered in the corresponding big and small weight run training and soy polypeptide supplement except adult group.The rats were killed after 6 weeks,and tested the indicators.Result:Compared with the adult group,the α-actin,MHC-I,MHC-IIa,MHC-IIx mRNA expression in rats skeletal muscle of model group were significantly decreased (P<0.01),MHC-IIb mRNA expression was significantly increased(P<0.01),weight training or soy polypeptide supplement could effectively alleviate the aging performance of skeletal muscle,they had notable interaction(P<0.01 or P<0.05).Conclusions:Weight training or soy polypeptide supplement may alleviate the age-related performance of aging rats skeletal muscle in α-actin and MHC isoform mRNA expression effectively,the combined effect of two methods was better than a single intervention factor.
weight training;soy polypeptide;skeletal muscle;α-actin;myosin heavy chain isoforms
G 804.23
A
1005-0000(2010)05-0388-04
2010-06-21;
2010-08-02;录用日期:2010-08-05
河北省自然基金(项目编号:C2008000177);大连大学博士科研基金联合资助项目
刘丰彬(1981-),男,辽宁大连人,讲师,博士,研究方向为体育健康促进的理论与应用。
1.大连大学体育学院,辽宁大连116622;2.吉林体育学院研究生部,吉林长春130022;3.河北师范大学体育学院,河北石家庄050016。
