胃癌和癌旁组织血管扩张刺激磷蛋白表达差异的研究
2009-11-29彭小春张京伟
彭小春 张京伟 魏 蕾
(长江大学医学院,湖北 荆州 434023)(武汉大学中南医院肿瘤外科,湖北 武汉 430071)(武汉大学基础医学院病理生理学教研室,湖北 武汉 430071)
胃癌和癌旁组织血管扩张刺激磷蛋白表达差异的研究
彭小春 张京伟 魏 蕾
(长江大学医学院,湖北 荆州 434023)(武汉大学中南医院肿瘤外科,湖北 武汉 430071)(武汉大学基础医学院病理生理学教研室,湖北 武汉 430071)
目的:观察血管扩张刺激磷蛋白(Vasodilator-stimulated Phosphoprotein,VASP)在胃癌组织和癌旁组织中表达的差异,探讨其在胃癌形成和转移中的作用。方法:收集胃癌组织42例和癌旁胃粘膜组织16例。癌组织按病理学和组织学分期分度。用免疫组化方法观察其VASP表达和分布。结果:癌旁正常胃粘膜组织中,胃粘膜上皮细胞及腺上皮细胞未见VASP阳性表达,而巨噬细胞和淋巴细胞有很强的VASP阳性表达。VASP在癌组织(粘膜上皮细胞、腺上皮细胞、血管内皮细胞、血管平滑肌细胞)有很强的表达,高于癌旁正常胃粘膜的表达;VASP表达在高、中、低分化腺癌中平均免疫印记指数分别为0.757、1.152、1.457,高分化腺癌组与中、低分化腺癌组间差别均有统计学意义(Plt;0.05);VASP表达在TNM Ⅰ、Ⅱ期组和TNM Ⅲ、Ⅳ期组中平均免疫印记指数分别为0.685和1.476,差异有统计学意义 (Plt;0.01);VASP在无淋巴转移和有淋巴转移组中平均免疫印记指数为1.753、0.673,差异有统计学意义(Plt;0.01)。结论:VASP在正常的胃组织和胃癌中分布和表达差异表明VASP参与了正常的胃粘膜上皮细胞向癌细胞分化的过程;VASP表达增加与其病理分级是平行的,这也说明VASP可能是调控胃癌侵袭特性的重要分子。
血管扩张刺激磷蛋白;胃肿瘤;免疫组化
胃癌是消化道最常见的恶性肿瘤,来源于胃粘膜上皮,占胃恶性肿瘤的95%,是目前世界范围内因为肿瘤导致死亡的主要原因之一[1,2],其侵袭和转移是影响患者预后的主要因素。临床上约有60%的肿瘤病人虽然经过有效的治疗,但最终死于侵袭和转移。众多研究发现,胃癌的侵袭和转移是一个多步骤、多阶段的复杂过程,并涉及到多种因素,但肿瘤细胞的自身运动能力是肿瘤侵袭与转移的关键环节。目前研究提示细胞骨架相关蛋白在调节细胞运动中发挥着极其重要的作用,如Arp2/3(actin related protein 2/3), WASP(Wiskott-Aldrich syndrome protein), Profilin等等。同时研究也发现这些蛋白在肿瘤组织中异常表达,如Arp2/3在结肠癌中的表达下调, WASP上调, Profilin在乳腺癌的表达下调,介导肿瘤细胞的细胞骨架重排,使得肿瘤细胞有着特殊的生物特性[3]。
血管扩张刺激磷蛋白(Vasodilator-stimulated Phosphoprotein,VASP)是Ena/VASP(Drospophila Enabled)家族中的一种肌动蛋白相关蛋白,它在调控细胞移动方面起着重要作用[4]。VASP分子量为46KD,含Ena/VASP同源1(Ena/VASP homology 1,EVH1)区域、富含Proline区域、Ena/VASP同源2(Ena/VASP homology 2,EVH2)区域三个结构部分,分别通过与Zyxin、Vinculin 、Profilin的结合,构建了粘附斑和胞内肌动蛋白的物理连接,此外,EVH2区域还直接与肌动蛋白相结合。这种特殊的空间位置提示VASP在与细胞骨架调节有关的各种细胞功能如细胞粘附、细胞移动中发挥重要作用。基于VASP调节细胞骨架的功能,以及VASP与Arp2/3、 WASP的密切关系,因此我们认为VASP可能在调控胃癌侵袭与转移中起着重要作用,目前仅有人做了VASP与肺癌的相关研究[5]。本实验首次观察胃癌组织和癌旁组织以及不同分化层次癌组织中VASP表达的差异,探讨VASP在胃癌发生、发展和浸润转移中的作用,为临床治疗胃癌提供更多实验依据。
1 材料与方法
1.1材料收集武汉大学附属中南医院2004年12月至2005年12月手术切除的胃癌标本42例,临床资料完整,术前均未行化疗放疗。胃癌42例,男30例,女12例,年龄32岁至83岁,平均(57.03±9.56)岁;组织类型均为腺癌,其中低分化腺癌23例,中分化腺癌9例,高分化腺癌10例;根据国际胃癌TNM分期标准,Ⅰ期、Ⅱ期胃腺癌16例,Ⅲ期、Ⅳ期胃腺癌26例。同时收集16例胃癌手术中切除的上下切缘作为正常胃粘膜对照。
1.2方法免疫组化检测胃癌组织及癌旁组织中VASP表达情况。按免疫强度分成四类:0分为无IR,1分为低 IR(+),2分为中等IR(++),3分为强 IR(+++)。按阳性染色细胞的比例分成4类:没有肿瘤细胞表现IR记为0分,小于33% 的肿瘤细胞表现IR记为0.33,33%~的肿瘤细胞表现IR记为0.67,大于67%的肿瘤细胞表现IR记为1分。免疫印迹指数根据评估免疫反应的强度(IR)积分以及阳性染色细胞的比例(PROP)综合判定[6]。
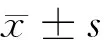
2 结 果
2.1VASP在癌旁正常胃粘膜上皮组织中的表达情况胃粘膜上皮细胞和腺上皮细胞未见阳性表达(图1a示),但发现淋巴细胞和巨噬细胞有表达(图1b示),血管平滑肌细胞及内皮细胞也有表达(图1c示)。
2.2VASP在胃腺癌组织中的表达情况可见到阳性表达,且VASP的表达水平和标本的组织分化程度、TNM分期以及淋巴结转移呈正相关(图2、表1示)(图1、2见第78页彩色图版)。

a、b、c分别为胃粘膜上皮细胞、淋巴细胞和血管平滑肌细胞图1 正常胃粘膜组织VASP表达情况(HE,×200)

a、b、c分别为高、中和低分化胃癌组织图2 胃癌组织VASP表达情况(HE,×200)

表1 VASP表达情况与患者临床特征的关系
3 讨 论
血管扩张刺激磷蛋白是一个多功能膜表面蛋白,它广泛分布于内皮细胞、血小板、淋巴细胞、血管平滑肌细胞等,定位于细胞的膜高运动性区域、粘附斑、应力纤维和leading edge处。它参与肌动蛋白丝的形成,以及在整合素-ECM介导的细胞内信号途径中发挥着重要作用。VASP参与细胞的粘附和移动。大量研究表明VASP蛋白在控制细胞移动以及调控细胞内肌动蛋白动力学发挥着普遍的作用。很多研究都表明,VASP在滋养层细胞侵袭、血管生成、细胞增殖以及成瘤化中起着重要作用[7]。
在本实验中,我们首次报道了VASP在胃组织中的空间分布和表达情况与其细胞类型不同有关。在正常胃粘膜组织中,在巨噬细胞和淋巴细胞中VASP的表达很强,这些细胞都是处于运动中的细胞,这也说明了VASP可能参与了这些细胞迁移的调控。而胃粘膜上皮细胞和腺上皮细胞都是弱至无表达,这些细胞被认为是胃癌细胞的组织来源细胞,这些都是正常胃组织中的非迁移细胞。
我们的免疫组化结果显示,VASP在胃腺癌组织比癌旁正常胃粘膜组织高表达,低分化腺癌中VASP表达高于高分化腺癌组(Plt;0.05),我们认为VASP可能在正常胃粘膜上皮细胞、胃腺细胞向肿瘤细胞转化过程中发挥着重要作用。接着我们做了胃癌不同分期以及转移情况的分析,结果显示伴有淋巴结转移的胃癌组织中VASP表达显著高于不伴有淋巴结转移组(Plt;0.01),TNM Ⅲ、Ⅳ期胃癌组织中VASP表达显著高于TNMⅠ、Ⅱ期组(Plt;0.01)。这些都说明了VASP蛋白可能通过调控腺瘤细胞和淋巴细胞的运动参与了组织侵袭转移。这也和已有报道VASP和肺癌的研究结论是一致的[5]。有报道指出抑制VASP的功能或者上调VASP的表达在野生型的NIH 3T3细胞都能导致其向肿瘤转化,这都说明了正常细胞的生长都需要VASP维持在一定范围内的,这也表明了VASP在成瘤过程中和/或者肿瘤的进展中发挥着重要作用[8]。
综上所述,我们通过研究首次报道了VASP在胃癌和癌旁组织中分布和表达的差异。胃癌中VASP的表达与标本的组织分化、TNM分期以及淋巴结转移呈正相关,这说明了VASP可能参与了胃腺癌侵袭特性的调控,其机制可能是通过调控肿瘤细胞内F肌动蛋白形成,粘附斑以及细胞的迁移来促进肿瘤细胞的迁移。另外,我们推测VASP可能参与正常胃粘膜细胞向胃癌细胞的转化。VASP可能是胃癌的一个重要调控蛋白和肿瘤进展的启动因子,可能是治疗胃癌或者阻止其恶性进展的一个重要靶分子。随着微观领域技术的发展,分析各种肿瘤模型的基因表达,可能为治疗肿瘤和鉴定特异的细胞骨架靶分子提供广阔的前景。
[1]Alberts SR, Cervantes A, van de Velde CJ. Gastric cancer: epidemiology, pathology and treatment[J].Ann Oncol,2003,14(Supp l2) :31-36.
[2]Roder DM. The epidemiology of gastric cancer[J]. GastricCancer,20025(Suppl 1):5-11.
[3]Atsushi K, Kaminishi M, Yukihiro Nakanishi,etal.Reduced expression of the insulin-induced protein 1 and P41 Arp2/3 complex genes in human gastric cancers[J]. Internal Journal of Cancer,2002,100:57-62
[4] Machesky LM. Putting on the bakes: a negative regulatory function for Ena/VASP proteins in cell migration[J]. Cell,2000,101:685-688.
[5] Dertsiz L, Ozbilim G, Kayisli Y,etal.Differential expression of VASP in normal lung tissue and lung adenocarcinomas[J]. Thorax,2005, 60:576 -581.
[6]Vandeputte DA,Trppst D, Leemstra S,etal.Expression and distribution of id helix-loop-helix proteins in human astrocytic tumors[J]. Glia,2002,38:329-338.
[7] Chen L, Daum G, Chitaley K,etal.Vasodilator-stimulated phosphoprotein regulates proliferation and growth inhibition by nitric oxide in vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol,2004, 24:1403-1408.
[8] Keyi Liu, Limin Li, Paul E,etal.Reversible Tumorigenesis Induced by Deficiency of Vasodilator-Stimulated Phosphoprotein[J]. Molecular and Cellular Biology, 1999, 22(18):3696-3703.
[编辑] 一 凡
R730.21
A
1673-1409(2009)02-R020-03
10.3969/j.issn.1673-1409(R).2009.02.006
2009-01-05
长江大学人才引进启动基金项目
彭小春(1981-),男,湖北公安人,硕士,从事细胞骨架蛋白与肿瘤的研究工作。
