Runx3基因在肝癌手术前后血浆中异常甲基化检测及临床意义
2009-11-29张海元
张海元
(长江大学医学院,湖北 荆州 434023)
Runx3基因在肝癌手术前后血浆中异常甲基化检测及临床意义
张海元
(长江大学医学院,湖北 荆州 434023)
目的:研究肝细胞癌组织及手术前后外周血浆中Runx3基因启动子区异常甲基化状态,探讨其在肝癌早期诊断及疗效评估中的价值;方法:采用DNA甲基化特异性PCR(MSP)技术分别对肝癌患者肿瘤组织及相应血浆进行Runx3异常甲基化检测。结果:在81例肝癌组织中,Runx3异常甲基化率为43.2%(35/81),相应血浆中Runx3甲基化检出率为39.5 %(32/81),血浆中Runx3基因甲基化改变与肿瘤组织甲基化状况显著相关(Plt;0.05);其中15例手术治疗患者手术前组织及血浆中Runx3甲基化检出率均为40%(6/15),术后只有1例患者血浆中Runx3基因异常甲基化。结论:血浆Runx3基因异常甲基化检测在肝细胞癌早期诊断及疗效评估方面有一定应用价值。
肝细胞癌;Runx3基因;甲基化;手术; 血浆
原发性肝细胞癌(HCC)是常见的恶性肿瘤,早期发现、早期诊断对于肝癌的治疗和预后意义重大。DNA甲基化改变发生在肿瘤形成的早期阶段,许多抑癌基因启动子区域的异常甲基化,能促进肿瘤发生,导致恶性表型[1],因此抑癌基因甲基化异常有可能成为癌变的早期检测指标[2]。Runx3(runt相关转录因子3)是一种新发现的定位于染色体1p36.1[3]的抑癌基因,其表达异常与人类多种消化道肿瘤的发生密切相关,据Xiao等[4]发现48.3%(30/62)的肝细胞癌组织中Runx3基因有高度甲基化。由于血浆甲基化总是与肿瘤细胞内抑癌基因甲基化同时出现[5],为此,本研究采用敏感的甲基化特异性PCR(MSP)方法研究肝细胞癌组织及手术前后血浆中Runx3甲基化状态,探讨血液检测Runx3甲基化改变在肝癌患者早期诊断上的意义,为肝癌患者治疗方案选择及疗效评估提供新的思路。
1 材料与方法
1.1标本来源肝细胞癌组织81例及相对应的癌旁正常组织取自湖北省肿瘤医院和鄂州市中心医院肿瘤科2005年2月至2007年5月手术切除标本,所选取的肝细胞癌患者术前均未实施放疗或化疗。同时收集术前外周血浆以及其中15例患者的术后第14~21d的外周血浆,-80℃储存。
1.2方法
1.2.1基因组DNA提取 ①组织DNA的提取:以酚-氯仿抽提法提取组织DNA,经紫外定量后于-20℃保存。②血浆中DNA的提取:参考文献[6]取3.0ml血浆,加入约10ml DNA缓冲抽提液(140mmol/L Tris, 140mmol/L EDTA, 0.5% SDS),加入蛋白酶K至终浓度为100μg/ml, 放入37℃水浴振荡过夜,然后用酚-氯仿抽提法提取DNA。
1.2.2亚硫酸氢钠处理基因组DNA 参照甲基化特异性PCR方法[7]用亚硫酸氢钠处理基因组DNA,用2.5倍体积预冷无水乙醇和2μl糖原(5mg/ml)沉淀DNA, -40℃过夜,然后用70%乙醇洗涤沉淀2次,干燥后用30μl TE或去离子水溶解,-40℃保存备用。
1.2.3甲基化PCR(MSP) 设计两对Runx3基因的甲基化引物和非甲基化引物(见表1)。总体积为30μl的反应液中含有DNA 5μl, 10×缓冲液3μl, 氯化镁 2.5mmol/L,引物0.5μmol/L, dNTP 250μmol/L, Hotstar Taq 0.5μl。MSP反应条件:95℃ 15min, 95℃ 30s, 60℃ 30s, 72℃ 30s,35个循环,72℃ 10min。

表1 Runx3基因引物设计
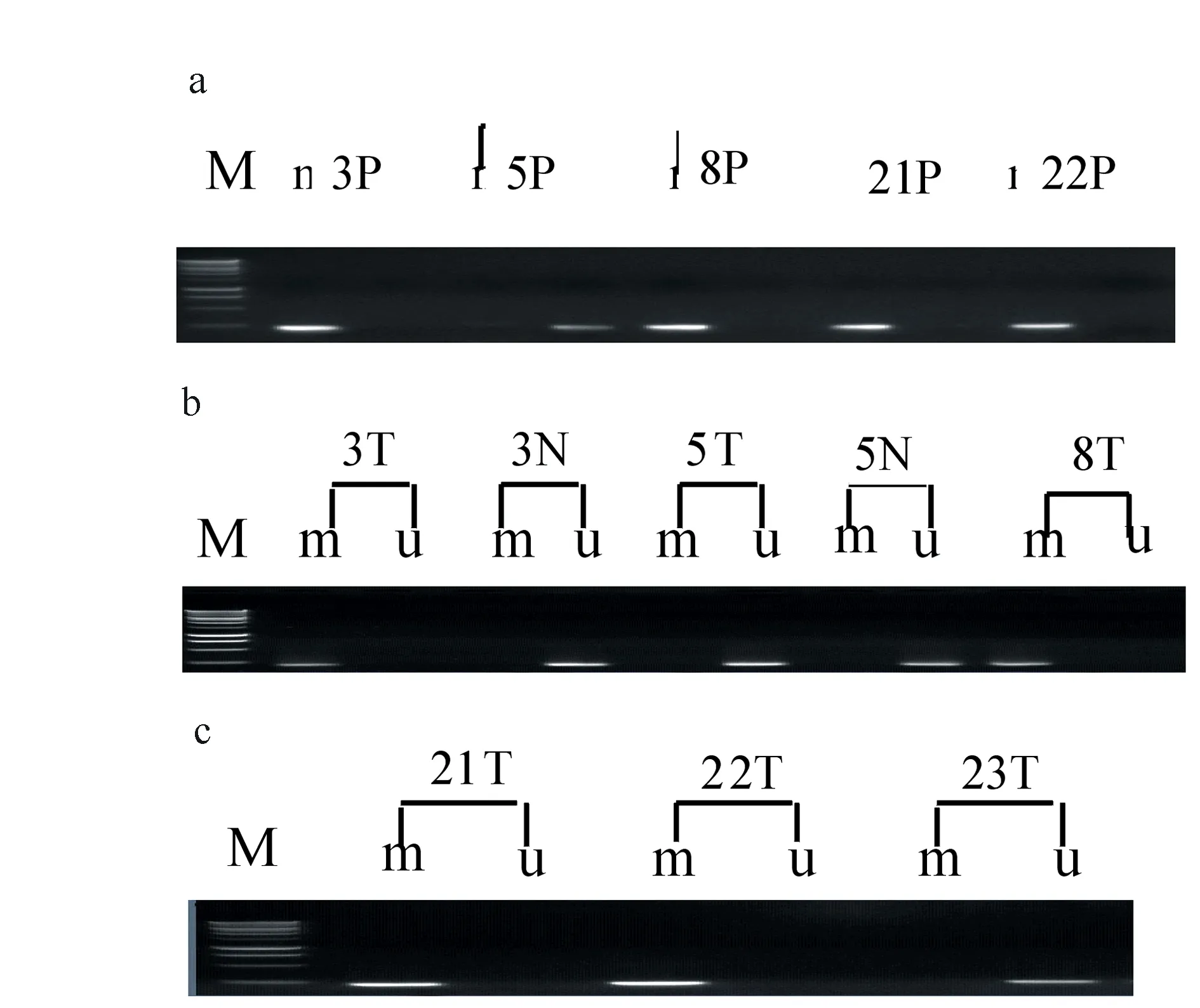
M:250bp梯度标准DNA分子量;m:甲基化;u:未甲基化;P:患者血浆;N:癌旁正常组织;T:肝癌组织;图1 MSP法检测肝细胞癌患者肿瘤组织及血浆中Runx3甲基化状态
1.3统计学处理以χ2检验分析MSP方法检测到的组织与血浆中Runx3基因甲基化效率,并对Runx3基因甲基化情况与肿瘤临床分级、血管侵润等临床病理参数的相关性进行分析。统计学处理均采用SPSS11.5软件完成。Plt;0.05为差异有统计学意义。
2 结 果
2.1肝细胞癌患者肿瘤组织及血浆中Runx3甲基化状态本研究采用MSP方法检测了81例肝细胞肝癌患者癌组织、癌旁正常组织及其相对应的血浆Runx3甲基化状况(典型图片分别见图1A、图1B、图1C)。在癌旁正常组织中,Runx3基因启动子区域未发现异常甲基化现象,而在肝细胞癌组织中,Runx3基因启动子区域甲基化率占43.2 %(35/81),在相对应的肝细胞癌患者血浆中,Runx3基因启动子区域甲基化率占39.5 %(32/81)。分析81例肝细胞癌患者血浆与肿瘤组织中Runx3甲基化状态(见表2),发现血浆中Runx3甲基化改变与肿瘤组织甲基化状况显著相关(Plt;0.05)。

表2 肝细胞癌患者血浆与肿瘤组织中Runx3异常甲基化检测结果 例
2.2Runx3甲基化状况和临床病理参数的关系分析肝细胞癌患者血浆与肿瘤组织中Runx3甲基化状况和临床病理参数的关系(见表3)。在肝细胞癌患者血浆及肿瘤组织中,Runx3甲基化频率与患者年龄、肿瘤分级分期、肿瘤大小等病理参数无显著相关性(Pgt;0.05)。
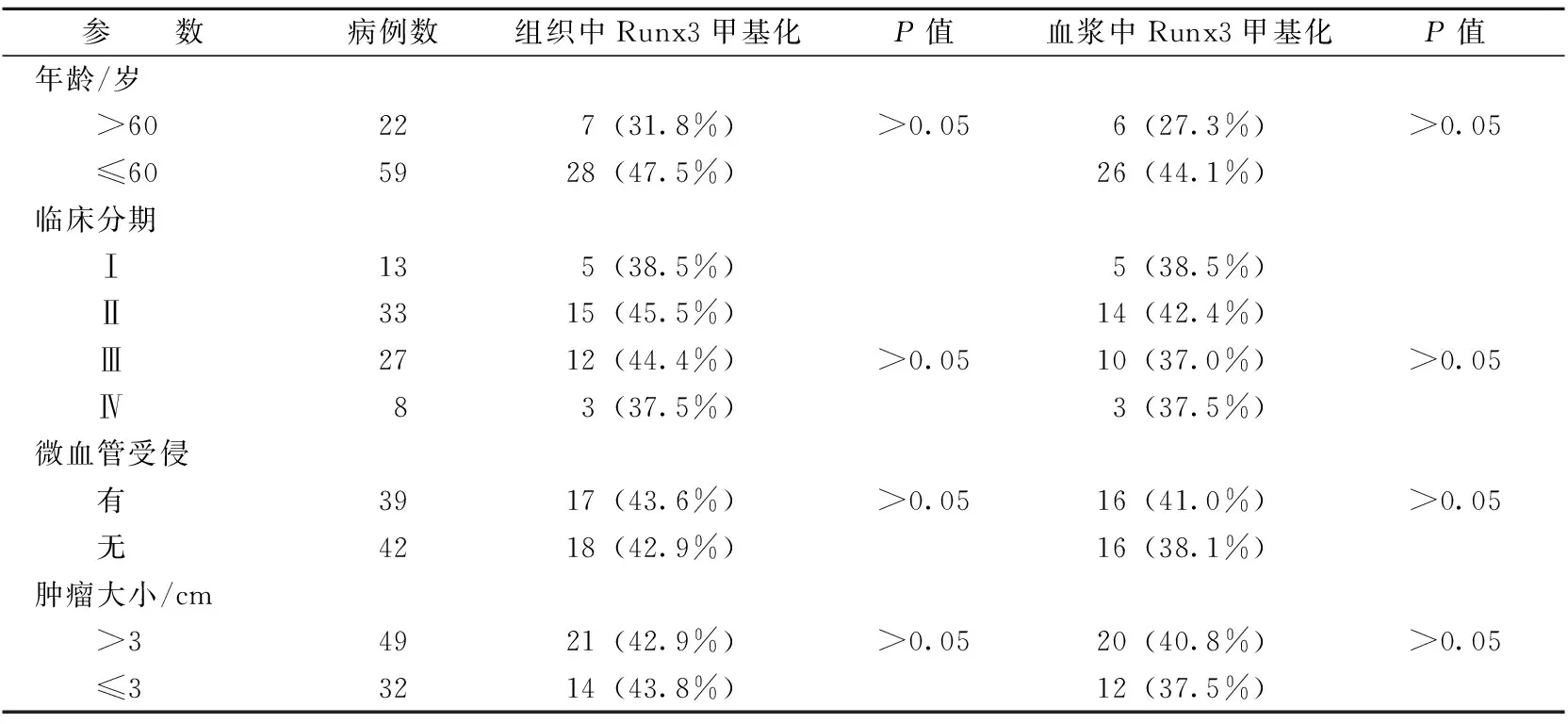
表3 肝细胞癌组织和血浆中Runx3基因启动子区域甲基化状态与临床病理参数的关系
2.3手术前后血浆中Runx3基因异常甲基化状况15例有成对手术前后血浆标本的肝癌根治手术患者中,检出6例患者的肿瘤组织及相应的术前血浆存在Runx3基因启动子区域异常甲基化,术前血浆Runx3异常甲基化状态与肿瘤组织标本保持一致,甲基化率为40%(6/15);术后第10~14d外周血浆中只有1例存在Runx3异常甲基化,另外5例转阴。
3 讨 论
Runx3基因是哺乳动物中Runx家族的进化基础,为新近克隆的一种候选抑癌基因[8],是TGF-β信号传导通路的一个重要环节。据Song等[9]报道,原发性肝癌存在着严重的TGF-β信号转导障碍,这说明Runx3基因可能在肝细胞肝癌的发生发展过程中是关键性的肿瘤抑制基因,其功能失活可导致TGF-β/SMADS信号通路削弱。许多研究表明,Runx3基因在胃癌、结肠癌等人类多种肿瘤中存在启动子区域甲基化异常[3,10,11],在肝癌中也有报道[4],这是抑癌基因Runx3失活的主要机制。
本研究采用甲基化特异性PCR方法检测了81例肝细胞癌组织及手术前后血浆中Runx3基因启动子区域甲基化状态,研究结果显示,肝癌组织中Runx3异常甲基化率占43.2 %(35/81),而相应血浆中异常甲基化率占39.5 %(32/81),血浆与相应肝癌组织相比仅有3例标本未检出Runx3基因异常甲基化,可能是由于肿瘤组织细胞尚无凋亡、坏死脱落或血液循环中来自肝细胞癌的肿瘤细胞量太少而低于MSP检测范围。在肝细胞癌的肿瘤组织Runx3基因甲基化阴性的病例中,在相应的血浆中均未检测到Runx3基因甲基化异常现象,这可说明血浆和肿瘤组织之间Runx3基因甲基化检出率存在良好的相关性,利用MSP方法检测肝细胞癌血浆及肿瘤组织中Runx3基因启动子区域异常甲基化具有良好的特异性。在15例有成对手术前后血浆标本肝癌根治手术患者中,有6例患者的肿瘤组织和血浆中检测出Runx3异常甲基化,而其中5例患者术后血浆中甲基化转阴,此期间手术是唯一的影响因素,因此可认为Runx3基因异常甲基化改变是手术造成的。
本研究有潜在重要的临床应用价值。由于肝细胞癌患者血浆样本易于获得,取样过程简单方便,极大减轻了患者身心负荷和经济压力,而且检测方法基于甲基化特异性PCR技术,利用患者血浆检测肝细胞癌Runx3基因异常甲基化的灵敏度可达91.4%(32/35),特异性为100%,因此在理论上特异性要优于其它方案的外周血核酸标记的检测,使之有良好的应用前景[12]。肝癌根治手术后第14~21天,术前检测有血浆Runx3异常甲基化的患者大部分可以转阴,未转阴的病例多疑有肿瘤残存,对这部分病例可继续监测与随访,因此血浆Runx3异常甲基化检测可以很好的对手术等治疗方案的疗效进行评估。肝细胞癌患者组织内发生异常甲基化的DNA可不断释放到外周血循环,并且在血循环中长期存在,由于血清甲基化总是与肿瘤组织甲基化同时出现[5],故血清中Runx3基因异常甲基化的检测为筛选肝细胞癌患者中新的标志物提供了新思路。
[1] Jones PA,Baylin SB. The fundmetal role of epigenetic events in cancer[J]. Nat Rev Genet,2002,3:415-428.
[2] Kang GH,Shim YH,Jung HY,etal.CpG island methylation in premalignant stages of gastric carcinoma [J]. Cancer Res,2001,61:2847-2851.
[3] Li QL,Ito K,Sakakura C,etal.Causal Relationship between the loss of Runx3 Expression and Gastric Cancer[J]. Cell,2002,109:113-124.
[4] Xiao WH,Liu WW. Hemizygous deletion and hypermethylation of RUNX3 gene in hepatocellular carcinoma[J]. World J Gastroenterol,2004,10(3):376-380.
[5] Lee TL,Leung WK,Chan MW,etal.Detection of gene promoter hypermethylation in the tumor and serum of patients with gastric carcinoma[J]. Clin Cancer Res,2002,8(6):1761-1766.
[6] Grady WM,Rajput A,Lutterbaugh JD,etal.Detection of aberrantly methylated hMLH1 promoter DNA in the serum of patients with microsatellite unstable colon cancer[J]. Cancer Res,2001,61(3):900-902.
[7] James G,Heman,Jeremy R,etal.Methylation-specific PCR : A novel PCR assay for methylation status of CpG islands[J]. Proc Natl Acad Sci USA,1996,93:9821-9826.
[8] Bae SC,Takahashi E,Zhang YW,etal.Cloning,,mapping and expression of PEBP2 alpha C,a third gene encoding the mammalian Runt domain[J]. Gene,1995,159:245-248.
[9] Song BC,Chung YH,Kin JA,etal.Transforming growth factor-betal as a useful serologic marker of small hepatocellular carcinoma[J]. Cancer ,2002,94(1):175-180.
[10] Ku JL,Kang SB,Shin YK,etal.Promoter hypermethylation downregulates RUNX3 gene expression in colorectal cancer cell lines[J]. Oncogene,2004,23(40):6736-6742.
[11]张海元,何小兵,夏鹏.胃肠道恶性肿瘤中Runx3基因甲基化研究[J].长江大学学报(自然科学版)医学卷,2008,5(3):9-13.
[12] Tan SH,Ida Hiroshi,Lau QC,etal.Detection of promoter hypermethylation in serum samples of cancer patients by methylation-specific polymerase chain reaction for tumour suppressor genes including RUNX3[J]. Oncology Reports,2007,18:1225-1230.
[编辑] 一 凡
R735.7
A
1673-1409(2009)02-R013-03
10.3969/j.issn.1673-1409(R).2009.02.004
2009-05-29
湖北省教育厅中青年项目(Q20091207)
张海元(1974-),男,湖北鄂州人,讲师,硕士,从事肿瘤分子生物学教学与研究工作。
