mIκBα表达载体在大鼠肝星状细胞中的稳定表达
2009-11-29杨友谊邹伟敏
杨友谊 邹伟敏
(湖北中医药高等专科学校,湖北 荆州 434020) (荆州区东城社区卫生服务中心,湖北 荆州 434020)
mIκBα表达载体在大鼠肝星状细胞中的稳定表达
杨友谊 邹伟敏
(湖北中医药高等专科学校,湖北 荆州 434020) (荆州区东城社区卫生服务中心,湖北 荆州 434020)
目的:探讨将mIκBα基因成功转染入大鼠肝星状细胞,并在其中稳定表达。方法:应用脂质体介导的基因转移技术将mIκBα基因真核表达载体pCMX-mIκBα导入大鼠肝星状细胞中,采用G418筛选途径得到稳定转染的大鼠肝星状细胞,再通过Western blot技术检测转染后大鼠肝形状细胞中相应mIκBα蛋白表达水平。结果:稳定转染的大鼠肝星状细胞中证实有pCMX-mIκBα相应蛋白质的表达。结论:mIκBα基因真核表达载体pCMX-mIκBα成功转入大鼠肝星状细胞,并在细胞中得到稳定表达,为进一步研究NFκB和肝星状细胞凋亡之间的关系,并为通过诱导肝星状细胞凋亡治疗肝纤维化寻找实验及理论基础。
肝星状细胞;核转录因子突变体;稳定转染
核转录因子NF-κB/IκB系统因其在机体各生物过程的调控中所起的重要作用已越来越引起人们的广泛重视。NF-κB能调控细胞在应急、感染、炎症等情况下的基因表达。参与细胞增殖、凋亡及细胞免疫反应的调控。最引人注目的是,它在肿瘤细胞的抗凋亡机制中起着关键作用。IκBα是NF-κB最重要的调控因子。静息状态下,NF-κB与IκBα相结合而存在于细胞浆中,当受到外界因素刺激时,IκBα被磷酸化并迅速降解,使NF-κB释放并活化而进入细胞核,从而调控一系列基因的表达。研究表明,第32和第36位丝氨酸在IκBα的降解中起着至关重要的作用,S32、S36发生突变的mIκBα不会被降解,与NF-κB发生不可逆结合而抑制其激活。这种现象的发现使人们可能找到了一条调控NF-κB活性进而调控一系列生物学过程的有效方法。本实验旨在通过转染技术把mIκBα导入大鼠肝星状细胞中,并筛选获得mIκBα稳定表达株。
1 材料与方法
1.1材料
1.1.1动物 SD大鼠由华中科技大学同济医学院实验动物中心提供,体质量200~350g。
1.1.2试剂与仪器 DMEM培养基(Gibco-BRL公司产品)、G418(Gibco-BRL公司产品)、大量质粒制备试剂盒(Wazard大量DNA纯化系统为Promega公司产品)、脂质体转染试剂盒(Lipofectamine2000为Invitrogene公司产品)、LB培养基、限制性内切酶BamH Ⅰ HindⅢ TaqDNA聚合酶 T4DNA连接酶(均为MBI公司产品)、markerⅣ(天根生化科技有限公司)、1mol/L CaCl2。E.coli(DH5)(宝生物工程大连有限公司)。mIκBα基因真核表达载体:pCMX-mIκBα(Santa Cruz公司)。
二氧化碳培养箱(Forma Scientific 公司)、超净工作台(苏州净化设备公司)、台式高速低温离心机(GS-15R美国Beckman公司)、基因扩增仪(PE9600美国PE公司)、紫外可见分光光度计(DU650美国Beckman公司)。
1.2方法
1.2.1肝星状细胞分离培养 SD大鼠,采用肝离体胶原酶和链霉蛋白酶灌注消化,50g低速离心去除肝细胞,密度梯度分离HSC,采用台盼蓝染色排斥法鉴定细胞活率,Desimin加α-SMA免疫细胞化学染色法鉴定HSC纯度。取上述方法获得的大鼠HSC采用含10%胎牛血清的DMEM培养基在37℃、5%
CO2环境中体外传代培养。
1.2.2质粒的制备 感受态细胞的制备: 取-70℃存储的大肠杆菌JM103菌种,用白金丝接种环直接蘸取菌液。在LB琼脂平板(不含抗菌素)上划线,37℃培养过夜;从平板上挑取一个单菌落,接入含2mlLB培养基的试管中,37℃振荡培养过夜;取0.2ml上述菌液,转入含30ml LB培养基的三角瓶中,37℃振荡培养2.5h;将培养物转入40ml的离心管中,置冰上10min,然后于2 500r/min、4℃离心10min;弃上清,将细菌重新悬浮于100mmol/L氯化钙25ml中,冰浴20min后,2 500r/min、4℃离心10min;弃上清,将细菌重新悬浮于1ml 100mmol/L氯化钙中过夜。
转化:取5μl连接产物加至100μl感受态细胞中,水浴30min,转入42℃热休克60~90s,立即置于冰上2min;加入800μl LB(Amp-)培养液,37℃ 2 000rpm振摇60min,去20μl菌液于事先制备好的Amp+ LB平板上,用无菌玻璃棒将溶液均匀涂布与整个平皿表面,置37℃温育过夜。
重组体的筛选和鉴定:挑取单菌落接种到3ml含氨苄青霉素(50μl/ml)的LB培养基中;37℃振摇过夜(12~16h),离心收集细菌;加入溶液Ⅰ100μl(50mmol/L葡萄糖、25mmol/L Tris-HCl pH8.0、10mmol/L EDTA pH8.0),混匀,室温放置5min;加200μl新鲜配制的溶液Ⅱ(1%SDS,0.2mol/L NaOH),颠倒混匀,冰浴5min;加150μl的溶液Ⅲ(3mmol/L Kac,2mmol/L Hac,pH4.8),颠倒混匀,冰浴10min;15 000rpm离心5min;上清液用酚/氯仿和氯仿各抽提一次;取上层水相加入2倍体积的无水乙醇,5 000rpm离心15min;弃上清,沉淀于室温干燥后,溶于20μl TE中,储存于-20℃备用。
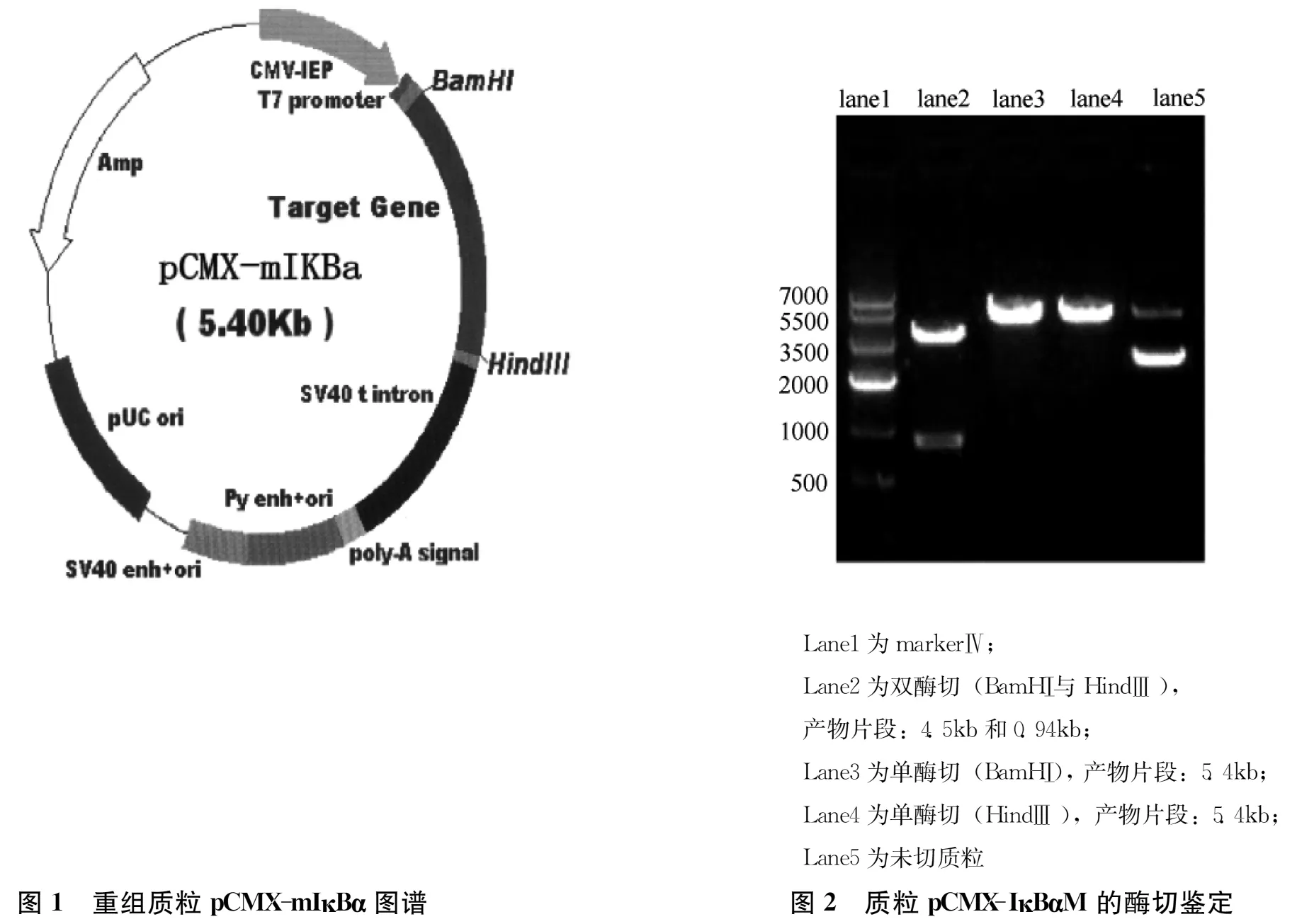
质粒内切酶分析鉴定:内切酶分析参照说明书进行,依次在EP管中加入质粒DNA、10×缓冲液、内切酶BamHⅠ与BamHⅢ,用灭菌去离子水补至总体积20μl,37℃水浴2~3h,然后加样于1%琼脂凝胶进行电泳,紫外灯下观察结果。
1.2.3基因转染 收获处于对数生长期的大鼠肝星状细胞,以5×104个细胞/孔转种于12孔的培养基中,37℃、5%CO2环境中培养24h,细胞长至80%融合;弃去细胞培养基,并用无血清DMEM培养基洗涤细胞两次备转染用;每孔细胞加入200μl溶液Ⅲ,前后轻微摇晃培养板,并同时用Puc119空质粒作阴性对照;37℃、5%CO2环境中培养6h后加入1 000μl含10%胎牛血清的DMEM培养基,不弃去转染液。
1.2.4G418筛选 转染后经24h,待细胞生长接近完全融合时以1:10密度传代于含300μg/ml G418的筛选培养基中继续培养,同时用不加转染液的细胞作为对照;当对照组细胞大部分死亡时,更换一次筛选培养基,G418浓度降低至150μg/ml以维持筛选用,继续培养;约3~4周后,可见抗性克隆形成,待其逐渐增大后,逐一转入50ml培养瓶中培养。
1.2.5mIκBα蛋白的检测(Western blot) 细胞蛋白质提取:选用生长良好的细胞,用预冷至4℃的PBS缓冲液漂洗细胞2次,弃去洗液并吸取残余的PBS液体,加入0.5ml裂解缓冲液置于冰上作用20min,用细胞刮棒将细胞集中于平皿的一侧,并用吸管把细胞碎片连同裂解缓冲液一起转移至经过冷却的EP管内,于4℃以12 000g将裂解物离心2min,将上清液转移至另一EP管内,并在-70℃中保存。
PAGE电泳:配制1%的琼脂糖凝胶;组装灌胶模具及电泳槽,准备电泳装置,并用琼脂糖凝胶封边;配制8%的分离用聚丙烯酰胺变性胶,在加入过硫酸胺和TEMED后,轻轻搅拌混匀,勿使凝胶聚合;小心用吸管将凝胶加入灌胶模具内,至距梳齿约0.5cm,并避免产生气泡,然后在分离胶上面加入一层约5mm厚的水层以隔绝空气的接触,直立置于室温下20~60min,直至凝胶聚合。在凝胶聚合后,会在分离胶和水层之间出现一个清晰的折光线;吸尽分离胶上的水,将梳子置于分离胶上,直至梳齿远端距分离胶约0.5cm;配制积层胶溶液,同样在加入过硫酸胺和TEMED后,轻轻搅拌混匀,勿使凝胶聚合;用注射器将积层胶缓慢加入分离胶表面,注意不能产生气泡,时温下静置20~30min,直至凝胶聚合。小心拔除梳子,不要将加样孔撕裂;反复用电泳液冲洗加样孔数次。以去除残留的未聚合的丙烯酰胺及其它污物,然后将电泳缓冲液加入电泳槽中,短板接正极;将蛋白质样品(0.1μg/10μl)与5×SDS凝胶上样缓冲液(1∶5 v/v)充分在一个EP管中混匀后,置于沸水浴中变性10min,稍作离心;用微量注射器将样品加入加样孔中,注意不能带入气泡,并使样品不溢出;接通电源,短板对正极,保持恒压为200V(注意调整电流,开始为100mA,电泳快结束时为60mA),电泳持续约60min,且电泳在4℃下完成;通过肉眼观察,当溴酚蓝电泳至距离电泳槽底部约2~3cm时,关闭电源,停止电泳;从电泳槽中取出凝胶玻璃板,取出凝胶。
转膜:转移缓冲液及双蒸馏水等均置于4℃低温预处理;将硝酸纤维素浸泡在转移缓冲液中20min,勿用手指直接接触硝酸纤维素膜,打开转移盒,用转移缓冲液将海绵垫及Whatman滤纸完全浸透,将滤纸剪成与待转移的凝胶大小一致。勿用手指直接接触滤纸;小心将凝胶置于三层Whatman滤纸上,避免产生气泡,以转移缓冲液湿润胶面,小心从凝胶的一边开始将硝酸纤维素膜放在胶面上,避免气泡形成,并勿用手指直接接触,然后在硝酸纤维素膜表面放三层Whatman滤纸,用干净的小试管轻轻滚过滤纸-凝胶-硝酸纤维膜-滤纸“三明治”上,以消除可能存在的所有气泡,然后将他们置于转移盒中;将转移盒置于电转移装置中,阳极对硝酸纤维膜一侧,连接好电极,使与SDS相结合而带负电荷的蛋白质向正极泳动,在恒温状态下以200mA转移60~120min,整个转移过程置于4℃低温环境中进行。
免疫显色及结果分析: 终止电转移,拆下转移装置,将滤纸揭下;将膜置于3%BSA/TBS溶液中,液面超过膜,在摇床上缓摇30~80min,保证充分封闭非特异性位点;弃去封闭液,用TBS洗膜三次;一抗反应:用0.5%BSA/TBS按1∶500稀释一抗,将膜与一抗溶液置于封闭的塑料袋中在37℃下充分孵育,同时温和摇动至少1h;洗膜:弃去一抗,用TBS洗膜三次,每次10min;二抗反应:弃去TBS,用0.5%BSA/TBS按1∶200稀释二抗,将膜同上置于二抗溶液中,温和摇动至少1h或过夜;洗膜:弃去二抗,用TBS洗膜三次,每次10min;显色:配好NBT/BCIP显色液后,在肉眼观察下进行兰色显色反应,用双蒸馏水终止显色反应。
2 结 果
2.1质粒的鉴定重组质粒pCMX-mIκBα图谱如图1,质粒DNA经BamHⅠ与HindⅢ酶切后产物经琼脂凝胶电泳显示2条带:分别为4.5、0.94kb,大小符合预期,见图2。
2.2Westernblot分析mIκBα蛋白在大鼠HSC中的表达转染pCMX-IκBαM的大鼠HSC内IκBα基因表达高于未转染组HSC,见图3。
3 讨 论

A为转染组;B为大鼠肝细胞图3 Western blot分析IκBαM蛋白在大鼠HSC中的表达
细胞在静息状态下,NFκB以无活性的潜在状态存在于细胞浆中,它与一种抑制因子结合组成为一异源多聚体P50-P60-IκBα或IκBβ。三聚体中IκB类抑制因子的存在可阻遏P50-P60复合物的二聚体化,因此丧失活性。当细胞受到肿瘤坏死因子(TNF)、蛋白酶C激活物PMA等NFκB激活剂刺激时,IκB即从三聚体中解离出来,暴露出P50亚基上的易位信号和P60亚基上DNA结合位点,从而使异二聚物表现出NFκB活性,并从细胞质中易位到细胞核中,与IκB基因序列相结合,从而发挥转录调控作用[1,2]。全部IκB蛋白均含有一个与NFκB连接的中心区,该区域由6个或更多的保守的锚蛋白重复构成。另外IκB的C端区对其抑制活性至关重要的,而N端含有一个调控结构域[3]。诱导型IκB降解依赖于刺激诱导的N端调控区2个保守的丝氨酸磷酸化,在IκBα对应的位点是S32和S36。IKK(IκB激酶)复合体经由上游激活物与IKKγ(IκB激酶调控亚基)相互作用而活化,并导致结合NFκB的IκB磷酸化及降解,使IκBα迅速被26S蛋白酶体降解。Wang等[4]发现NFκB的抑制剂IκB的32位和36位蛋白残基发生突变,即mIκBα,其失去磷酸化位点从而使IκB无法被降解而能够持续地抑制NFκB活性。
通过mIκBα基因的转入来抑制NFκB的活性从而达到诱导细胞凋亡的目的,目前主要应用于肿瘤细胞的基因治疗方面。Sumitomo等[5]构建了IκBα基因N端截短突变的腺病毒重组体,并将它转入一个分泌多种细胞因子的膀胱癌细胞系KU-19-19细胞中,发现这个腺病毒重组体能有效感染该细胞系并持续表达对NFκB的抑制作用,且不会被磷酸化及水解,并能抑制KU-19-19细胞的生长及其细胞因子的产生。最有意义的是,发现这个腺病毒重组体的感染可以直接导致肿瘤细胞的凋亡,而癌旁正常细胞则未见明显损伤。另外,Chen等[6]构建了一种叫Adv-SR-IκBα的NFκB超级抑制物,将这种抑制物感染口腔磷状细胞癌细胞(SCC)并表达后发现,该抑制物不但能抑制TNF-α诱导的NFκB激活,还能增强TNF-α诱导的Caspase-8和Caspase-3的激活。mIκBα经腺病毒介导转入耐受化疗药物的小鼠体内肿瘤细胞中,能诱导肿瘤细胞对TNF-α或化疗药物致敏而发生凋亡,瘤体萎缩[7]。Duffey等[8]将mIκBα基因转入表达前细胞因子IL-1、IL-6、IL-8和GM-CSF的头颈部鳞状上皮细胞癌细胞中,发现mIκBα能使该细胞大量凋亡。而且NFκB基本活性和TNF-α诱导后的激活活性均明显被抑制,同时上述4种因子的产生亦受到抑制。随后将此癌细胞接种到SCID小鼠体内做类似研究也得到相似结果,由此表明,mIκBα基因的表达可以抑制肿瘤细胞在体内的生长。
本实验主要研究mIκBα表达对大鼠肝星状细胞凋亡的作用。首先,通过脂质介导mIκBα基因进入大鼠肝星状细胞中:mIκBα真核表达载体pCMXMIκBα是以pCMX质粒为基本载体,在其中插入mIκBα基因完整编码序列构成的。转染方法上,本实验选用了脂质介导的转染方法,其有效率是先前磷酸钙沉淀法的5~10倍,且使用方便,并采用了第三代脂质体Lipofectiamine2000,它的转染能力较第一代脂质体增强了2~30倍,对真核细胞转染效率尤其高。转染后经G418筛选稳定转染的表达株,然后应用Western blot技术作mIκBα相应蛋白质表达的检测。
本研究将mIκBα基因成功导入大鼠肝星状细胞,并获得了高效、稳定表达mIκBα的大鼠肝星状细胞,为进一步从体外、体内两个层面探讨mIκBα对大鼠肝星状细胞凋亡的作用打下良好的实验基础。
[1]Ghosh S, May MJ, Kopp EB. NF-kappa B and rel proteins:Evalutionarily conserved mediators of immune responses[J].Annu Rev Immunol,1998,16:225-260.
[2]Arenzana-Seisdedos F, Turpin P, Rodriguez M,etal.Nuclear localization of I kappa B alpha promotes active transport of NF-kappa B from the nucleus to the cytoplasm[J].J Cell Sci,1997,110(3):369-378.
[3]Baldwin AS. The NF-kappaB proteins:New discoveries and insights[J].Annu RevImmunol,1996,14:649-683.
[4]Wang CY, Mayo MW, Baldwin AS,etal.TNF-and cancer therapy-induced apoptosis:Potentiation by inhibition of NF-kappa B[J].Science,1996,274:784-787.
[5]Sumitomo M, Tachibana M, Ozu C,etal.Induction of apoptosis of cytokine producing bladder cancer cells by adenovirus medicated I kappa B alpha over expression[J].Hum Gene Ther,2002,10(12):37247.
[6]Chen S, Fribley A, Wang CY. Potentiation of tumor necrosis factor-mediated apoptosis of oral squamous cell carcinoma cells by adenovirus-mediated gene transfer of NF-kappa B inhibitor[J].J Dent Res,2003,81(2):98-102.
[7]Baldwin AS,Control Bancroft CV, Chen Z,etal.Inhibition of transcription factor nuclear factor-kappa B inhibitor[J].J ClinInvest,2004,107(3):241-246.
[8]Duffey DC, Crowl Bancroft CV, Chen Z,etal.Inhibition of transcription factor nuclear factor-kappa B by a mutant inhibitor-kappa B alpha attenuates resistance of human head and neck squanous cell carcinoma to TNF-alpha caspase-mediated cell death[J].Br J Cancer,2005,83(10):1367-1374.
[9]Kagami S, Urushihara M, Kitamura A,etal.PDGF-BB enhances alpha1 beta1 integrin-mediated activation of the Erk/AP-1 pathway involved in collage matrix remodeling by rat mesangial cells[J].J Cell Physiol,2004,198:470-478.
[10]高春芳,卢伦根.纤维化疾病的基础和临床[M].上海:上海科技出版社,2004:199-201.
[11]Higashi K, Inagaki Y.Transcriptional repression of human alpha2(I)collage gene expression by interferon-gamma[J].J Biol Chem, 2003,278:5156-5162.
[12]Cutroneo KR, Chiu JF. Sense Oligonucleotide competition for gene promoter binding and activation[J].Int J Biochem Cell Biol,2003,35:32-38.
[13]Campbell MR, Gress CJ.Chicken collagen X regulatory sequences restrict transgene expression to hypertrophic cartilage in mice[J].Am J Pathol,2004,164:487-499.
[编辑] 一 凡
R34
A
1673-1409(2009)02-R009-04
10.3969/j.issn.1673-1409(R).2009.02.003
2009-01-08
杨友谊(1964-),男,湖北仙桃人,副教授,硕士,从事生物化学和分子生物学教学与研究工作。
