应用光学成像监测肿瘤治疗及抗微生物感染的实时过程
2009-11-29熊涛
熊 涛
(长江大学生命科学学院,湖北 荆州 434025;华中科技大学生命科学与技术学院,湖北 武汉 430074)
应用光学成像监测肿瘤治疗及抗微生物感染的实时过程
熊 涛
(长江大学生命科学学院,湖北 荆州 434025;华中科技大学生命科学与技术学院,湖北 武汉 430074)
目的:探讨光学成像技术与基因标记技术结合的非侵入性在体分子荧光成像实时监测肿瘤治疗和抗微生物感染的过程。方法:利用绿色荧光蛋白(GFP)转染人涎腺癌细胞ACC-M,建立GFP标记肿瘤皮下肿瘤生长治疗模型,并对模型进行整体荧光成像的初步研究;同时也进行表达红色荧光蛋白(DsRed2)细菌的腹部感染及治疗模型的光学成像。结果:单克隆ACC-M-GFP细胞稳定高水平表达GFP。2只成瘤裸鼠右上侧皮下肿瘤随时间推移,荧光区域面积逐渐增加,在瘤内注射后荧光区域面积略变小。注射大肠杆菌12h后感染已有扩散发生,36h时荧光扩散至整个腹部,在48h后裸鼠死亡;同时注射卡那霉素者在12h时仅少许扩散,在36h时荧光没有扩散并且荧光强度减弱,在 48h后荧光基本上已探测不到,裸鼠存活。结论:光学成像可以从时间上和空间上反映肿瘤生长及细菌消长的全过程,因而这两种模型同在体光学成像的结合为研究肿瘤治疗药物和抗生素筛选提供了一种研究平台。
绿色荧光蛋白(GFP);红色荧光蛋白(DsRed2);肿瘤;细菌;光学成像
荧光基因标记技术和光子学技术的迅速发展,使得光学成像技术可以实现肿瘤病理生理动力学过程的在体研究,其中涉及基因表达,血管生成,细胞粘附与迁移,组织间隙和淋巴中的物质传输,代谢微环境与药物传送等[1,2],特别是自从绿色荧光蛋白(Green Fluorescent Protein,GFP)的出现,光学成像广泛应用于生物医学的各个领域[3]。基于GFP的在体荧光成像可揭示肿瘤发生发展的细胞和分子机制,非侵入性在体评价抗肿瘤药物疗效[4]。早期GFP标记肿瘤研究采用终点分析[5,6](end-point assay)方法检测肿瘤转移灶,但该方法不能实时记录肿瘤转移过程。Yang等[7,8]首先利用整体光学成像系统对表达GFP的肿瘤实时非侵入荧光成像,记录了肿瘤转移过程;同时Zhao等[9]也利用整体光学成像系统对基于GFP微生物感染及治疗进行了实时监测。在体光学成像作为一种非侵入的外部成像技术,对于软组织和骨转移癌检测具有非常灵敏和快速的特点[8]。
为了能够为肿瘤治疗药物和抗生素的筛选搭建一个很好的平台,本研究利用GFP转染人涎腺癌细胞ACC-M,建立了GFP标记肿瘤的皮下肿瘤生长治疗模型,并对模型动物进行了整体荧光成像初步研究;同时进行了表达红色荧光蛋白(Discosoma sp.Red Fluorescent Protein, DsRed)细菌的腹部感染及治疗模型的光学成像。
1 材料与方法
1.1材料
1.1.1试剂和仪器 人涎腺癌细胞系ACC-M由武汉大学中国典型培养物保藏中心提供,DMEM(Gibco,USA),新生小牛血清(杭州四季青公司),pEGFP-C1和pDsRed2(Clontech,USA),FuGENE 6(Roche, Switzerland),G418(Promega, USA)。IX70倒置荧光显微镜(Olympus,Japan),致冷电荷耦合器件(Charge Coupled Device,CCD,Princeton Instruments,USA)。
1.1.2实验动物 BALB/c nu/nu裸鼠由湖北省防疫站实验动物中心提供,鼠龄为4~5周,体质量15~20g,在本实验室无特定病原体(specific-pathogen free,SPF)的裸鼠间饲养。动物饲养和实验严格按照中华人民共和国《实验动物管理条例》要求进行。
1.2方法
1.2.1细胞和细菌培养 用含10%小牛血清、青霉素100mg/ml和链霉素100mg/ml的DMEM培养基作为ACC-M细胞的培养液,于5%CO2饱和湿度,37℃细胞培养箱内常规培养;用每升含10g胰化蛋白胨、酵母提取物5g和氯化钠5g的LB培养基作为细菌的液体培养,固体LB培养基需要在每升液体LB中加入琼脂15g,细菌培养于37℃的恒温箱中。
1.2.2细胞与细菌转染和筛选 采用FuGENE 6脂质体转染ACC-M细胞。转染后48h,用含800μg/ml G418的培养液筛选细胞2周,获得稳定表达GFP的细胞株,接着采用96孔板有限稀释法进行单克隆细胞的筛选,获得表达GFP的单克隆细胞株,选取其中GFP表达量最高的单克隆细胞株作为实验细胞株,并命名为ACC-M-GFP;采用氯化钙法将pDsRed2转入大肠杆菌DH5α,通过加有氨苄青霉素的LB固体培养平板上进行筛选,再由荧光显微镜得到高表达的E. coli DH5α单克隆。
1.2.3肿瘤种植 0.25%的胰酶消化处于对数生长期的ACC-M-GFP细胞,冰冷的无菌磷酸盐缓冲液( PBS)洗涤3次,最后用适量PBS重悬成密度为1×106个/ml单细胞悬液。裸鼠麻醉按0.9ml麻醉剂(10%乌拉坦和2%水合氯醛混合液)/ 100g腹腔注射。对2只裸鼠进行皮下注射0.1ml的 ACC-M-GFP细胞液建立皮下肿瘤生长模型。
1.2.4细菌感染及治疗[9]离心收集表达DsRed2的大肠杆菌DH5α后,用冰冷的PBS洗涤3次,最后用适量PBS重悬成密度为1010~1011个/ml悬液,采用1ml的注射器(武汉恒康有限公司)注入2只裸鼠腹部,其中1只加用卡那霉素治疗,每6h在腹腔内注入20mg/ml的卡那霉素0.2ml。
1.2.5整体光学成像 实验所用整体光学成像系统为自制[10,11]。此系统由光源(深圳懿鎏电子有限公司,直径为5mm的大功率发光二级管,波长范围为468/30nm用于GFP成像、范围为525/30nm用于DsRed2成像)、激发滤光片(沈阳汇博光学技术有限公司EF-B1, 420~490nm带通用于GFP成像、460~550nm带通用于DsRed2成像)、发射滤光片(沈阳汇博光学技术有限公司BF-B1, 460~490nm带通用于GFP成像、520nm长通用于DsRed2成像)和探测器(Canon数码相机,型号:PowerShot G5)组成。成像前,裸鼠轻度麻醉,调整成像系统进行整体荧光成像。
2 结 果
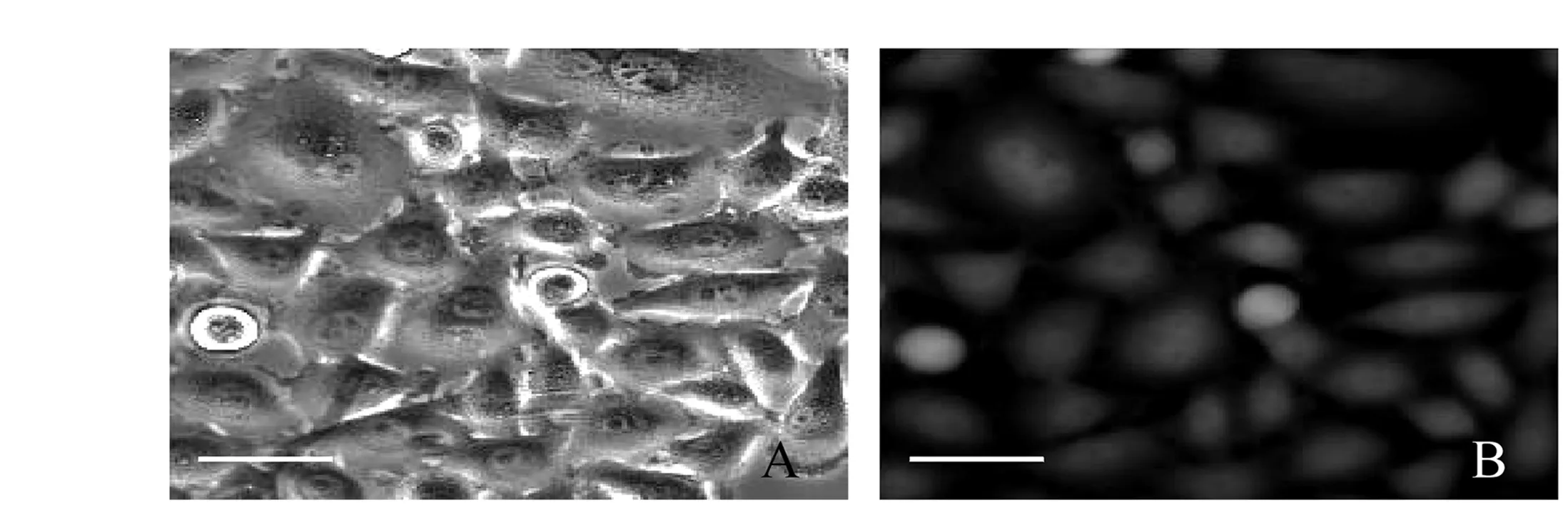
A为ACC-M-GFP细胞透射图B为ACC-M-GFP细胞荧光图 (标尺为50μm) 图1 稳定高表达GFP的ACC-M-GFP细胞
2.1稳定高表达GFP的单克隆细胞株ACC-M-GFP稳定高表达GFP的ACC-M-GFP细胞贴壁生长,在IX70倒置荧光显微镜下呈现出很强的绿色荧光,荧光较为均匀地分布于整个细胞内。单克隆ACC-M-GFP细胞在G418筛选压力下,一直稳定高水平表达GFP(见图1)。
2.2利用整体光学成像系统在体监测皮下肿瘤生长及抑制2只裸鼠移植了涎腺癌细胞,1周后肉眼观察到100% 成瘤。每隔5~7d,就对皮下肿瘤进行背景成像和整体荧光成像。右上侧皮下肿瘤随时间推移,荧光区域面积逐渐增加,至37d时肿瘤大小约为2cm×1cm;右下侧皮下肿瘤长至20d时,在肿瘤内注射0.1ml顺铂(浓度为0.1mg/ml),荧光区域面积略变小(见图2A)。
2.3腹部感染及治疗的整体光学成像
2.3.1腹部感染大肠杆菌的荧光成像 裸鼠腹部皮下注入表达红色荧光蛋白的大肠杆菌DH5α,每隔一定时间对注射部位进行整体荧光成像。大肠杆菌在12h已经有扩散发生,在36h时荧光扩散整至个腹部,在48h后裸鼠死亡(见图3)。
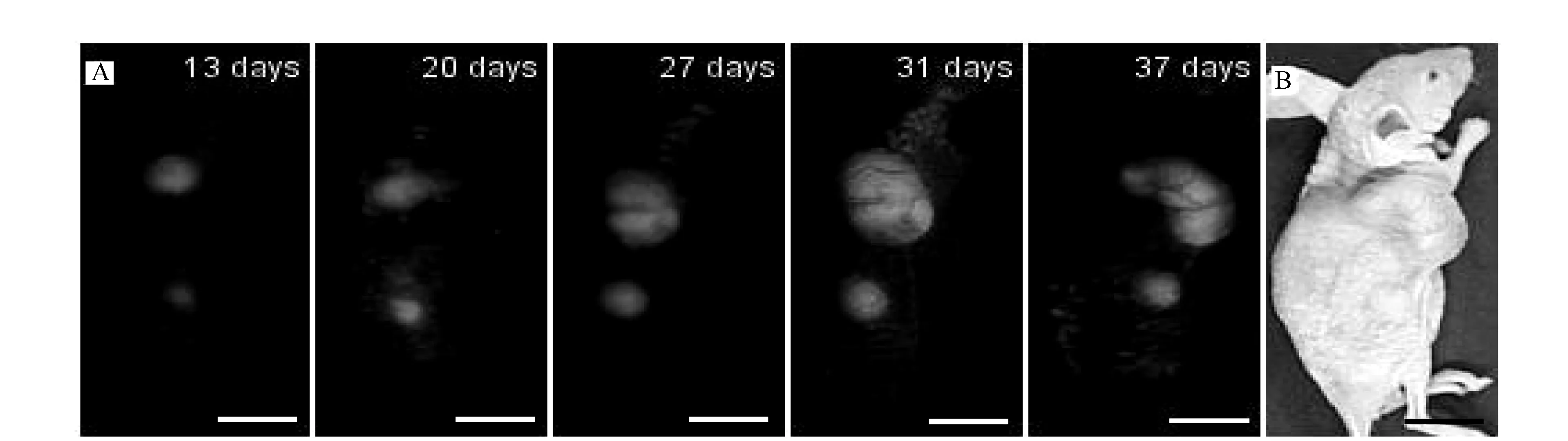
A为皮下肿瘤随时间生长的荧光图;B为透射图(标尺为1cm)图2 皮下肿瘤生长
2.3.2治疗腹部感染大肠杆菌时的荧光成像 裸鼠腹部皮下注入表达红色荧光蛋白的大肠杆菌DH5α,并立即注射20mg/ml的卡那霉素0.2ml,每隔6h腹腔内注入同样剂量的卡那霉素,同时每隔一定时间对腹腔进行整体荧光成像[12]。大肠杆菌在12h时有少许扩散,在36h时荧光没有扩散并且荧光强度减弱,在48h后荧光基本上已探测不到,裸鼠存活(见图4)。

3 讨 论
随着分子生物学及基因工程的发展,光学成像的概念取得了重大的突破[5],将基因标记技术与光学成像方法结合的非侵入性在体分子荧光成像应运而生。在光学成像中,选择不同波长的光相当于引入一个新的造影剂,从而真正实现了无损、多次重复地实时检测[11]。其次,光学成像仪器相对于MRI、PET等较便宜,容易为患者所接受。
本研究采用GFP和DsRed2两种荧光蛋白标记肿瘤和大肠杆菌,使肿瘤和大肠杆菌自身成为发光的光源,从而可以同正常组织区分开来,最后进行在体光学成像。图2为采用整体成像在体外观察的肿瘤的生长以及顺铂抑制肿瘤生长过程。大肠杆菌感染裸鼠腹部皮下及感染后的治疗,我们用这种成像方法实时动态地监测了大肠杆菌感染及卡那霉素治疗的消长过程,如图3和图4所示。这些实验反映了在体光学成像方法能为研究肿瘤发生发展和微生物消长过程提供重要的技术手段。对于研究肿瘤治疗药物和细菌抗生素筛选,本实验的两种实验模型将是一种很好的平台。
不过这种方法尚存在一些不足,动物组织中存在弹性蛋白和胶原蛋白,它们的激发波长和发射波长与GFP类似,图象中存在一定的背景;另外光在组织传输中存在吸收和散射,从而造成光学成像深度有限[12]。如图2A肿瘤在第13天的时候,荧光还特别弱,这就是光在传输过程中被吸收和散射的原因。目前研究者正致力于红色荧光蛋白(DsRed)及远红外荧光蛋白的研究,由于它们的激发和发射波长远大于GFP,因此它们解决了荧光探针的在体光学成像的一些困难,实现了自发荧光少且成像深度深[13,14],这些特性使DsRed及远红外荧光蛋白逐渐成为在体荧光成像的理想探针。
在今后的研究中,尚需进一步改善光学成像系统和荧光标记探针,对原位移植瘤的自发转移进行高分辨率的、深层次的实时非侵入在体荧光成像,为研究肿瘤转移机理、药物作用靶点和评价药物作用效果提供重要技术平台。
致谢:感谢华中科技大学国家光电实验室生物医学光子所给予的支持和帮助。
[1]Massoud TF,Gambhir SS. Molecular imaging in living subjects: seeing fundamental biological processes in a new light[J]. Genes Dev, 2003, 17 (5):545-580.
[2]Weissleder R. Scaling down imaging: molecular mapping of cancer in mice[J]. Nature Rev, 2002, 2(1):1-8.
[3]March JC, Rao G, Bentley WE. Biotechnological applications of green fluorescent protein[J]. Appl Microbiol Biotechnol, 2003, 62(4):303-315.
[4]Contag CH, Jenkins D, Contag PR,etal.Use of reporter genes for optical measurements of neoplastic disease in vivo[J]. Neoplasia, 2000, 2(1-2):41-52.
[5]Chishima T, Miyagi Y, Wang X,etal.Metastatic patterns of lung cancer visualized live and in process by green fluorescence protein expression[J]. Clin Exp Metastasis, 1997, 15(5):547-552.
[6]Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites[J]. Nat Rev Cancer, 2002, 2(8):563-572.
[7]Yang M, Baranov E, Wang JW,etal.Direct external imaging of nascent cancer, tumor progression, angiogenesis, and metastasis on internal organs in the fluorescent orthotopic model[J]. Proc Natl Acad Sci USA, 2002, 99(6):3824-3829.
[8]Yang M, Baranov E, Li XM,etal.Whole-body and intravital optical imaging of angiogenesis in orthotopically implanted tumors[J]. Proc Natl Acad Sci USA, 2001, 98(5):2616-2621.
[9]Zhao M, Yang M, Baranov E,etal.Spatial-temporal imaging of bacterial infection and antibiotic response in intact animals[J]. Proc Natl Acad Sci USA, 2001, 98(17):9814-9818.
[10]Chu J, Chen YP, Xiong T,etal.Whole-body fluorescent imaging of the growth and metastasis of GFP-expressing tumors[J]. ACTA Laser Biology Sinica, 2004, 13(6):433-438.
[11]Xion T, Zhang GZ, Liu BF,etal.In vivo optical imaging of human adenoid cystic carcinoma cell metastasis[J]. Oral Oncol,2005,41 (7):709-715.
[12]Billinton N, Knight AW. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence[J]. Anal Biochem, 2001, 291 (2):175-197.
[13]Campbell RE, Tour O, Palmer AE,etal.A monomeric red fluorescent protein[J]. Proc Natl Acad Sci USA, 2002, 99 (12):7877-7882.
[14]Gurskaya NG, Fradkov AF, Terskikh A,etal.GFP-like chromoproteins as a source of far-red fluorescent proteins[J]. FEBS Letters, 2001, 507(1):16-20.
[编辑] 一 凡
R730.23;Q63
A
1673-1409(2009)02-R005-04
10.3969/j.issn.1673-1409(R).2009.02.002
2009-02-27
国家重点基础研究发展计划(2004CB520804);湖北省教育厅青年资助项目(Q200712005);长江大学博士启动基金(0364)
熊涛(1974-),男,湖北荆州人,副教授,博士,从事肿瘤在体光学成像及细胞凋亡研究。
