DNA-AFLP分析用辣椒基因组DNA提取方法的优化
2009-11-29宋小丽施倩倩浙江大学农业与生物技术学院农业部园艺植物生长发育与品质调控重点开放实验室浙江杭州310029
向 珣,宋小丽,施倩倩(浙江大学农业与生物技术学院,农业部“园艺植物生长发育与品质调控”重点开放实验室,浙江杭州310029)
柴伟国 (浙江省杭州市农业科学研究院,浙江 杭州 310024)
曹家树 (浙江大学农业与生物技术学院,农业部“园艺植物生长发育与品质调控”重点开放实验室,浙江杭州310029)
DNA-AFLP分析用辣椒基因组DNA提取方法的优化
向 珣,宋小丽,施倩倩(浙江大学农业与生物技术学院,农业部“园艺植物生长发育与品质调控”重点开放实验室,浙江杭州310029)
柴伟国 (浙江省杭州市农业科学研究院,浙江 杭州 310024)
曹家树 (浙江大学农业与生物技术学院,农业部“园艺植物生长发育与品质调控”重点开放实验室,浙江杭州310029)
采用SDS法、CTAB-1法和CTAB-2法提取辣椒(Capsicumannuum)叶片DNA,通过紫外吸收和琼脂糖凝胶电泳检测,证明CTAB-2法所提取DNA的质量和纯度较高;以此DNA为模板进行DNA-AFLP分析,特征条带清晰、基本无脱尾,适用于DNA-AFLP等分子生物学研究。
CTAB;辣椒(Capsicumannuum);DNA;DNA-AFLP
提取DNA是分子生物学研究的基础技术,DNA的纯度及结构的完整性是进行基因工程各项研究所必需的。AFLP标记由Vos等[1]发明,原理是利用一种稀有酶切位点酶和一种丰富酶切位点酶,同时切割基因组DNA,然后在酶切片段两端连接上人工接头,作为扩增反应的模板。设计的引物和接头与酶切位点互补,并在3’端加上2 ~ 3个选择性碱基,因此在DNA被酶切后的无数片段中,只有那些与引物3’端互补的片段才能进行扩增,称为选择性扩增。扩增产物在PAGE胶上分离后,通过银染等检测手段显示出多态性丰富的指纹图谱。该标记系统能通过少量的引物扩增产生数量丰富的带型标记,并且分辨率高,在鉴定遗传多样性和物种亲缘关系中具有较大的优越性[1]。目前,栽培辣椒(Capsicumannuum)品种种质谱系越来越集中在少数优良种质上,导致亲缘关系越来越近,形态区分难度也越来越大,新品种的新颖性和特异性鉴定缺少依据,生产上品种的形态鉴定、新品种的认定或审定很困难。DNA-AFLP构建辣椒遗传图谱,不仅具有强有力的多态性检测能力,而且所揭示的多态性DNA产物能被高效地克隆,获得的分子标记可以用于辅助育种及基因文库筛选等更深入的遗传学研究。
高质量的DNA提取,是成功构建DNA-AFLP指纹图谱的前提。模板的质量将影响酶切、连接、PCR扩增反应,而假阳性或假阴性不能反映真实的多态性[4]。酚类化合物和多糖是影响植物DNA提取的2个重要因素,常导致DNA降解,影响DNA的纯度、产量及DNA聚合酶活性[5]。辣椒叶片富含淀粉和多酚等物质,有效去除DNA所含杂质(多糖、酚类等),是提取高质量辣椒DNA的关键。因此,本研究在SDS和CTAB法基础上适当加以改良,提取形态相近、亲缘关系密切的12份辣椒材料DNA,进行DNA-AFLP分子标记鉴定,以便为区分它们提供分子指纹证据。
1 材料与方法
1.1 材料
供试辣椒品种12份,分别是‘采风1号’、‘采风3号’、‘千丽1号’、‘弄口早椒’、‘杭椒2号’、‘杭椒3号’、‘浙椒1号’、‘鸡爪椒’、‘吉林甜椒’、‘9614-1-2’、‘9624-25’和‘ASC0503’,全部来源于杭州市农业科学研究院蔬菜研究所。
1.2 方法
(1)总DNA的提取 基因组DNA提取采用SDS法和CTAB法,略加改进[6]。操作如下:从超低温冰箱中取出材料,称取0.5 g,加入适量的液氮,在保持叶片冷冻的条件下快速将叶片研磨成粉末;分别用3种抽提缓冲液抽提(表1);70% ~ 80%冷乙醇洗沉淀2次,再用无水乙醇漂洗1次,冷冻真空干燥机抽干;加50 ~ 100 μL ddH2O或TE使沉淀溶解,-20 ℃保存;取5 μL DNA,以 0.8%琼脂糖凝胶电泳检测 DNA质量,同时用紫外分光光度计检测DNA含量及质量。

表1 抽提缓冲液体系Table 1 Extraction buffer systems
(2)DNA-AFLP分析 以CTAB-2法提取的DNA为模板,经EcoR Ⅰ、MseⅠ双酶切,并与MseⅠ、EcoR Ⅰ接头连接,预扩、选扩、聚丙烯酰胺凝胶电泳。所有接头和引物由上海英骏生物技术有限公司合成(表2)。AFLP酶切、连接、扩增参照宋小丽等[7](表3、表4)。

表2 DNA-AFLP所用接头及引物序列Table 2 DNA-AFLP adopters and primers

表3 DNA-AFLP反应体系Table 3 DNA-AFLP reaction system

表4 DNA-AFLP扩增和电泳程序Table 4 DNA-AFLP amplification and electrophoresis procedures
2 结果与分析
2.1 辣椒叶片匀浆比较
将叶片加入液氮磨成干粉,加入抽提缓冲液,在65 ℃水浴45 min后比较匀浆的颜色。SDS法匀浆颜色为暗绿色,不透明;CTAB-1法叶片匀浆颜色翠绿且透明,CTAB-2法叶片匀浆颜色比CTAB-1稍暗,但是透明。匀浆绿色且透明是DNA提取质量高的标志。CTAB法比SDS法除酚类物质彻底,其中CTAB-1防止酚类物质氧化的能力更强。
2.2 琼脂糖凝胶电泳检测

A. SDS法提辣椒基因组DNA; B. CTAB-1法提辣椒基因组DNA; C. CTAB-2法提辣椒基因组DNA; a泳道:‘采风1号’DNA;b泳道:‘采风3号’DNA。图1 辣椒基因组DNA 0.8%琼脂糖凝电泳检测Figure 1 Electrophoresis of pepper genomic DNA through 0.8% agarose gel
电泳检测显示,采用CTAB-2法提取的DNA纯度较高,结构完整、条带清晰、整齐一致,无降解现象;SDS法几乎全部降解,并存在蛋白质污染,可能是大量的酚类物质降解促进了DNA 的降解。CTAB-1法中,DNA条带模糊不均一,都有不同程度的降解,且有胶状物聚集于点样孔,说明有多糖和蛋白质污染(图1)。
2.3 紫外吸收检测
CTAB-2法提取DNA的D260/D280在1.75 ~ 1.95(表5),说明CTAB-2法提取的DNA紫外吸收曲线具有典型的天然DNA标准吸收光谱,RNA、蛋白质去除较好;SDS法提取的DNAD260/D280在1.0 ~ 1.3之间(未列出),结合电泳图可以分析出DNA降解非常严重;CTAB-1法的D260/D280在1.3 ~ 1.7之间,结合电泳图可以分析出DNA降解严重而且含部分蛋白质。就测量的DNA浓度而言,SDS法和CTAB-1法测得的浓度(未列出)比CTAB-2法高很多,都是1 000以上,但这是由于DNA降解的缘故,仅仅数值不能说明问题。

表5 CTAB-2提辣椒基因组DNA的浓度和质量Table 5 Quantity and quality of pepper genomic DNA extracted by method CTAB-2
2.4 DNA-AFLP分析
对酶切、连接后的产物进行预扩增,凝胶电泳检测显示扩增产物稳定,弥散范围在100 ~ 1 000 bp之间(图2),表明辣椒基因组DNA酶切充分,接头连接较好。使用5条EcoR Ⅰ引物和5条MseⅠ引物,共25对引物组合用于构建12个辣椒品种的遗传图谱,大部分引物在品种间均能扩出差异条带(图3)。
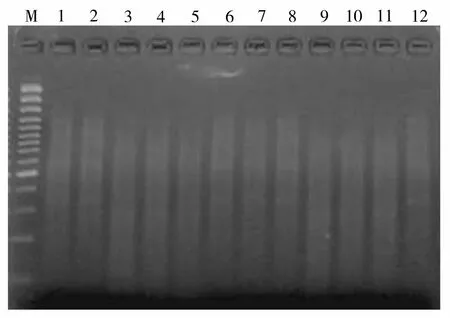
M:100 bp标准分子量;泳道1 ~ 12为辣椒品种编号图2 连接产物预扩增凝胶电泳检测Figure 2 1% agrouse gel electrophoresis of the preamplified productions
3 讨论
辣椒叶片富含的酚类物质会导致DNA降解,与DNA 结合形成的沉淀物质多呈黄色或黑褐色,难以溶解或溶液颜色深,很难得到高纯度DNA。由于酚类化合物在植物材料中普遍存在,常出现获得的DNA产量低、质量差、DNA易降解等问题,难以满足相关的分子分子生物学研究需求。已有的报道使用液氮研磨,并在提取液中加入一定量的PVP、巯基乙醇等可去除酚类物质的试剂[8,9]。
RAPD是一种有效的分子标记技术,对DNA用量很少(5 ~ 10 ng),质量要求也不高,操作简单。俞文政等[10]采用SDS法、CTAB法和高盐低pH法对辣椒叶片DNA进行提取,结果显示SDS法提取的DNA分子较为完整,能进行RAPD分析。Paran 等[11]发现在检测辣椒多态性上,AFLP引物是RAPD有效性的4倍,具有信息量大、快速、稳定、高效的优势[12],但AFLP对DNA的要求较RAPD高,因为DNA需要经过EcoR Ⅰ、MseⅠ双酶切,并与MseⅠ接头和EcoR Ⅰ接头连接,随后预扩、选扩,过程复杂且多,提取的DNA质量不高会导致酶切不充分,影响以后的连接扩增反应,不利于扩增。本研究中,SDS法提取的DNA质量不高,褐变严重。SDS法中DNA纯化虽用氯仿/异戊醇代替酚来去处变性蛋白,克服酚残留对酶切的影响,但SDS本身对PCR、RAPD等有较大影响。顾红雅等[13]提出用增大离心速度或延长离心时间,也有利于杂质的去除,克服SDS法DNA含较多糖类杂质的缺点。
与SDS法(0.5 mol·L-1NaC1)相比,CTAB法增加高盐溶液中盐的浓度(提取缓冲液中NaC1的浓度提高到1.4 mol·L-1),使DNA在高盐缓冲条件下优先沉淀,可有效去处多糖。CTAB-1法增加巯基乙醇的含量,同时加入PVP使其与多酚类物质结合形成复合物。虽然CTAB-1的叶片匀浆比CTAB-2更绿,酚类物质去除更好,但过剩的疏基乙醇导致辣椒叶片DNA得率低,有脱尾,虽能用于普通PCR扩增,但由于DNA片断的断裂程度较大,在DNA-AFLP分析中谱带减少、模糊,影响分析效果。
DTT是一种还原剂,有抗氧化作用,与巯基乙醇的作用相似,但DTT的刺激性气味要小很多,毒性也较巯基乙醇低很多。王岩等[6]利用改良的2×CTAB法(含0.2%DTT)提取辣椒基因组DNA,以此DNA为模板适合于普通PCR分析。本研究CTAB-2法在高盐缓冲条件下,用0.2%DTT代替CTAB-1法1%PVP-360,并省略了1%的巯基乙醇,结果显示改良的CTAB-2提取的基因组DNA产量高、质量好,适用DNA-AFLP分析。在高盐提取缓冲液中加入适量的DTT,能有效地抑制酚类物质的氧化,同时也避免造成DNA的断裂等一系列的问题,为利用DNA-AFLP分析辣椒植物的起源、分类、亲缘关系及品种特征图谱的建立提供了有力保障。
[1]Vos P, Hogers R, Bleeker M,etal. AFLP, a new technique for DNA fingerprinting[J]. Nucleic Acids Res, 1995, 23:4407~4414.
[2]邹喻苹,葛 颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001.
[3]邓明华,邹学校,周群初.辣椒品种和纯度的现代鉴定技术[J].中国辣椒,2002,(4):14~17.
[4]符庆功.白菜不育两用系基因组AFLP差异片断筛选、克隆及序列分析[D].杭州:浙江大学,2003.
[5]蔡秀珍,刘克明,龙春林.野生芋属植物干叶片DNA的提取及PCR扩增[J].中国野生植物资源,2008,27(1):51~53.
[6]王 岩,张宝玺,张国裕,等.辣椒叶片DNA提取方法的优化[J].长江蔬菜,2006,(8):59~61.
[7]宋小丽,柴伟国,董德坤,等.12个亲缘关系密切辣椒品种的AFLP鉴定[J].浙江农业科学,2008,(3):259~262.
[8]刘玉皎,李 萍,张小田.巯基乙醇和PVP对蚕豆DNA质量的影响[J].湖北农业科学,2008,47(3):248~250.
[9]陈 瑾,迪丽拜尔·托乎提,郭卫东.五种提取草珊瑚叶片总DNA方法的比较研究[J].新疆师范大学学报(自然科学版),2008,(1):87~89.
[10]俞文政,杨 贵,张映南,等.辣椒基因组DNA提取方法研究[J].辣椒杂志,2007,(4),39~43.
[11]Paran I. Variation inCapsicumannuumrevealed by RAPD and AFLP markers[J]. Euphytica, 1998, 99:167~17.
[12]Becker J, Vos P, Kuiper M,etal. Combined mapping of AFLP and RFLP markers in barley[J]. Mol Gen Genet, 1995, 249:65~73.
[13]顾红雅,翟礼嘉,明小天.植物基因分子操作[M].北京:北京大学出版社,1995.192~211.
Q785
A
1673-1409(2009)02-S048-04
10.3969/j.issn.1673-1409(S).2009.02.014
2009-03-30
浙江省自然科学基金项目(Y3080128);国家自然科学基金项目(30771377)
向 珣(1973-),女,四川达州人,农学博士,讲师,从事园艺植物生长发育研究.
曹家树,Email:jshcao@zju.edu.cn.
