射频紧缩家犬前交叉韧带后血供重建研究
2009-09-19马文谱赵建彬哈欣高友娟苑振峰袁欣
马文谱 赵建彬 哈 欣 高友娟 苑振峰 袁 欣
[摘要] 目的 将射频能量应用于正常家犬前交叉韧带(ACL),分析术后6周和12周的组织学变化以及固定对它们的影响。方法 将24只成年家犬,随机分为A、B两组。A组射频处理ACL的中间段,B组处理ACL的两端部。每只家犬双后肢进行固定和非固定的对比。于6周、12周行血管免疫组化染色。结果 6周时和12周时,两端紧缩固定组ACL血管密度高于中间段紧缩固定组,12周时非固定组ACL全部断裂。结论 紧缩ACL前半部分的上下端效果较好,射频处毛细血管从滑膜发生并向深层生长。ACL射频术后有必要进行外固定制动。
[关键词] 动物实验; 前交叉韧带; 射频; 组织紧缩; 组织学检查; 制动; 血管化
[中图分类号] R873 [文献标识码] A [文章编号] 1673-9701(2009)23-05-03
Revascularization Study of Anterior Cruciate Ligament after Radiofrequency Shrinkage in a Canine Model
MA Wenpu ZHAO Jianbin HA Xin GAO Youjuan YUAN Zhenfeng YUAN Xin
Orthopedic Surgery,Peoples Hospital of Liaocheng City of Shandong Province 252000,China
[Abstract] ObjectiveTo treat the normal anterior cruciate ligament(ACL) with radiofrequency shrinkage,and then analyze the histologic changes and the impact of immobilization at Weeks 6 and 12 after initial treatment. MethodsTwenty-four skeletally mature canis familiaris were divided into A and B groups randomly. The radiofrequency shrinkage technique was applied in midportion of the ACLs in Group A and in the amph-portions of the ACLs in Group B. We carried out a contrast between the immobility and the non-immobility in the two posterior limbs of each dog. At Weeks 6 and 12 after that,the capillary number was counted in normal ACLs and treated ACLs after FⅧ immunohistochemical histologic examination in every portion. ResultsAt Week 6,the vascularity in amph-portions immobilized groups was higher than that in immobilized midportion group. At Week 12,all the free ACLs in non-immobilized groups ruptured. ConclusionIt may be a better method to shrink the amph-portions of the front portion in the elongated ACL radiofrequency-treatment than to shrink the midportion. The capillary vessels originate from the synovial envelope and invade the radiofrequency-treated parts from the surface toward the deep portion. A period of immobilization is necessary after operation.
[Key Words]Animal study; Aterior cruciate ligament; Radiofrequency energy; Soft-tissue shrinkage; Histological examination; Immobilization; Revascularization
前交叉韧带(ACL)松弛是运动损伤中的常见疾病,20世纪90年代及其以前主要以保守治疗为主,如肌肉锻炼、支具保护及限制运动水平等,但效果均不确切[1]。射频技术开始被应用到肩关节不稳的治疗后在治疗ACL松弛方面取得了较好的效果[2,3],但是也出现了一些并发症[4]。关于ACL射频紧缩术的基础研究较少,而且多数集中在射频术后即时的生物力学和组织学的改变方面。射频术后的组织学随时间变化方面的动物实验也较少。我们认为,如果想进一步在ACL外科开展射频技术,必须由基础研究提供足够的动物实验结果方面的支持。
1 材料与方法

1.1 实验动物与分组
25只成年家犬,平均体重(16.5±2.2)kg,年龄(4.1±0.7)岁,家犬的体重相近,行走步态正常,关节活动自然。X线摄片确定动物骨骺已经闭合。在实验家犬中随机选出24只并随机分为A、B两组。A组射频处理ACL的中间段,B组射频处理ACL的两端部。A组的每只家犬的一条后肢随机分入A1组,手术后进行固定处理;另外一条分入A2组,不做固定处理。B组的每只家犬的一条后肢随机分入B1组,手术后进行固定处理;另外一条分入B2组,不做固定处理。另取家犬的正常ACL 6条作为射频实验的对照组,和手术后的ACL一同进行组织学检查。

1.2 手术操作
术前半小时肌内注射安定5mg、速眠新2mL后,双后肢常规消毒铺无菌巾单,取髌前外侧入路,暴露ACL。术中使用直径2.5mm射频汽化仪时,设定射频汽化仪为25W。紧缩方式:射频电极从一个端开始以2.5mm/s速度开始向另一端移动,韧带每一部分均经紧缩,无遗漏,不重叠。按照实验设计紧缩处理韧带的中1/3或者ACL的两端各1/3,手术部位的前后方向占韧带周径50%~60%。紧缩完成用爱昔康缝线逐层缝合关节囊及皮肤,包扎伤口,随机将一侧膝关节用石膏固定于家犬的自然屈膝位置,另一侧则无任何外固定。固定侧三个月后取下石膏固定。每日观察实验家犬的的行走步态是否有异常。正常的步态应该是家犬行走和跳跃时没有肉眼可见的异常。当家犬出现跛行或者一侧下肢向上提起无法负重时认做异常步态。按照实验计划的时间于术后6周、12周时取出A、B组实验动物各6条ACL。
1.3 组织学分析
横切片行兔抗FⅧ(武汉博士德公司)的免疫组化染色,采用不含一抗的PBS溶液代替一抗作为阴性对照。阳性对照采用已知阳性的家犬的子宫内膜标本。
微血管计数:每个标本有两个横切片进行观察计数。标出横切片的中心,将中心与邻接滑膜的韧带边缘之间的连线分为三部分,这样每个横切片被分为滑膜下部(邻接滑膜层)、中间部、核心部三部分。滑膜下部、中间部各计数5个200倍镜视野,核心部计数3个高倍视野。将每区所有高倍镜视野中的计数平均,然后按面积(mm2)标准化取值代表韧带横切片的微血管密度。由三位不知临床资料的高年资病理医师采用背对背方法分别进行,取计数的平均值。
1.4 统计学处理
实验数据使用SPSS 11.0处理,分6周和12周利用析因分析对固定与否以及射频处理韧带两端或中间进行检验,同时检验两者是否有交互效应。利用配对t检验及独立样本的t检验对比分组间的血管密度的差别。当P<0.05时有显著性差异。
2 结果
2.1 步态观察及韧带观察
家犬出现跛行、关节异常畸形和后肢上抬无法负重等提示关节内可能存在ACL功能异常。固定侧后肢未出现异常活动,而未固定侧后肢在不同时间内出现异常活动。6周时未发现实验动物无外固定后肢有异常活动。B2组出现关节异常活动的时间为(57±4)d,而A2组出现关节异常活动的时间为(54±5)d,两者对比无显著性差异。6周、12周时沿原手术入路切开暴露ACL后进行观察。6周时候A1、B1组有鲜亮薄层滑膜包裹形成,集中于射频部位。A2、B2组滑膜覆盖散乱,韧带有部分中断现象。
2.2 正常ACL组织学观察
正常的ACL由一层血管丰富的滑膜覆盖,血管内皮细胞的免疫组化染色显示在中间段,血管密度如下:滑膜下部(66.0±17.0)/mm2;中间部(40.8±29.3)/mm2;核心部(22.5±9.7)/mm2。ACL胫骨端和股骨端的血管密度无明显差异,取其平均值表示两端部血管密度如下:滑膜下部(78.7±17.2)/mm2;中间部(48.8±33.3)/mm2;核心部(25.6±11.2)/mm2。
2.3 微血管计数
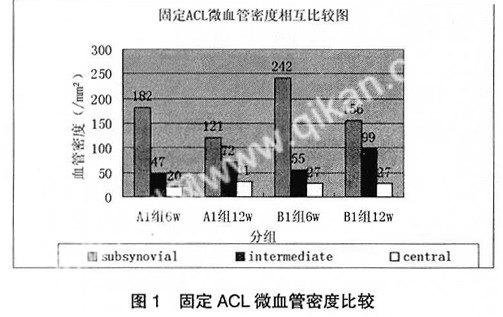
术后ACL的血管增高区主要位于射频处理区,而韧带后方未涉及到的后方血管密度无明显改变(表1)。6周和12周时候,B组ACL股骨端和胫骨端的血管密度无明显差异,我们取其平均值代表两端部血运。而6周时A1、B1组的滑膜下部的血管密度分别明显强于A2、B2组。经析因分析,固定和射频处理韧带的两端均有助于ACL射频术后的再血管化,两者只存在简单的叠加作用(F=31.098,P=0.000,F=4.485,P=0.047)。12周A1、B1组韧带的中间部的血管密度较6周前和正常韧带的血管密度明显增加,B1组韧带的中间部的血管密度高于A1组。韧带的核心部血管密度无明显改变。分析对比6周、12周时候A1、B1组每组中三个分区的的血管密度。发现韧带的血管密度在6周、12周时滑膜下部明显大于中间部,但在12周时这种差距减小。
3 讨论
射频技术在外科的应用越来越受到重视。自1998年Thabbit[3]将射频技术第一次应用到ACL松弛的紧缩治疗后,陆续有关于这项技术并发症[4]的报道,另有研究者对这项技术提出了质疑[5]。目前缺乏关于射频技术对ACL治疗的基础研究。
射频术后ACL的生物力学强度下降,如果不受保护将有断裂的危险。Lopez等[6]将正常家犬的一侧后肢ACL进行射频处理,术后未施行任何保护措施,约55d后观察到ACL断裂的征象。实验中我们将射频处理后家犬的后肢分为石膏固定侧和不固定侧,然后将家犬饲养在家犬舍中。术后60d左右未固定后肢均出现ACL断裂后异常步态,而固定侧未出现。这说明石膏管型起到了限制关节屈伸的作用,有利于术后ACL的组织修复。术后负重并不是ACL射频紧缩术后的禁忌,而限制关节的过度屈伸,维持关节的稳定才是关键。
良好的组织血运是组织修复再生的前提。韧带受损后的再血管化对韧带胶原的生成以及组织塑形都是非常重要的。Hsiao-Li Ma等[7]发现紧缩过程会破坏韧带表层的血管网及其包裹滑膜。而这些血管和滑膜正是提供韧带营养的根源。在韧带经受射频处理后,其必将适应新的环境,韧带纤维重新生长、重塑,血管重新长入。固定组的ACL 6周时在射频处理区域的微血管生成集中在韧带的表层,即韧带的滑膜下层,而在12周时韧带的中间部的微血管密度增大,滑膜下层的微血管密度开始降低(图1)。这一动态的观察说明,在术后的前几周,射频处理区域的血管长入是从覆盖韧带的滑膜开始的(图2),在固定组,两端射频处理后ACL的血管化要优于中间射频处理的ACL。
学者们认为在韧带受后的修复过程中,韧带的脂肪垫、滑膜起到了重要的作用,当切除髌前脂肪垫后,韧带的血管化明显延迟[8]。Unterhauser等[9]在羊的自体肌腱重建ACL的研究中认为,韧带的血管化首先应当是韧带周围的滑膜生长。Scheffler等[10]在羊的ACL射频处理术后的组织学观察中发现韧带的新生血管集中在滑膜下层和中间部。但是其未形成连续的观察过程。血运丰富、脂肪垫覆盖较好的两端在经受射频处理后韧带的再次血管化的密度以及组织重塑的速度都要好于韧带的中间段,这说明韧带血运丰富的地方有较好的组织修复能力。
综合以上,我们认为射频处理后的韧带的再血管化必须在适当的外固定的情况下才能进行,它的血管化的模式是由滑膜向韧带射频渗透区域进行的,韧带两端的再血管化优于韧带的中间部分。去除手术适应证的选取问题,我们认为术中的紧缩方式对术后恢复也有较大影响。我们在实验中韧带的紧缩从韧带的两端向韧带中间进行,紧缩范围不重叠,尽量余留较多的韧带中段,余留韧带后面的50%左右不紧缩。一旦术中检查到膝关节的前抽屉试验和Lachman试验变为阴性,就可以停止紧缩。当然这种紧缩方式还需要足够的临床证据支持。在将来进一步的研究中,我们想找到合适的方法创建ACL部分损伤松弛模型,并进行生物力学方面的实验。同时根据实验结果和临床观察,制定出紧缩术后的具体的康复方案。
4 结论
紧缩ACL前半部分的上下端效果好于紧缩处理ACL中1/3,有利于组织再血管化和重塑。在ACL的射频处理部位,毛细血管从滑膜开始发生向射频处理部位的深层生长。ACL射频术后有必要进行一定时间外固定制动,制定详细的术后锻炼以及保护措施,以利于组织修复。
[参考文献]
[1] Buckley SL,Barrack RL,Alexander AH. The natural history of conservatively treated partial anterior cruciate ligament tears[J]. Am J Sports Med,1989,17:221-225.
[2] 王雪松,冯华,洪雷,等. 双极射频电热固缩治疗前交叉韧带松弛临床研究[J]. 中国运动医学杂志,2007,26(1):17.
[3] Thabbit G. The arthroscopic monopolar radiofrequency treatment of chronic anterior cruciate ligament instability[J]. Oper Tech Sports Med,1998,6:157-160.
[4] Perry JJ,Higgins LD. Anterior and posterior cruciate ligament rupture after thermal treatment[J]. Arthroscopy,2000,16:732-736.
[5] Carter TR,Bailie DS,Edinger S. Radiofrequency electrothermal shrinkage of the anterior cruciate ligament[J]. Am J Sports Med,2002,30:221-226.
[6] Lopez MJ,Markel MD. Anterior cruciate ligament rupture after thermal treatment in a canine model[J]. Am J Sports Med,2003,31:164-167.
[7] Hsiao-Li Ma,Wei-Jau Jiae,Chang-Hung Huang,et al. Thermal effects after anterior cruciate ligament shrinkage using radiofrequency technology: a porcine cadaver study[J]. Knee Surg Sports Traumatol Arthrosc,2005, 13:619-624.
[8] Benedetto KP,Klima G. Effect of the Hoffa fat pad on revascularization of the ruptured anterior cruciate ligament:A histologic study of the rabbit mode[J]. Z Orthop Ihre Grenzgeb,1986,24:262-265.
[9] Unterhauser,Frank NMD. Endoligamentous revascularization of an anterior cruciate ligament graft[J]. Clin Orthop Relat Res,2003,414:276-288.
[10] Sven Scheffler,Heike Chwastek,Veronika Schonfelder,et al. The impact of radiofrequency shrinkage on the mechanical and histologic properties of the elongated anterior cruciate ligament in a sheep model[J]. Arthroscopy,2005,21:923-933.
(收稿日期:2009-03-16)
