酿酒酵母与拟南芥Pre-mRNA剪接位点的比较
2009-07-31申杰华
申杰华
摘要:RNA 剪接是一个多步骤、形成多种中间状态复合物的复杂过程。跨物种的基因表达更显得复杂,RNA剪接是基因表达调控中重要的步骤。这里讨论酵母和植物的剪接位点保守序列的差异,指出可能对植物基因在酵母中表达有重要作用的顺式作用元件。
关键词:RNA剪接;剪接体;剪接因子;跨物种表达;剪接位点
酿酒酵母细胞繁殖快,操作简便,属于真核模式生物。将植物的基因放入酵母中表达,在于能用酵母细胞大量表达植物蛋白。在2002年有一篇论文关于植物mRNA前体在裂殖酵母中的剪接和1983年的跨物种基因表达的研究。[1]
RNA剪接(RNA splicing)是tRNA、rRNA,特别是mRNA加工与成熟的重要生物学过程,也是蛋白质分子多样性产生的关键机制之一,在基因表达调控中扮演着重要的角色[2]。RNA剪接需要多种因子参与, 包括杂性核RNA(heterogeneous nuclear I A,hnRNA)结合蛋白hnRNP(heterogeneous nuclear ribonucleoprotein)、小型核RNA (small nuclear RNA,snRNA)结合蛋白snRNP(small nuclear ribonucleoprotein)等。核pre-mRNAs 剪接由剪接体执行,剪接体包含有5种(U1,U2,U4/6,和U5)snRNPs和其他non-snRNP剪接因子。[3]在真核细胞内,RNA原初转录物的分子很大,通过剪接产生成熟的mRNA分子.
1Pre-RNA剪接反应机制概述
真核生物细胞核基因初始转录物(pre-mRNA)剪接由两步连续进行的转酯反应完成(Padgett,1984Ruskin,1984)。首先,分支位点(branch site)处的腺苷酸2羟基亲核攻击5剪接位点的3一5磷酸二酯键,产生两种剪接中间体分子:一为5外显子对应的线性RNA分子;一为由内含子5一端鸟苷酸与分支点腺苷酸之间通过2一5磷酸二酯键形成的套索状分子,该分子包含了内含子和3外显子序列。紧接着5一外显子的3羟基攻击3剪接位点的磷酸二酯键,去除套索状结构的内含子序列,同时将相邻的两个外显子连接起来[4]。
2剪接体组装中的内含子和外显子的界定
U1snRNP结合上5剪接位点SF1结合到分支区域促使U2AF结合到聚嘧啶区域和3剪接位点上,导致早期复合体的形成(E complex)。在A复合体中U2snRNP和mRNA 前体形成稳定的snRNA-branch-region duplex。U4-U5-U6 3snRNP结合到A复合体上产生C复合体,一个成熟的剪接体。(1)内含子界定:mRNA 前体含有1个内含子和2个外显子,在E复合体上的剪接因子结合在剪接位点上跨过内含子。(2)外显子界定:在mRNA 前体中含有多个内含子和外显子,E复合体中的剪接因子结合在剪接位点上在外显子定义的早期复合体上(EDE complex),随后形成了A复合体(EDA complex),在组装成熟剪接体的过程中有一个内含子界定的复合体的过渡[5]。
3剪接体的组装过程
mRNA 前体原始转录物被蛋白(hnRNP Proteins;putative AU-biding proteins in plants)结合上,这类蛋白中的一些可能会结合上特殊的序列或者结合剪接因子.U1snRNP 和蛋白的相互作用(比如U2AF)形成一个复合体。结合U2 snRNP形成剪接体的前体,再结合上U4/U6-U5就形成了剪接体。随着这个复合体一系列的RNA-RNA间的相互作用和重组的改变,剪接反应发生了。剪接后,间接产物和剪接后复合体被释放,内含子被降解,剪接体结合在内含子上而后进入新的一轮循环中[6]。
4mRNA前体剪接因子
4.1 SR蛋白
SR蛋白家族是近些年来为人们广泛关注的一类剪接因子,它在剪接复合体的聚集形成,以及剪接因子在mRNA前体链上结合位点的识别过程中起着关键作用。其成员包括SC35(spliesome component of 35kD)、SF2/ASF(splicing factor 2/alternative splicing factor)、SRP20、SRP30、SRP40、SRP55和SRP70等。SR 家 族 剪接因子的结构特点是氨基酸序列中富含丝氨酸一精氨酸残基。其中RNA结合结构域(RNA binding domain)位于氨基末端(N末端),具有结合RNA的能力。而位于竣基末端的是含不同丝氨酸和精氨酸残基数量的RS 结构域(RS domain),它能够与具有RS结构域的U2AF(U2 auxiliary factor)的35kD亚基和U1snRNP7OkD的蛋白质相互作用,因而能够促进U2AF和U1snRNP与剪接位置结合。所以,SR蛋白在高等真核生物细胞中介导U1snRNP同5剪接位点结合与U2AF同3'剪接位点结合,起着“桥”的作用。关于SR蛋白在选择性剪接中对剪接位点的调控,主要是通过与不同的几个顺式调节因子作用。如通过与外显子的剪接增强子(exonic splicing enhancer,ESE)、内含子的剪接增强子(intronic splicing enhancer,ISE)、外显子的剪接沉默子(exomcsplicing silencer,ESS)和内含子的剪接沉默子(Intronic splcing silencer,ISS)的结合,来增强或减弱对其附近3或5弱剪接位点的识别和利用[7]。Wang等[8]使用ESE finder的软件(web一based),对人类SR蛋白可识别的细胞中存在着的ESE序列进行筛选和评分,这些蛋白质包括SF2/ASF、SRP40、SRP55和SC35;进一步证实了与ESE序列相关的SR蛋白,在外显子的定位过程以及组成性剪接和选择性剪接过程中的重要作用。另一方面,人类的很多疾病都与SR蛋白非正常结合剪接位点有关。Stickeler等[9]对肿瘤的研究发现,在肿瘤形成之前,不同组织细胞中SR蛋白的表达类型各不相同,一般只表达1个家族中的1个亚型;随着肿瘤的发展,SR蛋白表达类型逐渐增多而各不相同。以至最后,恶性肿瘤中SR蛋白的表达类型变得十分复杂。另外,Li等[10]发现SR蛋白SF2/ASF在维持基因组的稳定方面也起作用。
4.2 hnRNP形成因子
多聚嘧啶区域结合蛋白(PTB)是一种分子量为58kD的可以与RNA结合的新型核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNp)形成因子,它参与各种与RNA代谢相关的过程,也包括RNA的剪接。PTB能与U2AF竞争结合多聚嘧啶区域,对3剪接位点起调控作用。PTB也能抑制5剪接位点,并且可能通过包裹外显子使其不被剪接体结合而使外显子被跳过。
hnR N P A1也是一类hnRNP形成因子,有人对其进行晶体结构分析表明,它有两个独立折叠的与RNA结合的结构域,两者之间有一个连接体。两个RNA结合域(RNA binding domain,RBD)对于U1部分区域具有很高的同源性,这可以解释两者之间的对于剪接位点结合的竞争关系。而在空间位置上,两个RBD呈反平行排列且彼此靠近,构成RNA结合平台,依靠两对Arg一AsP离子键来实现结构的相对稳定。这种反平行RNA结合平台的存在,使得RNA能够形成浓缩状态结合并集聚于平台上,从而有利于RNA分子的剪接和运输[10]。
4.3 RNA解旋酶类剪接因子
在酵母细胞中发现一类需要水解特定的核苷三磷酸进而发挥其功能的剪接因子。其中的代表是特定氨基酸位点是天冬氨酸一谷氨酸一随机氨基酸一组氨酸/天冬氨酸基序的核苷三磷酸酶(Asp一Glu一x一His/Asp box NTPase,DExH/D一box NTPase)。这类蛋白质因子具有“解旋酶”的结构域,有类似于核酸蛋白酶(RNPases)的功能,且极为保守。属DExH/D一box NTPases蛋白家族的成员有Prps、Prp2、Prpl6、Prp22和Prp43等。
通过实验,人们发现Ppr5对于剪接复合体的聚合至关重要,Prp2催化复合体构象的改变以顺应第一步的RNA酯交换反应,Prpl6p参与第二步的RNA酯交换反应,Prp22p在mRNA的释放过程中发挥作用,而内含子的释放与Prp43的参与有关。另外,Prp28和Brr2是U5snRNP中的两个DExH/D一box ATPase,它们在U1和U4snRNP从剪接复合体中释放过程中起作用[11]。对于剪接复合体来说,在完成一轮的剪接反应后解聚是很有必要的,因为这对于参与剪接的蛋白质因子的重新利用而促进下一轮的剪接反应很重要。
在剪接催化过程中,U5snRNP扮演了重要角色,而Snull4和Prp8似乎是组成了U5snRNP的核心。其中,Snull4和核糖体转运酶(translocase)EF一G有很高的同源性,Small等[12]发现,Snull4催化GTP水解然后引发剪接复合体激活和解聚。
另外,人们发现一种蛋白复合体Ppr19,又称NTC(NineTeen complex),在剪接过程中加到原先的剪接复合体上[13]。对于U1或者U4的解离,NTC并非必需,但是它们可在U4的解离后在剪接复合体上稳定U5和U6,使得U5和U6与mRNA前体形成一种高度易于催化反应的状态。这表明,NTC在调节复合体结构改变过程中起着关键作用。利用基因工程的方法,目前已鉴定出8种蛋白质因子参与了NTC的组成。这些蛋白质因子是在U4脱离剪接复合体后一起加到复合体上去的,提示这些蛋白质可能以整体的一个复合体的形式发挥功能。
5酿酒酵母和拟南芥的剪接顺式作用元件保守序列的比较(14):
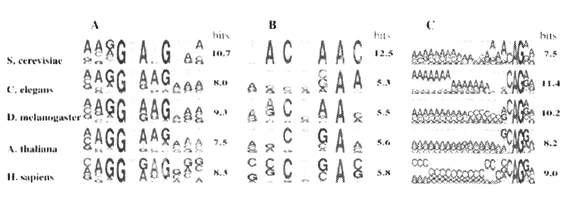
上图中A表示5剪接位点,B表示分支位点,C表示3剪接位点。每个字母的高低对应着碱基在相应位置出现的频率。比较酵母和拟南芥5剪接位点和分支位点,不难发现拟南芥相对酵母碱基出现的频率没酵母的高,相对来说剪切位点碱基保守性不高。所以从序列保守性来看,5剪接位点和分支位点是拟南芥植物基因在酵母中表达比较重要顺式作用元件。
6展望与结语
在多数情况下,真核mRNA内含子的存在可以提高基因的表达水平,因为其剪接过程会影响mRNA新陈代谢的多个阶段,包括转录、RNA编辑、pre-mRNA的加工、mRNA的出核运输、翻译和无义衰变等。真核mRNA内含子在真核生物基因表达调控中起着重要的作用,是转基因研究中提高外源基因表达的重要元件之一。
植物内含子序列在3剪接位点前没有聚嘧啶序列(polypyrimidine tract),也没有保守的分支位点序列和酵母比较。然而,植物内含子富含AU 序列在3剪接位点前。AU-rich 序列在酵母中可能和在植物中的作用相似,能帮助剪接因子识别其他的顺式作用元件例如剪接位点。植物内含子在酵母中表达的过程中可能会出现转录起始位点提前和隐藏剪接位点等复杂的问题。
植物基因在酵母中的表达具有重要的意义,可应用于工程菌,对跨物种基因表达也具有重要的作用。
参考文献:
[1]Bhaskarjyoti, N. C, S.C and A. D (2002).Plant pre-mRNA splicing in fission yeast, Schizosaccharomyces pombe. Biochemical and Biophysical Research Communications.Volume 293, Issue 4.
[2]Sharp, P.A. (1994). Split genes and RNA splicing. Cell 77, 805-815.
[3]Lührmann, R., Kastner, B., and Bach, M. (1990). Structure of spliceosomal snRNPs and their role in pre-mRNA splicing. Biochim. Biophys. Acta 1087, 265-292.
[4]姚晓敏,马涵慧,王灿华,林志新,李伯良(2005)真核生物pre-mRNA剪接的研究进展. 上海交通大学学报(农业科学版),Vol_23 No.1.
[5]Matthew J. S, Dustin B. R and Andrew M. M (2008) Pre-mRNA splicing: a complex picture in higher definition . Trends in Biochemical Sciences. Volume 33, Issue 6.
[6]John W.S. Brown(1996) Arabidopsis intron mutations and pre-mRNA splicing. The Plant Journal. Volume 10 Issue 5, Pages 771 - 780.
[7]Soret J et al. SR proteins as potential targets for therapy. Prog Mol Subcell Biol,2006,44:65-87.
[8]Wang J et al. The Ribosomal Database Project (RDP-II): 15 sequences and tools for high-throughput rRNA analysis. Nucleic Acids Res,2005,33(16): 5053-5062.
[9]Stickeler E et al. p53 Autoantibodies in Patients with Primary Ovarian Cancer Are Associated with Higher Age, Advanced Stage and a Higher Proportion of p53-Positive Tumor Cells Oncology ,1999,18(24): 3574-3582.
[10]Li X et al. New talents for an old acquaintance : The SR protein splicing factor ASF/SF2 functions in the maintenance of genome stability .Cell Cycle,2005,4(12):1706-1708.
[11]沈佳,张耀洲.mRNA前体的剪接因子.生命的化学,2007(27).
[12]Small EC et al. Novel cross-talk between three cardiovascular regulators: thrombin cleavage fragment of Jagged1 induces fibroblast growth factor 1 expression and release. Mol Cell,2006,23(3):389-399.
[13]Tsai RT et al. Spliceosome disassembly catalyzed by Prp43 and its associated components Ntr1 and Ntr2 .Genes Dev,2005,19(24):2991-3003.
[14]Lee P. Land Christopher B. B(2001)A computational analysis of sequence features involved in recognition of short introns. PNAS . vol. 98 no. 20 11193-11198.
