高效液相色谱法测定注射用哌拉西林钠他唑巴坦钠(4∶1)含量及有关物质
2009-07-17周卫民李健和彭六保曹俊华罗霞
周卫民 李健和 彭六保 曹俊华 罗 霞
[摘要] 目的:建立高效液相色谱法测定注射用哌拉西林钠他唑巴坦钠(4∶1)含量及有关物质。方法:色谱柱为Phenomenex C18(250 mm×4.6 mm, 5 μm);流动相为甲醇-水-10%四丁基氢氧化铵溶液(600∶400∶20)(用磷酸调节,pH值为3.5);检测波长为230 nm;流速为0.8 ml/min,柱温为25℃,进样量为20 μl。结果:6批样品中有关物质最大单个杂质的平均含量为0.746%,总杂质的平均含量为2.482%。哌拉西林和他唑巴坦检测浓度的线性范围分别为53.92~215.70 μg/ml(r=0.999 9)和12.72~50.86 μg/ml(r=0.999 8),平均回收率分别为99.9%(RSD=0.51%)和99.8%(RSD=0.40%)。结论:本检测方法灵敏、快速、结果准确,可用于注射用哌拉西林钠他唑巴坦钠(4∶1)的质量控制。
[关键词] HPLC;注射用哌拉西林钠他唑巴坦钠(4∶1);含量测定;有关物质
[中图分类号] R927.2 [文献标识码]A [文章编号]1674-4721(2009)05(a)-007-04
Determination of piperacillin sodium and tazobactam sodium (4∶1) for injection and its related substances by HPLC
ZHOU Weimin1, LI Jianhe2*, PENG Liubao2, CAO Junhua2, LUO Xia2
(1.Department of Pharmacy, Liangang Hospital of Loudi, Loudi 417009, China; 2.Department of Pharmacy, The Second Xiangya Hospital, Central South University, Changsha 410011, China)
[Abstract] Objective: To establish a high performance liquid chromatagraph(HPLC) method for the determination of piperacillin sodium and tazobactam sodium (4∶1) for injection and its related substances. Methods: Thechromatographic separation was performed on a PhenomenexC18(250 mm×4.6 mm, 5 μm)with mobile phases constisted of methanol-water- 10%tetrabutylammonium hydroxide solution(adjust pH to 3.5 with phosphoric acid)(600:400:20) and the flow rate at 0.8 ml/min. The detection wavelength was 230 nm. The column temperature was 25℃ and the sample size was 20 μl. Results: The average contents of the largest single impurity and the total impurities in six batches of samples was 0.746% and 2.842%, respectively. The linearity ranges of piperacillin and tazobactam were 53.92-215.70 μg/ml(r=0.999 9)and 12.72-50.86 μg/ml(r=0.999 8), respectively. The average recovery were 99.9%(RSD=0.51%) and 99.8%(RSD=0.40%),respectively. Conclusion: The method is sensitive, rapid,accurate,and suitable for the quality control of piperacillin sodium and tazobactam sodium (4∶1) for injection.
[Key words] HPLC;Piperacillin sodium and tazobactam sodium (4∶1) for injection;Content determination;Related substance
哌拉西林属酰脲类青霉素,抗菌谱广、抗菌作用强,尤其对铜绿假单胞菌有强大抗菌作用,是目前国内外广泛应用并被认为是最有价值的一类青霉素,但其对β-内酰胺酶不稳定[1-2]。他唑巴坦是一个新的β-内酰胺酶抑制剂,属于青霉烷,在舒巴坦结构的基础上增加了1个三氮唑环,是舒巴坦的衍生物,具有广谱的抑酶活性[2-3]。哌拉西林与他唑巴坦联合后具有良好的协同作用,可增加哌拉西林的抗菌活性,并扩大其抗菌谱,比常用的酶抑制联合制剂,如哌拉西林/舒巴坦、氨苄西林/舒巴坦及替卡西林/克拉维酸的抗菌作用强[4-7]。哌拉西林他唑巴坦复方制剂中,哌拉西林与他唑巴坦的配比有8∶1和4∶1两种。配比为8∶1的复方制剂,由日本大鹏公司研究,1992年后相继在法国、英国、西班牙、德国和美国上市,国内于1999年批准上市。配比为4∶1的复方制剂,由日本富山公司和大鹏公司共同开发,于2001年6月在日本批准上市。文献[8-9]报道哌拉西林/他唑巴坦的最适配比为4∶1。鉴于目前国内未见有4∶1品种开发上市,故研究开发了疗效确切、副反应少、治疗费用相对较低、适用人群更广(不仅适用于成人,而且适用于12岁以下儿童)、使用更为方便(有静脉滴注和推注两种给药方式)的规格为2.5 g的注射用哌拉西林钠他唑巴坦钠(4∶1)。采用高效液相色谱法对其含量测定以及降解产物的检查进行研究,现将研究结果报道如下:

1仪器与试药

1.1 仪器
日本岛津LC-10A高效液相色谱仪;SPD-10A紫外检测器;上海精密科学仪器有限公司FA1004N型电子分析天平。
1.2 实验药品
注射用哌拉西林钠他唑巴坦钠(4∶1)(中南大学湘雅二医院药剂科研制,批号:080105、080106、080107、080108、080109、080110);哌拉西林对照品(中国药品生物制品检定所,批号:134215-200711,含量:90.7%);他唑巴坦对照品(中国药品生物制品检定所,批号:129501-200712,含量:99.3%)。甲醇为色谱纯,其余试剂均为分析纯。

2 方法与结果
2.1有关物质检测
2.1.1色谱条件
2.1.1.1流动相选择:参照文献,适当调节各组分比例,选用甲醇-水-10%四丁基氢氧化铵溶液(600:400:20)(用磷酸调pH值为3.5)为流动相。

2.1.1.2检测波长确定:取本品适量,加流动相溶解,并稀释制成每1毫升中约含哌拉西林10 μg的溶液,照紫外-可见分光光度法(《中国药典》2005年版二部附录Ⅳ A),在200~400 nm波长范围内扫描;另分别精密称取哌拉西林和他唑巴坦对照品适量,加流动相溶解并稀释制成每1毫升中分别约含哌拉西林和他唑巴坦10 μg的溶液,同法操作。结果两种主药均只有紫外末端吸收。考虑到高效液相色谱仪和紫外检测器的灵敏度与稳定性,参照文献中检测波长,将230 nm作为本品有关物质检测波长。
2.1.2 系统适用性试验
取本品适量,精密称定,加流动相溶解,并定量稀释制成每1毫升中约含哌拉西林0.4 mg的溶液,作为供试品溶液。另取流动相适量,作为空白溶液。分别取两种溶液各20 μl注入液相色谱仪,试验结果见图1。结果哌拉西林主峰保留时间为9.883 min,理论板数为6 480,他唑巴坦主峰保留时间为4.263 min,理论板数为4 666。两主峰与相邻杂质峰的分离度均大于1.5。空白无干扰。参考文献[1],规定系统适用性试验中理论板数按哌拉西林峰及他唑巴坦峰计算均应不低于1 600。
2.1.3破坏性试验
精密称取本品适量,加流动相溶解并稀释制成每1毫升中约含哌拉西林0.4 mg的溶液,作为供试品溶液。①酸破坏试验:取供试品溶液10 ml,加浓盐酸1滴,混匀,过滤,取续滤液作为酸破坏供试品溶液;另取浓盐酸1滴,加10 ml流动相稀释,作为酸破坏空白溶液。②碱破坏试验:取供试品溶液10 ml,加饱和氢氧化钠溶液1滴,混匀,过滤,取续滤液作为碱破坏供试品溶液;另取饱和氢氧化钠溶液1滴,加10 ml流动相稀释,作为碱破坏空白溶液。③氧化破坏试验:取供试品溶液10 ml,加高锰酸钾试液1滴,立即过滤,取续滤液作为氧化破坏供试品溶液;另取高锰酸钾试液1滴,加10 ml流动相稀释,作为氧化破坏空白溶液。④热破坏试验:取供试品溶液10 ml,置沸水中加热10 min,取出,放冷,过滤,取续滤液作为热破坏供试品溶液。⑤光破坏试验:取供试品溶液5 ml,于4 500 lx照度下放置24 h,取出,过滤,取续滤液作为光破坏供试品溶液。分别取上述各种溶液各20 μl,注入液相色谱仪,记录色谱图,试验结果见图2。本品在酸、碱、氧化剂、高温和强光照射作用下均发生降解,各条件下杂质峰与两主成分峰均能达到良好的分离。故本色谱条件能够满足有关物质考察的要求。

2.1.4 精密度试验
取本品适量,加流动相溶解,并定量稀释制成每1毫升中约含哌拉西林0.4 mg的溶液,作为供试品溶液。精密量取20 μl,注入液相色谱仪,记录色谱图。如此连续进样6次。结果哌拉西林和他唑巴坦的峰面积分别为10 028 347和820 209,其RSD分别为0.82%和0.80%。本方法精密度良好。
2.1.5 供试品溶液稳定性试验
取本品适量,加流动相溶解,并定量稀释制成每1毫升中约含哌拉西林0.4 mg的溶液,作为供试品溶液。分别于0、1、2、4、6、8 h精密量取20 μl,注入液相色谱仪,记录色谱图,以两成分峰面积的变化为指标考察供试品溶液在8 h内的稳定性。结果见表1。供试品溶液8 h内稳定。
2.1.6 检测限试验
精密称取哌拉西林对照品11.18 mg与他唑巴坦对照品12.26 mg,置100 ml量瓶中,加流动相溶解并稀释至刻度。然后从上述溶液中精密量取1 ml,置100 ml量瓶中,加流动相溶解并稀释至刻度。精密量取1ml,置10 ml量瓶中,加流动相溶解并稀释至刻度。分别取20、10、5 μl注入液相色谱仪,记录色谱图。当进样量为10 μl时,哌拉西林峰与他唑巴坦峰信噪比均为3,哌拉西林和他唑巴坦的最小检出量分别为1.0 ng和1.2 ng。
2.1.7 测定法
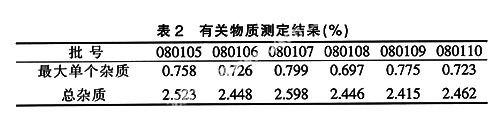
取本品适量,精密称定,加流动相溶解并定量稀释制成每1毫升中约含哌拉西林0.4 mg的溶液,作为供试品溶液;精密量取适量,用流动相定量稀释制成每1毫升中约含哌拉西林16 μg的溶液,作为对照溶液。照上述色谱条件下的方法试验,取对照溶液20 μl注入液相色谱仪,调节仪器灵敏度,使哌拉西林峰高为满量程的20%~25%。再取上述两种溶液各20 μl注入液相色谱仪,记录色谱图至哌拉西林峰保留时间的2倍,供试品溶液如显杂质峰,量取各杂质峰面积,其中最大单个杂质峰的峰面积不得大于对照溶液中哌拉西林和他唑巴坦两主成分峰面积和的一半(2.0%);各杂质峰面积的和不得大于对照溶液中哌拉西林和他唑巴坦两主成分峰面积的和(4.0%)。各批样品有关物质测定结果见表2。

2.2 含量测定
2.2.1 色谱条件
同有关物质项下。
2.2.2 线性关系试验
精密称取哌拉西林对照品148.96 mg和他唑巴坦对照品32.08 mg,置50 ml量瓶中,加流动相溶解,并稀释至刻度。分别精密量取1.0、1.5、2.0、2.5、3.0、4.0 ml,置50 ml量瓶中,加流动相稀释至刻度,取20 μl注入液相色谱仪,记录色谱图。以哌拉西林峰面积A1为纵坐标,哌拉西林浓度C1(μg/ml)为横坐标,进行线性回归,得回归方程:A1=25 663 C1+5 487.8,r=0.999 9。以他唑巴坦峰面积A2为纵坐标,他唑巴坦浓度C2(μg/ml)为横坐标,进行线性回归,得回归方程:A2=8 436.1 C2-291.02,r=0.999 8。试验结果表明:哌拉西林溶液在53.92~215.70 μg/ml浓度范围内,他唑巴坦溶液在12.72~50.86 μg/ml浓度范围内均与相应峰面积呈良好的线性关系。色谱图见图3。
2.2.3 供试品溶液稳定性试验
精密称取本品适量,加流动相溶解并稀释制成每1毫升中约含哌拉西林和他唑巴坦分别为0.100 mg和0.025 mg的溶液,作为供试品溶液,分别于0、1、2、4、6、8 h精密量取20 μl,注入液相色谱仪,记录色谱图。试验结果见表3。含量测定供试品溶液在8 h内较为稳定。
2.2.4 精密度试验
精密称取本品适量,加流动相溶解并稀释制成每1毫升中约含哌拉西林和他唑巴坦分别为0.100 mg和0.025 mg的溶液,作为供试品溶液,精密量取20 μl,注入液相色谱仪,记录色谱图,连续进样6次。结果哌拉西林和他唑巴坦的峰面积分别为2 415 379和198 180,其RSD分别为1.29%和0.71%。本方法精密度良好。

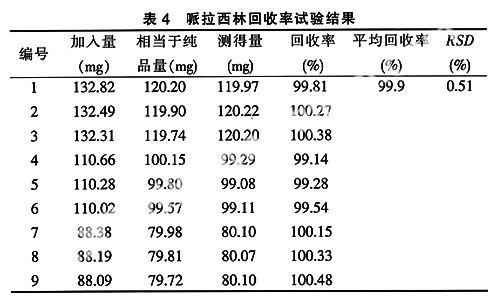
2.2.5 回收率试验
分别精密称取哌拉西林对照品约80、100、120 mg各3份,分别精密称取他唑巴坦对照品约20、25、30 mg各3份,各分别置于9个100 ml量瓶中,按处方分别加入相应量的哌拉西林钠和他唑巴坦钠原料药适量,各制成模拟样品共9份。取各份模拟样品,分别加流动相溶解并稀释至刻度,摇匀。分别精密量取5 ml,置50 ml量瓶中,加流动相溶解,并稀释至刻度。另取哌拉西林对照品适量和他唑巴坦对照品适量,精密称定,用流动相溶解并稀释制成约含哌拉西林和他唑巴坦分别为0.1 mg/ml和0.025 mg/ml的溶液。分别精密量取上述各种溶液20 μl,注入液相色谱仪,记录色谱图,按外标法以峰面积计算,即得。结果见表4和表5。本方法回收率良好。
