论高一化学“粗盐提纯”实验的不足
2009-07-13许晨恋
许晨恋
摘要:对上海市二期课改修订版高一化学学生实验“粗盐提纯” 在实验目的、实验内容上的不足提出了修改。
关键词:可溶性杂质;沉淀法;过量试剂
文章编号:1005-6629(2009)05-0017-03中图分类号:G633.8文献标识码:C
在二期课改《化学》教材中,“粗盐提纯”这一实验设置在了九年级第一学期和高中一年级第一学期,充分突显了该实验在化学教学中的重要性。
然而反观两个年级“粗盐提纯”实验报告,有着区分度不高,内容类似的弊病。除了在《化学练习部分高中一年级第一学期(试用本)》【实验二 粗盐提纯】中增加了“用少量蒸馏水洗涤晶体”的这样简单的一步,两个实验无论从实验的目的性(掌握从固体混合物中去除不溶性杂质即粗盐中的细沙)或是实验的基本操作(溶解过滤蒸发)上都近乎相同。从本质上来说,高中进行该实验只是机械地重复了初中的内容,而未做任何提高。这样的设计不符合学习的特点。学习是进阶型的,在知识的阶梯上同学们拾级而上,层层深入,直到迈向知识的最高殿堂。而教师起到的作用就是授之以“渔”,常教常新,如此才能强化学生的感知态度,促进学生自我思考发展。
《化学高中一年级第一学期(试用本)》第23页图2.1《天工开物》中制海盐图中,古人采取“先日撒灰,日中扫盐”的方法,其中的“灰”即指能除去某些可溶性杂质的草木灰。第24页提供了表2.1“海水在浓缩过程中析出盐的种类和质量”,已经明确指出:在由海水浓缩得到的粗盐中往往存在这样的几种微量杂质:MgCl2、MgSO4、CaSO4。在第30页【思考与复习2.1】中第2题又提出了“在粗盐提纯中,通常在溶液中依次加入BaCl2、NaOH和Na2CO3,以除去SO42-(Na2SO4)、Mg2+(MgCl2)和Ca2+(CaCl2)”。以上三处在课本中出现的内容,足以说明对于粗盐中一些可溶性杂质的去除,是这一节学习的重中之重,是对九年级粗盐提纯的深化和补充。问题的探索已经让学生的心动起来,现在是时候“励其行、促其思、放其手”了。只有通过对粗盐中可溶性杂质(如硫酸钠、氯化镁、氯化钙等)去除的“实践”,才能完成他们对化学体系中除去纯净物中的杂质这一整体的“探究”。
考虑到高中教学的系统性、严密性和丰富性,首先,我将实验名称更改为【粗盐提纯2】;同时在【实验目的】的表述上添加并着重于“掌握溶液中可溶性杂质的去除方法”,较原实验目的性有了本质的改变与提升。
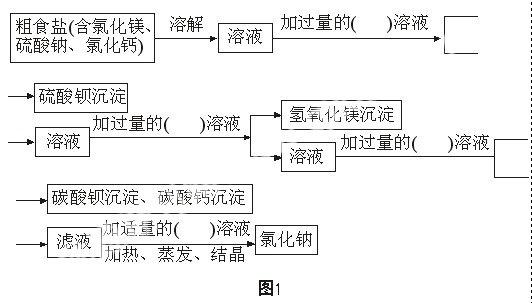
在实验进行的具体过程中,应体现出丰富性。原实验报告中采用了“水洗法去杂”,由于步骤实在过于简单,导致了与九年级实验报告有如“双胞胎”的严重问题,无法让同学们真正深切体会到粗盐提纯的另一个重要点——可溶性杂质的去除。这样的漏洞,不免使高一的同学对于化学学习的丰富性产生怀疑,成为以后在化学学习上产生倦怠的隐患。为此,我在实验报告中添加了【实验原理】这一块内容,其好处在于(1)点明了实验中采用的去除可溶性杂质的方法为“沉淀法”,让同学有据可寻;(2)增加了实验过程流程图,使整个实验步骤豁然开朗。(具体见实验报告)
当然,实验中的严密操作是启发同学思考的关键。首先,在加水溶解时,对所加水量的控制,牵涉到“让固体完全溶解”与“蒸发中所需的时间”这两个条件,为了使同学们思考全面,将此问题作为了【思考与讨论】第一题出现。其次,硫酸钠、氯化钙、氯化镁三种杂质去除,必然存在先后顺序,对于孰先孰后的讨论,能提高同学们思维的严密性。最后,在以沉淀法去杂过程中,为保证可溶性杂质全都转化为沉淀,就必需添加过量的除杂剂,在将碱性溶液还原到氯化钠溶液时,则只能添加适量的盐酸。实验中的“3个过量” “1个适量”引出了对于“量”这个概念的严格取用。(具体见实验报告)
综上所述,我设计了如下实验
实验报告粗盐提纯2
【实验目的】
1. 初步掌握溶液中可溶性杂质的去除方法
2. 学会从粗盐提纯氯化钠的基本原理和方法
3. 熟练掌握溶解、过滤、蒸发和结晶等基本操作
【实验原理】
化学试剂和医院用的氯化钠都是以粗食盐为原料提纯的。粗食盐中,含有不溶性杂质和Ca2+、Mg2+、SO42-等可溶性杂质。从粗食盐提纯氯化钠,要选择合适的试剂,使氯化镁、氯化钙、硫酸钠转变成沉淀而除去,此法称“沉淀法”。
为了使杂质充分沉淀而除去,所加试剂(又称沉淀剂)必须是过量的。加入过量的试剂必然会引入新的杂质,因此要设计几种试剂加入的先后顺序,最后必须除尽各种杂质(包括加入的过量试剂),得到纯净的氯化钠。
设计从粗食盐提纯氯化钠的实验方案,填写下列实验框图1所示流程。
【实验用品】
100 mL烧杯(2只)、 250 mL烧杯、玻璃棒、铁架台(带铁圈)、石棉网、天平、100 mL量筒、酒精灯、漏斗、滤纸、蒸发皿、火柴、剪刀
粗食盐(含少量硫酸钠、氯化钙、氯化镁)、2 mol/L盐酸、1 mol/L氯化钡溶液、1 mol/L氢氧化钠溶液、饱和碳酸钠溶液、pH试纸、蒸馏水
【实验内容】
1.称量:用天平称取10 g粗盐,用量筒量取蒸馏水35 mL, 放入100 mL烧杯中
2.溶解:将该烧杯放在铁架台铁圈上隔着石棉网加热、搅拌,加速食盐的溶解
3.去除硫酸钠: 继续加热溶液近沸腾, 加入 1 mol/L 氯化钡溶液2-3 mL。观察到__________,反应的化学方程式_________________________。继续加热上述悬浊液4分钟。待沉淀沉降,在上层清液中加1-2滴氯化钡溶液,仔细观察,溶液不出现浑浊,表示硫酸钠______________________。如出现浑浊,继续加入1 mL 1 mol/L氯化钡溶液,重复上述操作,直到硫酸钠除尽为止。
4.除去氯化镁: 加热烧杯中液体近沸腾,边搅拌边滴加1 mol/L氢氧化钠溶液,直到不再产生沉淀为止。待沉淀全部沉降,取上层清液,检查氯化镁是否去除尽。
5.除去_____、_____: 在上述液体中滴加饱和碳酸钠溶液,直到不再产生沉淀为止。书写化学方程式______________,____________________。取上层清液,检查杂质是否除尽。
6.过滤: 制作过滤器,装配好过滤装置,过滤烧杯中液体,除去不溶性杂质。
7. 除去碳酸钠:待冷却后在上述滤液中滴加2 mol/L 盐酸,直到溶液pH值为7。
8.蒸发: 将滤液转移入蒸发皿中,加热搅拌,至有较多食盐析出时停止加热,利用余热使溶液蒸干。
9.称量: 用天平称量精盐。
【实验记录和计算】
粗盐的质量是_____________g。
精盐的质量是_____________g。
粗盐提纯精盐的收得率:(精盐的质量÷粗盐的质量)×100%=_____________。
【思考和讨论】
1.为什么10 g粗盐要量取35 mL左右水来溶解?食盐常温下的溶解度约36 g/100 g水,试通过计算回答。
2. 在去除杂质的过程中,给溶液加热有什么好处?
3. 粗盐提纯过程中,几次用到玻璃棒,每次的作用各是什么?
4. 为了除去粗盐中的可溶性杂质及泥沙,可将粗盐溶于水,然后进行五项操作:①过滤②加过量氢氧化钠溶液③加适量盐酸④加过量碳酸钠溶液⑤加过量氯化钡溶液。正确的操作顺序为()
(A)⑤、②、④、①、③ (B)④、①、②、⑤、③
(C)②、⑤、④、①、③ (D)①、④、②、⑤、③
5. 当粗盐中的可溶性杂质都是微量的时候,可以用什么方法简单去除杂质?
6. 分析自己实验操作中有哪些不足之处,如何改进?
修改后实验的优点在于:
(1)以【实验原理】作为基础导向,其中增设的填空引发同学思考,促使他们未行先想,利于培养他们用审视的态度去证实知识形成过程的胆略。
(2)较原实验强调了可溶性杂质去除的具体步骤与先后顺序,完整了同学除去杂质的系统思维法。
(3)通过对“3个过量”“1个适量”的操作与讨论培养量化的严密性。
(4)增加了溶液中可溶性杂质是否彻底去除的判断,丰富了实验内容,增强了趣味性。
(5)以硫酸钠杂质是否除尽为标准,由同学自行推导出判断其他杂质是否除尽的方法,提高了同学归纳小结的能力。
(6)实验内容关于除去杂质内容的填空,提高了同学分析问题的能力;思考与讨论中第5题以“水洗法”除杂涵盖了原实验的主要内容,提高了同学解决问题的能力。
(7)实验中的部分填空,巩固了方程式的书写;实验现象也较原实验更直观生动。
(8)辨析了各种仪器的不同加热方法,强化了实验的操作能力。
(9)剔除了原【思考与讨论】中的某些与九年级教材相同的提问,避免重复。增设了选择题丰富题型,降低了难度,同时概括了添加沉淀剂先后顺序对提纯结果有无影响,培养学生严密地思考问题及解决问题的能力。
(10)整个实验紧扣教材内容,强调了理论结合实际的主旨。
