建立更加稳定和有效的兔耳瘢痕模型
2009-03-30冯登超杨喜明薛宏斌贺光照
冯登超 杨喜明 薛宏斌 贺光照
[摘要]目的:建立更加稳定和有效的兔耳瘢痕模型。方法:选用16只新西兰大耳白兔,分别在兔耳腹侧中段作1cm×1cm的全层皮肤缺损共192个,以形态学、瘢痕增生指数及羟脯氨酸(HPr)的含量变化对创面愈合后形成的增生块,进行动态组织病理学、细胞增殖活性及胶原纤维合成等检测。结果:兔耳腹侧中段创面可产生类似于人类的增生性瘢痕,其发生率为 91.5%,增生块最长持续时间可达120多天。结论:采用本实验的模型复制方法,可以得到更加稳定和有效的兔耳增生性瘢痕。
[关键词]瘢痕;动物模型;羟脯氨酸
[中图分类号]Q813.1[文献标识码]A[文章编号]1008-6455(2009)02-0191-04
Establishment of an animal model for hypertrophic scar
FENG Deng-chao,YANG Xi-ming,XUE Hong-bin,HE Guang-zhao
(1.Department of Plastic and Burning Surgery,Yan'an University Affiliated Hospital , Yan'an 716000,Shaanxi,China; 2.Department of Plastic and Burning Surgery,the First Affiliated hospital ,Chongqing Medical University,Chongqing 400016,China)
Abstract:ObjectiveTo establish stable and reliable animal model of rabbit ear for hypertrophic scar.MethodsFull skin defect ( 1cm×1cm in diameter)was created on the ventral side of 32 ears in 16 New Zealand white rabbits.Wound healing under natural condition was observed continuously after the operation. The scar proliferation and index on the rabbit ears were observed by light microscope,the scar HPr content was determined by improved chloraseptine Toxidizing assay.ResultsThe animal model of hypertrophic scar induced by full thickness skin wounds on the ventral side of rabbit ears was similar to that in humans.Its incidence was 91.5 %.The hypertrophic scar could last 120 days.ConclusionFull thickness skin wounds on the ventral side of rabbit ears could produce stable and reliable hypertrophic scars.
Key words: scar;mode1 animal;HPr
增生性瘢痕(hypertrophic scar,HS)是常见的病理性瘢痕,一直都是整形外科和创伤外科研究的热点和难点问题,但其机理到目前尚未明确[1]。对其发生机制和防治的研究一直进展甚微,最主要的原因是目前尚缺乏一种合适的动物模型。尽管曾有人采用了将人增生性瘢痕移植于裸鼠皮下的动物模型[2],但在有免疫缺陷的动物身上实验,很难得出符合客观实际的结论;1997年Morris等[3]观察到兔耳内侧皮肤损伤后有真皮增生现象,并初步建立了急慢性瘢痕模型,为进一步研究提供了一种新的途径,但仍存在复制成功率低等缺点。本实验的目的是通过改进Morris的方法,建立一种更加稳定、有效、复制率高的动物瘢痕模型。
1材料和方法
1.1 实验材料:选用新西兰大白兔16只,2.3~2.5kg,兔耳健全,雌雄不拘,购自重庆医科大学动物实验中心(动物合格证号SCXK(渝)20020001),分笼饲养。
1.2 实验方法
1.2.1 兔耳增生性瘢痕模型的制作:将动物适应性饲养1周后,瘢痕模型的制作参照Morris等[3]和李荟元等[4]方法,并加以改良,用30g/L戊巴比妥钠1.0ml/kg (30mg/kg)作耳缘静脉麻醉,兔耳腹侧面皮肤碘伏、乙醇消毒,严格无菌操作技术下,在兔耳腹侧中段沿长轴避开可见血管,作1cm×1cm大小创面,创面间隔1cm以上,去掉兔耳全层皮肤并用刮勺彻底刮除软骨膜,创缘用电烙铁烧灼,每耳6处(见图1),共192个创面,术后创面暴露,待其自行愈合。
1.2.2形态学观察及标本的收集:术后第1、2、4、6、8、10、12、14、16、18、20天观察创面愈合情况。术后第3、7、11、14、18、28、56、84天 同样用30g/l戊巴比妥钠作耳缘静脉麻醉,每次随机处死2只兔子,切取标本, 切口在创面边缘,垂直于兔耳皮肤表面,深及软骨表面。将每个标本平均分成2份,1份用4%多聚甲醛固定24h,常规脱水,透明,包埋,切片,然后分别进行HE、VG染色;1份用液氮快速冷冻,后转为低温冰箱-80℃保存, 氯胺-T 法测定HPr含量。这样在每个时间点,每组有24个标本,共8组。
1.2.3主要观察和检测的指标:①创面愈合情况、上皮化时间及瘢痕增生情况;②瘢痕增生指数的变化;③瘢痕发生率;④增生块组织中HPr的含量变化。
1.2.4 HPr含量测定[5-6]:标本称重后匀浆,加入2mg/ml胃蛋白酶溶液1ml,4℃冰箱过夜,16 000rpm离心,取上清液0.5ml加6mol/ml 浓盐酸1.5ml,封入安瓿瓶中,125℃烤箱3h。冷却后加10mg/ml氢氧化钠1.5ml,调pH 值至5~7,蒸馏水稀释至5ml。取样本1ml 加入柠檬酸缓冲液0.5ml、0.05mol/l氯胺-T 1ml氧化6min,加入3.15mol/ml过氯酸终止氧化5min,加入10%对二甲氨基苯甲醛1ml,100℃水浴2min,显色后560nm比色。标准管中加入10μg/ml的L-HPr,空白管调零。最终结果计算:每克组织中HPr含量(mg/g)= 测量管光度值÷标准管光度值×10(μg/ml)÷100÷标本重量。
1.3 统计学处理:每组样本数据以表示,用SPSS13.0统计分析软件t检验及方差分析。
2结果
2.1 形态学变化及平均愈合时间:兔耳腹侧全层皮肤缺损首先以血凝块充填,随后代之以肉芽组织,创面有少许渗出液。肉芽组织鲜红,易出血,生长速度较快,但软骨表面没有肉芽组织生长。至伤后第6天创面比较干燥(见图1),伤后第11~14天可见创面收缩,第l5~17天可见软骨周边己干燥坏死并向创面内卷曲,周围上皮及肉芽组织在坏死软骨下向中心生长,创面周围皮肤隆起,第l9~22天干燥坏死软骨脱落,创面愈合,平均愈合时间(19.4±2.3)天,愈合区明显高于周围正常皮肤,此硬块不断高出皮面,开始呈淡红色,在伤后第28天左右增生达到高峰(见图2),其增生范围不超过原创缘,厚度约为耳厚的3倍,增生性瘢痕表面无皮肤附件。伤后第56天左右增生性瘢痕开始软化,色泽变淡,但仍高出皮面(见图3),逐渐进入消退期。伤后第84天增生性瘢痕,颜色接近兔耳正常肤色,略高出皮面,表面平整,触之质软(见图4)。兔耳增生性瘢痕可持续3~4个月。
2.2 组织学结果:HE染色显示在术后第28天增生性瘢痕组织真皮层明显增厚,为周边正常真皮层厚度的3.0~4.0倍,真皮中含大量排列致密、粗大的胶原纤维,排列混乱,呈旋涡状或结节状,形成胶原结节(见图5),其间有少量炎性细胞。第56天可见真皮中成纤维细胞数目减少,血管数量减少,管腔闭塞,胶原纤维减少(见图6),逐渐进入消退期。
2.3 HI及瘢痕发生率测定:术后第18、28、56和84天标本同时进行显微镜下用测微尺测量瘢痕的相对增生厚度,设定瘢痕的高度(Scar height)为SH,正常皮肤高度(dermis height)为DH,则瘢痕增生指数(Hypertrophic Index,HI)HI=SH/DH。瘢痕组织高度≥2mm,硬度与兔耳软骨相似时即为增生性瘢痕[7]。
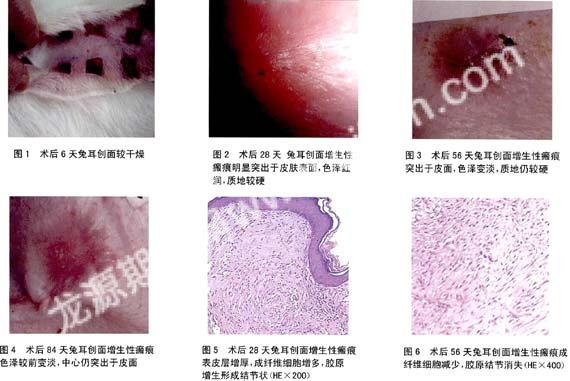
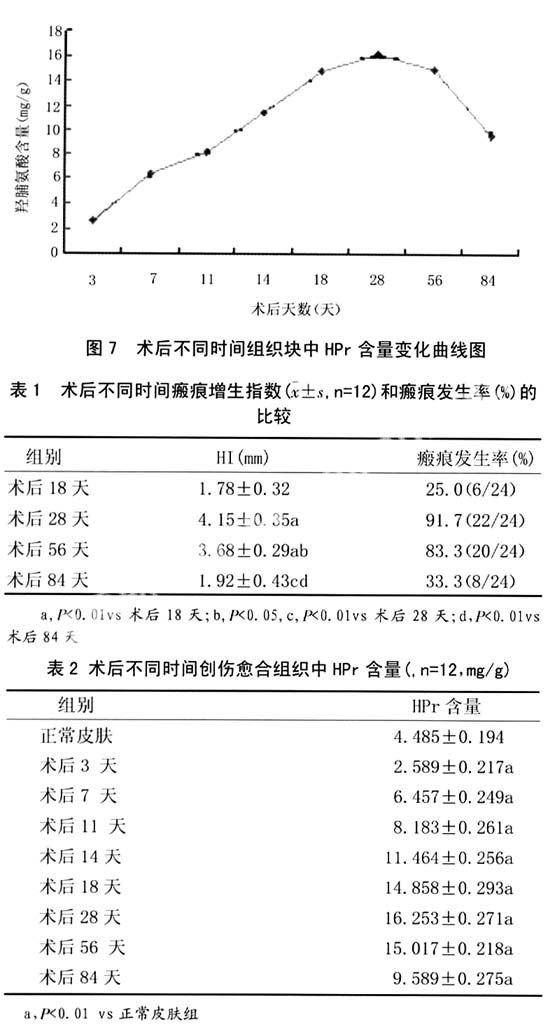
表1结果显示,术后第28天组和56天组HI分别为4.15mm、3.68mm,与术后第18、84天组进行比较,差异均有显著性意义(P<0.05)。术后第18天瘢痕发生率只有25%,而术后第28天瘢痕发生率高达91.7%,术后第56天仍维持在较高水平,至术后第84天仍有33.3%的瘢痕HI大于2mm。
2.3 HPr测定:表2和图7结果显示,术后第7天创缘内组织块的HPr含量开始增加,但增加不显著,而术后11~18天,突出组织块的HPr含量显著增加,至28天达到高峰,约为正常皮肤HPr含量的3.6倍,56天以后开始逐渐下降。各组与兔耳正常皮肤组比较,差异均有显著性意义(P<0.01)。
3讨论
在创伤愈合的研究中,人与动物的伤口都可以出现瘢痕性愈合,但是增生性瘢痕在动物身上很少出现,建立有效和稳定的增生性瘢痕动物模型比较困难。现有关于病理性瘢痕的研究资料,主要来源于三种途径:一是通过体外瘢痕组织培养的成纤维细胞进行相关研究;二是将人的病理性瘢痕组织移植到裸鼠的皮下,借助对寄生状态下的瘢痕组织进行观察;三是通过临床病例的观察及术后标本的分析研究。这些方法都有一定的缺憾:①成纤维细胞体外培养体系是体外实验,无法很好的模拟人体内环境和条件;②将人的增生性瘢痕组织移植于裸鼠皮下,它并不是动物自身产生的瘢痕组织,被移植的人类瘢痕组织脱离了人体环境,是“寄生”于裸鼠身上,对于这种处于非生理环境下的组织,想要研究观察瘢痕的发生、发展及转归的全过程是不可能的;其不能完整反映创面愈合至增生性瘢痕形成整个动态变化过程,得出的实验结果可能会有一定的偏差[2];③临床观测无法细致的研究瘢痕的发生、发展及转归。然而,只有在动物本身产生的瘢痕模型上,才能更确切、更直接、更深入地研究瘢痕发生、发展及其转归。
以往由于缺乏动物自己产生的增生性瘢痕动物模型,对创面愈合的研究和增生性瘢痕的研究不能互相联系。最近,第四军医大学李荟元等[8]研究建立的兔耳增生性瘢痕模型,为这两个方面研究的结合提供了条件。李希军等[5,9]研究发现保留软骨去除软骨膜可以获得更大的瘢痕并且延长瘢痕的增生期,因为裸露的软骨无组织营养而导致部分软骨坏死,肉芽生长是通过溶解作用从坏死软骨下向中心生长,延缓了创面愈合速度,导致肉芽组织在创面周围的堆积,最后形成较大的瘢痕。
本实验HPr含量测定结果显示,术后7天创缘内瘢痕组织的HPr含量开始增加,但增加不显著,而术后第11~18天,突出瘢痕组织内的HPr含量显著增加,至28天达到高峰,56 天出现下降趋势。
以往有关兔耳模型瘢痕发生率和HI的报道比较多,但术后瘢痕发生率一般不超过80%[6,10]。测定HI及瘢痕发生率结果显示,本模型在牛扶幼等[11]方法上稍有改进,术后第28天组和56天组HI分别为4.15mm、3.68mm,与术后第18、84天组进行比较,差异均有显著性意义(P<0.05)。术后第28天瘢痕发生率高达91.7%,术后第56天仍维持在83.3%较高水平,至术后第84天仍有33.3%的HI大于2mm。结果可见,经改良后兔耳创面瘢痕具有很好的有效性和稳定性。保留软骨,切除皮肤并刮除软骨膜,由于加深了对创面的损伤程度,从而延缓了创面愈合的速度,因此兔耳创面能产生更加稳定和有效的增生性瘢痕。本模型可以用作动态的研究药物防治增生性瘢痕的实验动物模型。
[参考文献]
[1]Burd A ,Huang L.Hypertrophic response and keloid diathesis:two very different forms of scar[J].Plast Reconstr Surg,2005,116(7):150e-157e.
[2]刘宏亮,吴宗耀.肥厚性瘢痕移植至裸鼠后的病理学观察[J].第三军医大学学报,1994,16(6):434-436.
[3]Morris DE,Wu L,Zhao L,et al.Acute and chronic animal models for excessive dermal scaring:quantitative studies[J]. Plast Reconstr Surg,1997,100(3):674-681.
[4]李荟元.创伤研究动物模型--兔耳瘢痕模型的建立与应用[M].西安:第四军医大学出版社,2005:42-43;74-76.
[5]李希军,柳大烈,张阳.透明质酸及透明质酸酶对兔耳创面增生性瘢痕形成影响的对比研究[J].中华医学美学美容杂志,2001,7(4):194-197.
[6]舒彬,郝林林,吴宗耀,等.兔耳增生性瘢痕的形态学观察与羟脯氨酸含量变化[J].第三军医大学学报,2001,23(3):343-345.
[7]张选奋,郭树忠,张琳西,等.IFN-γ抑制兔耳皮肤伤口愈合和瘢痕增生中蛋白激酶C的活性变化[J].中华整形外科杂志,2006,11(6):442-444.
[8]李荟元,刘建波,兰海.建立增生性瘢痕动物实验模型[J].第四军医大学学报.1998,19(6): 655-657.
[9]李希军,柳大烈,王吉慧.兔耳增生性瘢痕动物模型建立方法的探讨[J].中国美容医学,2006,15(6):499-500.
[10]周勤生,马少林,董祥林.兔耳增生性瘢痕动物模型的建立与应用[J].新疆医科大学报,2005,28(8):746-748.
[11]牛扶幼,牛永敢,陈言汤.兔耳增生性瘢痕模型的建立[J].中国医学工程,2004,12(5):12-14;17.
[收稿日期]2008-10-11[修回日期]2008-12-22
编辑/张惠娟
