不同运动负荷大鼠心肌胶原纤维形态学变化特征的电镜观察
2008-11-17赵冰王庆志文小军王立东张曦
赵 冰 王庆志 文小军 王立东 张 曦
(1.郑州大学第三附属医院妇产科,河南 郑州 450052;2.河南省食管癌开放实验室,河南 郑州 450052;
3.新乡医学院人体解剖学教研室,河南 新乡 453003)
摘 要:目的:通过电镜技术观察不同运动负荷下心肌胶原纤维的形态学变化特征。方法:将36只Wistar大鼠随机分成对照(C组)、一般运动负荷组(NS组)、超负荷(O组),每组各12只,分别给予一般负荷、中等负荷、超负荷的运动训练。8周后, 断头处死,取出心脏左心室前壁、左室乳头肌处两组组织块分别作透射和扫描电镜观察。结果:正常组胶原纤维的形态分为粗纤维、细纤维和微细纤维三种;心肌结构完整。一般运动负荷组,心肌束间或肌束内较粗胶原纤维大量增生;心肌细胞体积略显增大,体积增大。超负荷组,心肌细胞间胶原纤维大量增生,心肌束间或心肌束粗大胶原纤维过度增生。结论:运动超负荷可致胶原纤维增生,从而导致心肌扩张功能与收缩功能的降低。
关键词:运动负荷;胶原纤维;超微结构;心脏
中图分类号:G804.2文献标识码:A文章编号:1007-3612(2008)10-1365-04
Morphology Changes of Collagen Fibers in Rats Heart in Electronmicroscope under Different Exercise Loads
ZHAO Bing1,2, WANG Qing-zhi3, WEN Xiao-jun3, WANG Li-dong2, ZHANG Xi1
(1.Third Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan China; 2. Laboratory of esophageal cancer in
Henan Province, Zhengzhou 450052, Henan China; 3. Xinxiang Medical College, Xinxiang 453003, Henan China)
Abstract:Objective: To observe the changes of collagen fibers in rats' cardiac muscle (CM) in electron microscope under different exercise loads. Methods: Thirty-six rats are divided into control group (C group), normal swimming group (NS group) and overload group (O group) .Three groups are given normal, middle and overload swimming training respectively for 8 weeks. Then all rats are killed by decapitation, and taken out the antetheca and papillary muscle of left ventricle, and the changes of collagen fibers are observed through transmission and scanning electron microscope. Result: In control group, crude fibers, small fibers and microfilament of collagen fibers can be seen, and the cardiac muscle architectonic is integrated. In normal swimming group, the crude fibers much increase in muscle bundle blank and muscle bundle inner. And the bulk of cardiac muscle cell slightly increases, the number of mitochondrion increases. In overload group, the crude fibers remarkably increase in muscle bundle blank, and the cardiac muscle architectonic is destroyed. Conclusion: Overload training can lead to the crude fibers of cardiac muscle cell increasing, and it may be lead to broaden function and retracted function depressing.
Key words: exercise load; crude fiber; ultramicrostructure; heart
心肌是由心肌细胞和心肌间质(extracellular matrix, ECM)构成,心肌间质又以胶原纤维为主,构成心肌的框架结构,是维持心脏结构和功能不可缺少的重要组成部分。近年研究表明,心肌胶原纤维不仅对心肌细胞具有支持和连接作用,而且在协调心肌肌力的传递、营养物质的输送、信息的传递等方面都起着重要的作用[1]。通过电镜观察不同运动负荷下心肌胶原纤维的形态学变化特征及其对心功能的影响,为最终阐明运动与心脏的生理、病理变化机制提供理论依据,并为科学制定训练计划和有效预防心脏损提供理论依据。
1 材料和方法
1.1 动物分组和训练 ┆雄性Wistar大鼠36只,体重180~220 g(新乡医学院实验动中心提供),随机分成3组,每组12只: 对照组,常规饲养,不加干预;一般运动负荷组,进行中等强度游泳训练,游泳池体积为200 cm×70 cm×80 cm,水深60 cm,水温34~36℃,每周训练6 d,1次/d。第一次下水10 min,此后逐日累加到第1周末时游泳时间达到60 min,第2周末时每天达到120 min。以后维持这一运动量直至第8周; 超负荷组,前2周的训练安排同一般运动负荷组,第3周给予高强度训练:开始时每天在大鼠尾部负体重1%的重量游120 min。以后逐渐增加负重,在周末时负重重量达到体重4%~5%。从第4周开始每天上、下午各训练一次,游泳时人为地用玻璃棒驱赶大鼠使其不停游动,发现有力竭表现时(在水下10 s不能浮上),捞上水面休息5 min后继续训练至满120 min,以后保持这一运动量直至第8 周[3~5]。
1.2 标本收集与切片制作 ┆各组大鼠训练满8周后断头处死,取出心脏左心室、左乳头肌处取两组组织块分别作透射和扫描电镜观察。透射电镜组织块大小均为1 mm×1 mm×1 mm,前者置入4%戊二醛固定液,4℃固定。然后组织块经1%锇酸后固定、脱水、包埋、超薄切片、染色后在日立H-7500透射电镜下观察组织亚微结构。扫描电镜的组织块大
小分别为2 mm×3 mm×5 mm, 呈成条状,4%戊二醛4℃固定, 经冲洗、脱水、干燥、喷金后在扫描电镜下观察、照相。
2 结 果
2.1 不同运动负荷组左心室与左乳头肌扫描电镜观察
2.1.1 正常组左心室与左乳头肌胶原网络的立体形态 在扫描电镜下,心肌胶原纤维比较丰富。胶原纤维呈粗纤维、细纤维和微细纤维三种。粗纤维数量较少,跨越若干个心肌细胞,环绕与心肌细胞群外,有纵、横两种走向,纵向纤维体平行,横向纤维与心肌细胞近乎垂直比心肌细胞大,似“腰带”状把心肌细胞捆扎成束。横向纤维再走行上可以发出分支或斜行。细纤维数量较多,从层面上看,位于粗纤维深层,连于粗纤维之间,交织成网。细纤维的编制形式复杂,规律性不明显。细纤维一般比较短,在几个心肌细胞表面,或跨越邻近的几个细胞(图1)。细纤维可以是粗纤维的分支,向深层像树根一样延伸为微细纤维。微细纤维紧贴心肌细胞表面,排列紧密而细腻,形似“毯膜”,包裹心肌细胞。正常情况下微细纤维形成心肌细胞完整的膜鞘。在相邻的心肌细胞边缘微细纤维存在局部交织粗、细、微细三种胶原纤维相互交织,形成层次分明、立体明显的胶原网络结构,均有一定张力。在心肌细胞表面贴附一些散在的大小不等纤维细胞,有些纤维细胞被悬吊在纤维网之间,形成了细胞外的一个三维空间结构(图2)。

图1 正常组左心室肌,图2 正常组左乳头肌,
扫描电镜,×1 200扫描电镜,×2 000
2.1.2 一般运动负荷组胶原纤维变化情况 一般运动负荷组时,心肌束间或肌束内较粗胶原纤维大量增生,呈“条索状”或“树枝状”样向下逐级延伸,呈波浪形弯曲或线形分布,并相互交织,网络着心肌束(图3)。在乳头肌上也可见到胶原束打成的结节,粗细不等的胶原纤维多呈“条索状”以垂直或斜交的方式借肌内膜心肌纤维连接。心肌细胞肥大且细胞间胶原纤维连接紧密(图4)。
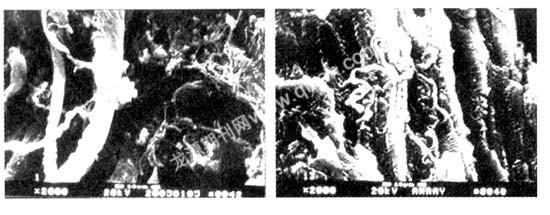
图3 一般负荷组左心室肌,图4 一般运动负荷组左乳
扫描电镜,×2 000头肌,扫描电镜,×2 000
2.1.3 运动超负荷组胶原纤维变化情况 超负荷组,心肌细胞及细胞群间胶原纤维大量增生,胶原从粗到细分级明显,从一大束胶原形成的结节处向下均为细胶原,相互交织成网形成心肌细胞的“网格状”居室,包裹着心肌细胞(图5);在心肌束间或心肌束过度增生的粗大胶原纤维成束成网呈波浪状、螺旋式或网格型相互编织分布,粗细明显分级分布,细纤维形成明显的网格,心肌束间隙较粗的胶原纤维向心肌层伸入;同时发现左乳头肌有肌纤维与胶原纤维断裂现象(图6、7)。
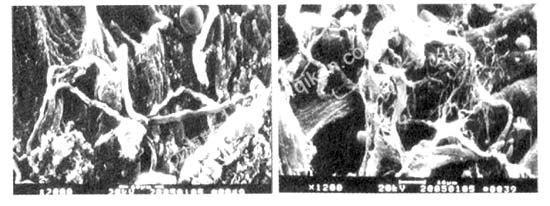
图5 超负荷组左心室肌,图6 超负荷组左心室肌,
扫描电镜,×2 000扫描电镜,×1 200
2.2 不同运动负荷组左心室与左乳头肌透射电镜观察
2.2.1 正常组心肌超微结构的变化 心肌结构清晰,肌丝排列整齐,Z线、M线、I带、A带清晰,肌膜完整;线粒体数量较多,呈带状排列,嵴排列整齐,规则,线粒体膜完整,核双层结构清晰,核仁明显,闰盘未见扩张(图8)。

图7 超负荷组左乳头肌,图8 正常组左心室肌
扫描电镜,×2 000透射电镜×2 000
2.2.2 一般运动负荷组心肌超微结构的变化 一般运动负荷组大鼠心肌组织结构肌丝排列整齐,数量增加,明暗带相间,结构清晰。心肌细胞体积略显增大,T管亦稍有扩张,同时和肌浆网分布于Z线,线粒体数量明显增多,体积增大,核膜双层结构清晰可见,核仁清楚,线粒体膜完整(图9、10)。

图9 左心室一般负荷组图10 左乳头肌一般负荷组
透射电镜×4 000透射电镜×6 000

图11 左心室超负荷组透射电镜×8 000
2.2.3 超负荷组肌超微结构的变化 超负荷组大鼠心肌组织结构完整度破坏,肌纤维粗细不均,Z线不规则增宽,肌丝排列紊乱,肌节阶段性变宽或变短,肌丝扭曲断裂明显,部分肌纤维阶段性变性,闰盘失去台阶状结构,闰盘出现明显扩张、甚至有的闰盘失去正形性状。肌纤维与线粒体的排列关系严重破坏,排列混乱;线粒体膜完整性破坏,嵴排列欠完整,发生不同程度的断裂,髓样变,结构模糊不清,甚至消失,基质电子密度降低,有的基质溶解呈空泡结构,核膜还基本完整,但可见周边有切迹或皱缩(图11)。
3 讨 论
3.1 扫描电镜下不同负荷组心肌胶原纤维变化特征 在以往的研究中大多是对心脏与心肌细胞、毛细血管等方面,特别是在运动对心肌超微结构的影响,蛋白质代谢调控在运动心肌适应机制以及心肌内分泌功能,蛋白合成激素受体功能和其他因子调节功能上进行了大量研究,为揭示运动心肌肥大变化机制提供了重要途径。但却忽视了对运动与ECM的探索,而实质上许多心脏病患者都与心肌胞外间质密切相关,ECM的形态结构与生化重塑都会以不同程度影响心脏的功能[6,7],心肌中胶原网络结构的生理意义及其在心脏疾病时的改变成为现代心脏病学研究领域中的一个新的热点。Weber等[8]首次提出了间质性心脏病的概念,从而对心脏病的研究开创了一个新的领域。ECM中的微妙结构较心脏本身更易在不同运动负荷中发生变化,甚至影响心脏的功能,进一步观察分析心肌间质胶原网络结构的分布方式对阐述运动心脏的功能变化具有重要现实意义。本文观察发现,心肌间质胶原网络结构在心肌、毛细血管及心内膜之间大量的胶原纤维基本上以下几种方式相联接,即“网格状”联接,横向纤维与心肌细胞近乎垂直比心肌细胞大,似“腰带”状把心肌细胞捆扎成束,广泛分布于心肌细胞群及肌内膜上,形成心肌细胞的居室,此结果证实了Weder等[9]的观点。“树枝样”联接,细纤维是粗纤维的分支,向深层像树根一样延伸为微细纤维, 以垂直或斜角方式存在于肌束膜、肌内膜上;直线型联接,所有的胶原纤维彼此连续成网,形似蜂窝,相邻的心肌细胞间为一层胶原纤维膜相隔。在若干个心肌细胞之间有较粗大的胶原纤维,这些粗纤维与其他胶原纤维连接成网,粗的胶原纤维位于若干个心肌细胞之间,把心肌细胞分割形成细胞群。陈小讯等认为心肌间质的胶原主要以粗、细两种纤维形式存在,粗纤维主要走行于心肌细胞间,组呈粗大的框架结构;细纤维则以粗纤维为支架编织成网,包裹于心肌细胞和毛细血管的表面,将心肌细胞固定于其间。心肌间质胶原网络的这种组合形式对稳定心壁的结构很有意义,在阻止心肌肌小节的过度伸张,防止心肌细胞在收缩时移位;细胶原纤维编织成的包裹在细胞和血管的鞘状结构可以使心肌收缩时,产生的力在细胞间迅速传导,保证各心肌细胞的功能协调一致。并认为胶原纤维与细胞表面的任何部位均可连接[10~13]。
本研究与以往研究在胶原纤维束的分类和排列上有所不同。实验观察到粗纤维多位于心肌细胞束间,纵、横两种走向,纵与心肌细胞平行,横与心肌细胞近乎垂直,这些粗纤维主要功能是约束细胞群,使其成为较大的收缩单位;细纤维一般行程短,相互交织成网,笼罩邻近的心肌细胞,这种排列对心肌细胞舒缩时力的传递、防止细胞滑脱和错位、维持心肌张力起重要的作用;微细纤维包裹心肌细胞,形成一层绝缘膜,可能有利心肌电位的传导[14],存在于心肌细胞间及细胞群间,在乳头肌切片上更为常见;总之心肌间质胶原网络是一个由心肌束、细胞群到细胞间、细胞内及心内膜和心肌毛细血管间的一个三维空间结构网络。田振军等[15,16]认为在细纤维之间存在许多纤维同交一点的聚集点,这些聚集点附于心肌细胞表面,细纤维由聚集点向四周辐射,是细纤维的附着点。本研究在不同组均发现有较大的胶原纤维束交一点相汇打结,像树根一样分级延伸为微细纤维,微细纤维附着在心肌细胞表面,排列紧密而细腻,形似“毯膜”,包裹心肌细胞,决定心肌硬度,粗细两种纤维均不与细胞接触,而纤维之间拥有较大的网眼,这一层纤维密度很大,把心肌细胞全部包裹,因此微细纤维是保持心肌细胞正常电位传导非常重要的绝缘体,如果此膜损坏或断裂,可能会影响心脏功能。本文观察结果表明,一般运动负荷条件下,心肌束间,心肌细胞间借肌束膜及肌内膜胶原纤维增生,以适应心肌细胞肥大收缩力增加从而保证心肌间力的传递;运动超负荷条件下,心肌束间,心肌细胞群及细胞间大量胶原纤维不成比例增生,可见胶原纤维粗大成束成网以波浪形或网格状广泛分布,在小动脉壁上及心内膜下胶原纤维过度增生,限制了心肌细胞的伸长与缩短,增加了心肌的僵硬度,使心肌细胞之间力的传递受阻,血管壁的弹性降低,心肌血氧供应功能遭到破坏。发现的乳头肌有肌纤维与胶原纤维断裂现象也许也是因为心脏长期强有力的收缩导致缺氧情况而引起的损伤。同时心内膜对缺血缺氧很敏感,运动超负荷导致心内膜胶原纤维层增厚,内皮细胞受到损伤,这可能是因心肌肥厚的原因导致。此结果与Weber等[9]报道的压力超负荷性心肌肥厚结果相类似。
3.2 透射电镜下不同负荷对心肌亚微结构的影响 心脏的机能状态是决定运动训练水平的重要因素之一,直接关系运动成绩的好坏,尤其对耐力运动员。本研究通过不同运动负荷观察了心肌的超微结构变化。心脏超微结构改变能较直观地反映心肌细胞及间质重塑。构成心脏的细胞中,心肌细胞仅为心脏细胞总数的1/3,而体积却占心脏结构的75%,所以心肌细胞重塑是心脏形态结构重塑的重要方面。心肌间质部分有成纤维细胞、胶原纤维、血管平滑肌细胞、巨噬细胞等。适宜负荷后运动心脏的超微结构特点:1) 心肌细胞体积增大,心肌纤维增粗。2) 线粒体均匀增大,线粒体变密,基质电子密度增强。3) 横小管扩张增大,闰盘连接不同程度改变。长期过度负荷可导致心肌肌丝紊乱,部分肌丝断裂,并出现心肌纤维化、结缔组织增生肌节异常、线粒体肿胀、峭断裂及钙超载、毛细血管密度下降等现象[5]。佟长青等[18]发现运动性心脏心肌超微结构亦有病理变化,主要是水盐代谢障碍,表现为肌浆网扩张,钙超载,而病理性心脏主要表现为蛋白质合成及能量代谢受损。目前研究较一致认为,过度负荷导致心肌损伤的机制是血液动力学及内分泌改变引起心肌缺血缺氧及代谢障碍,并形成恶性循环所致。本研究从微观上证实了运动心脏与功能相适应的结构改变。过度负荷组超微结构显示肌丝、闰盘、线粒体发生一系列病理性改变,可能是由于长期缺血缺氧,或缺氧累加使细胞发生不可逆的结构改变,如肌丝断裂、线粒体膜的融合、嵴结构模糊消失、空泡的出现。一般运动组心肌表现为与有氧代谢功能增强相适应的生理性肥大,线粒体随着细胞体积的增长而成比例的增长,和线粒体数量增加,肌节排列整齐而更适应心脏快速收缩的协调性。可见适宜的运动负荷提高心脏的机能,相反,长时间的超负荷训练对心脏造成损伤。
总之,实验证明运动超负荷可致心肌胶原纤维增生,
可能是导致心肌扩张功能与收缩功能降低的主要原因之一。而有关运动负荷与心肌间质胶原网络重塑的调控及分子生物学机制有待作进一步研究。
参考文献:
[1] Weber KT, Brilla CG.Oathological hypertrophy and cardiac interstitium [J]. Circulation, 1991, 83(6):1849-1865.
[2] 朱全,浦钧宗,张敏. 游泳方法建立大鼠模拟过度训练模型[J]. 中国运动医学杂志1997, 8(4):137-140.
[3] 叶剑飞.过度训练的病理生理及康复—I·大鼠过度训练模型的建立[J]. 中国运动医学杂志1992, 11(1):15-21.
[4] 朱全,浦钧宗. 大鼠游泳训练在运动实验中的应用方法[J]. 中国运动医学杂志,1996,15(2):125-129.
[5] 田振军, 熊正英, 郭进,等.大鼠游泳过度训练模型的建立及心室构型改建研究[J].陕西师范大学学报,1996,24(3):104-109.
[6] 邓昌明,黄晶,刘东,等.型心肌病心肌纤维化血清指标观察[J].临床心血管病杂志, 2002,18(3):106-107.
[7] 王长谦,黄定九,陈润芬,等.大鼠心肌胶原网络重构及血清评估指标[J].中华内科杂志, 1998,37(7):451-454.
[8] Weber KT, Cardiac interstitium in health and disease:the fibrilar collagen network[J].K JACC,1989,13:1637-1652.
[9] Weber KT,Clark WA,Janicki JS,et al. Physiologic Versus pathologic hypertrophy and the pressure-overloaded myocardlum[J].J Cardiovasc Pharmacol,1987,10 (Suppl6):S37-50.
[10] Robison TF, Cohen-Gould L, Factor S. Skel, et al. Framework of mammalian heart muscle. Arrangement of interand pericellular connective tissue structure[J].Lab Tnvest, 1983,49(4):482-498.
[11] Icardo JM, Colvee E, Collagenous.Skeleton of the human mitral papillary musule[J]. Anat REC,1998,252(4):509-518.
[12] Weber KT, Sun Y, Suresh C, et al. Collagen Network of themyocardium: function, structural Remodeling and Regulatory Mechanisms[J].J Mol Cell cardiol,1994,26(3):279-292.
[13] Tanaka K, Mistushma A. Apreparation method for observing intracellular structures by scaning electron microscopy[J].J Microse,1988,133:213-222.
[14] 卢兴.心肌间质网络结构的生理和病理意义[J].基础医学与临床,1992,12(6):17-21.
[15] 田振军.过度训练对心肌间质胶原、心肌舒缩性能和血管Ang II 变化的研究[J].中国应用生理学杂志,1994,11(6):573-577.
[16] 王长谦,谢秀兰,徐依敏, 等.压力负荷性心肌肥厚大鼠心肌胶原网络重构及其与心功能变化的关系[J].心功能杂志,1998,10(4):215.
[17] 田振军.不同运动强度大鼠心肌间质胶原网络结构重塑的扫描电镜观察[J].体育科学,1999,19(3):70-73.
[18] 佟长青.运动性和高血压性肥大心脏心肌超微结构的对比性研究[J].中国运动医学杂志, 2001,2(20):158-166.
