局灶射频消融治疗低危与中危局限性前列腺癌的疗效分析
2025-03-06郜澍蒋振孙继源黄海锋张青郭宏骞




Efficacy of focal radiofrequency ablation in the treatment of low-to-intermediate risk localized prostate cancer
GAO Shu,JIANG Zhen,SUN Jiyuan,HUANG Haifeng,ZHANG Qing,GUO Hongqian
(Department of Urology,Nanjing Drum Tower Hospital,Affiliated Hospital of Medical School,Nanjing University,Nanjing 210000,China)
ABSTRACT:Objective To explore the efficacy of focal radiofrequency ablation (RFA) in the treatment of low-to-intermediate risk localized prostate cancer and its impact on postoperative urinary control and sexual function recovery,in order to explore the feasibility of minimally invasive methods for the treatment of localized prostate cancer.Methods Clinical data of 28 patients with low-to-intermediate risk localized prostate cancer who underwent RFA in Nanjing Drum Tower Hospital,Affiliated Hospital of Medical School during Jun.2017 and Feb.2021 were retrospectively analyzed.The 5-year failure-free survival (FFS) rate,surgery related complications,postoperative urinary control and sexual function were collected.The differences between the survival curves of patients in the low-risk and intermediate-risk subgroups were assessed with log-rank test and Breslow test.Results All surgeries were successfully completed under local anesthesia.During the median follow-up of 43 (40-49) months,the 5-year FFS rate predicted by Kaplan-Meier method was 78.57%; 25 patients (89.29%) did not experience surgery-related complications; 27 patients (96.43%) were able to control urination; 1 patient developed new-onset sexual dysfunction.There was no significant difference in the survival curves between patients in the low-risk and intermediate-risk groups (P>0.05).Conclusion RFA for patients with low-to-intermediate risk localized prostate cancer has good clinical efficacy,little impact on urinary control and sexual function recovery,and few postoperative complications,which can be used as one of the treatment options for these patients.
KEY WORDS:focal radiofrequency ablation; prostate cancer; low-to-intermediate risk; localized; failure-free survival rate;urinary control;sexual function
摘要:目的 探讨局灶射频消融(RFA)治疗低危与中危局限性前列腺癌的疗效及其对患者术后尿控和性功能恢复的影响,以期探究微创方法治疗局限性前列腺癌的可行性。方法 回顾性分析2017年6月—2021年2月南京大学医学院附属鼓楼医院接受RFA治疗的28例低危与中危局限性前列腺癌患者的临床资料,统计分析患者的5年无失败生存(FFS)率、手术相关并发症、术后尿控及性功能情况。采用log-rank检验和Breslow检验评估低危与中危分组患者生存曲线间的差异。结果 所有手术均在局部麻醉下顺利完成。中位随访时间43(40~49)个月,随访期内所有患者均存活,采用Kaplan-Meier法预测的5年FFS率为78.57%。25例(89.29%)患者未出现手术相关并发症,27例(96.43%)患者术后可以自主控尿。1例患者术后出现新发性功能障碍。低危组与中危组患者间生存曲线差异无统计学意义(Pgt;0.05)。结论 局灶RFA治疗低危与中危局限性前列腺癌患者临床疗效较好,对尿控及性功能的影响小且术后并发症较少,是该类患者的可选治疗方案。
关键词:局灶射频消融;前列腺癌;低危与中危;局限性;无失败生存率;尿控;性功能
中图分类号:R737.25 文献标志码:ADOI:10.3969/j.issn.1009-8291.2025.02.010
收稿日期:2024-06-11 修回日期:2024-08-18
通信作者:郭宏骞,主任医师,教授。E-mail:drghq@nju.edu.cn;
张青,副主任医师,副教授。E-mail:drzhangq@nju.edu.cn
作者简介:郜澍,硕士研究生。研究方向:泌尿肿瘤的微创治疗。
E-mail:njushugao@qq.com
前列腺癌(prostate cancer,PCa)是全世界范围内男性发病率排名第2的肿瘤,也是男性肿瘤相关性死亡的第5大原因[1]。低危与中危前列腺癌患者在选择治疗方案时,需综合评估肿瘤控制和功能学恢复获益情况。局灶射频消融(radiofrequency ablation,RFA)作为一种新兴的局限性前列腺癌微创治疗方法,具有术后患者恢复快、创伤小等特点[2-3]。结合专家共识[4-5]及本中心既往冷冻消融治疗前列腺癌的经验,本研究回顾性分析28例接受局部麻醉下局灶RFA治疗的低危与中危局限性前列腺癌患者的临床资料,探究RFA治疗的有效性和对患者术后尿控及性功能恢复的影响,以期探究微创方法治疗局限性前列腺癌的可行性。
1 资料与方法
1.1 基线资料 回顾性分析2017年6月—2021年2月于南京大学医学院附属鼓楼医院接受RFA治疗的28例低危与中危局限性前列腺癌患者的临床资料。采用《中国泌尿外科和男科疾病诊断治疗指南(2022版)》[4]推荐的D-Amico量表的预后风险分组方法,将低危定义为前列腺特异性抗原(prostate specific antigen,PSA)<10 ng/mL、Gleason评分<7分、TNM分期为cT1~2a;中危定义为PSA 10~20 ng/mL或Gleason评分7分或TNM分期为cT2b。其中低危患者15例、中危患者13例,术前患者均能自主控尿,患者的基线资料见表1。
术前充分告知所有患者局灶RFA治疗的优缺点、后续需长期随访的可能以及其他可选择的治疗方案,并让患者签署知情同意书。本研究经南京大学医学院附属鼓楼医院医学伦理委员会批准(伦理批号:202-261-602)。
1.2 局灶RFA方法 所有患者术前均在本院接受多参数磁共振(multi-parameter magnetic resonance imaging,mpMRI)检查。泌尿外科医师和影像科医师仔细阅读患者的mpMRI影像,并标注可疑病灶范围。随后,由1名经验丰富的泌尿外科医师采用经会阴系统穿刺活检和靶向穿刺活检,诊断前列腺癌。
所有患者均由同一位经验丰富的泌尿外科医师行RFA治疗。术前1 h,患者均静脉输注抗生素。患者取截石位,置入三腔导尿管,心电监护监测生命体征,经直肠超声(transrectal ultrasound,TRUS)检查前列腺。所有患者均接受局部浸润麻醉,使用10 mL 2%(5 mL∶0.1 g)利多卡因溶液,于会阴部直肠上方2 cm旁开1 cm进针,逐层浸润至前列腺包膜。使用Esaote超声诊断系统(MyLabTwice,Esaote,Italy)融合mpMRI和TRUS图像,定位可疑病灶。图像融合完成后,实时超声图像上即可见到病灶标记(图1)。
术中使用Celon Lab Power RFA系统(Celon Lab Power,Olympus Surgical Technologies,Germany)及20 mm RFA针(Celon ProSurge T20,Olympus Surgical Technologies,Germany)。超声引导下经会阴部自麻醉位点置入消融针,当针尖到达可疑区域(region of interest,ROI)时,测量针尖到尿道、直肠等关键解剖结构的距离,规划、预评估消融范围。开始消融后,术中实时TRUS监测消融范围,并持续使用生理盐水冲洗尿道。达到预设能量值、预期消融范围被强回声覆盖后,停止消融(图2)。拔除消融针,按压止血。术后观察20~30 min后行超声造影检查。超声造影评估消融已彻底完成后,患者返回病房,术后口服抗生素。
1.3 随访与评估 术后定期复查及随访,复查内容包括体格检查、PSA和影像学检查,必要时行穿刺活检[5]。基本随访方案为:术后3个月内首次复查PSA,随后的1年内每3个月复查1次,1年后每6个月复查1次。术后6个月内复查mpMRI,1年后再次复查mpMRI。当出现PSA有升高趋势或出现直肠指检异常等触发因素时,也应进行mpMRI检查。若mpMRI提示出现可疑病灶,则进行系统穿刺活检和靶向穿刺活检,不将活检作为常规检查手段。随访时记录患者术后尿控情况、性功能情况、是否需使用尿垫、是否存在下尿路症状、血尿、直肠瘘等。
主要疗效指标为无失败生存(failure free survival,FFS)率,其定义为患者未转向前列腺根治性切除术(radical prostatectomy,RP)、雄激素剥夺治疗(androgen deprivation therapy,ADT)、根治性放疗(radiotherapy,RT)、肿瘤转移及前列腺癌相关死亡。次要疗效指标包括总生存(overall survival,OS)率(其定义为从接受RFA开始到某时间节点为止所有患者存活的比率)、无复发率、无疾病进展率、无转移率、手术相关并发症(Clavien-Dindo分级)、尿控、性功能等。尿控评估标准为每日使用的尿垫数量,理想的尿控效果为无需使用尿垫。性功能障碍定义为不能完成性行为中的插入行为。
1.4 统计学方法 使用SPSS 25.0(IBM,USA)软件进行统计学分析,连续变量采用中位数(四分位间距)表示,分类变量采用例(%)表示。使用Wilcoxon检验比较两组间的年龄、前列腺体积、最大癌核长度等基线数据。采用Kaplan-Meier法进行生存分析,使用log-rank检验、Breslow检验进行比较。Plt;0.05为差异有统计学意义。
2 结 果
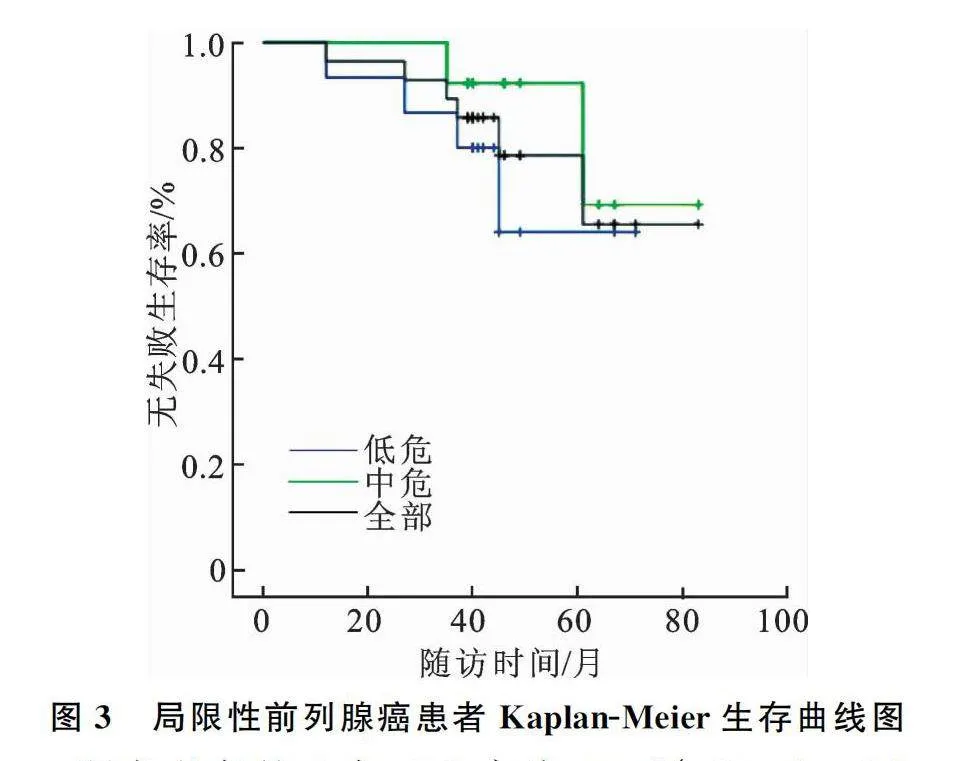
所有手术均顺利完成,中位随访时间为43(40~49)个月。全部患者RFA后3年FFS率为89.29%(25/28),Kaplan-Meier法预测的术后5年FFS率为78.57%(22/28),低危组术后5年FFS率为64.00%,中危组术后5年FFS率为92.31%。低危组与中危组患者在年龄、前列腺体积、最大癌核长度方面比较差异无统计学意义(Pgt;0.05,表2),低危组与中危组FFS生存曲线比较,差异无统计学意义(log-rank检验,P=0.331;Breslow检验,P=0.272,图3)。
所有患者的3年OS率为100%,Kaplan-Meier法预测的5年OS率为100%,5年无复发率为78.57%、无疾病进展率为100%、无转移率为100%。低危组术后5年无复发率为64.00%,中危组术后5年无复发率为92.31%。所有患者术后3个月的中位PSA为3.74(1.43~6.57)ng/mL。8例患者复查mpMRI提示出现可疑病灶,其中6例患者在发现影像学可疑病灶后,通过系统穿刺活检和靶向穿刺活检确诊为局部复发,并立即接受挽救性治疗,2例采用ADT,4例行RP,另外2例患者术后1年复查mpMRI提示PI-RADS 3分病灶,系统穿刺活检及靶向穿刺活检结果为阴性。其余20例患者按随访计划定期复查PSA和mpMRI,未见可疑病灶。
患者中位住院时间为3(2~6)d,25例(89.29%)患者未出现手术相关并发症,3例患者出现Clavien-Dindo Ⅰ级并发症,1例患者术后3个月时仍需要留置导尿管解决尿潴留。2例患者出现术后新发下尿路症状(lower urinary tract symptoms,LUTS)。术前存在LUTS的10例患者中,5例患者术后相关症状消失,5例患者在术后3个月时依然存在类似症状。拔除导尿管后,27例(96.43%)患者可以自主控尿,仅1例患者在术后12个月时依然存在尿失禁,使用尿垫数量为1个/d,无患者发生直肠尿道瘘。术前性功能正常的9例患者中,1例术后出现新发性功能障碍。
3 讨 论
以冷冻消融、激光消融(focal laser ablation,FLA)、高能聚焦超声(high-intensity focused ultrasound,HIFU)、不可逆性电穿孔(irreversible electroporation,IRE)和RFA为代表的局灶治疗方法近年来在临床上的应用越来越广泛[6-9]。相较于RP、RT等全腺体治疗方法,局灶治疗在功能学方面可令患者明显获益[10-13]。RFA是一种新兴的局灶治疗方法,初步研究显示其可用于治疗限性前列腺癌并具有良好的安全性[2,14]。本研究回顾性分析了28例接受RFA治疗的低危与中危局限性前列腺癌患者的临床资料,随访期间,所有患者均存活,中位随访时间43(40~49)个月,Kaplan-Meier法预测的5年FFS率78.57%、OS率100%、无复发率78.57%、无疾病进展率100%、无转移率100%,使用log-rank检验和Breslow检验均提示低危组与中危组间FFS生存曲线无明显差异。低危组FFS率较中危组低(3年:86.67% vs. 92.31%;5年:64.00% vs. 92.31%),这可能与局灶RFA的靶向病灶选择有关。局灶RFA靶向主要病灶,即影响前列腺癌疾病进展的病灶[15],通常认为是Gleason评分最高或体积最大的病灶。主要病灶在中危患者中通常认为是Gleason评分7分病灶。但在低危患者组中,病灶Gleason评分均为6分,若存在多灶性病变,则仅能将体积最大的病灶作为主要病灶,而这有时是不准确的,小体积病灶也有可能导致疾病进展。有研究发现,在多灶性疾病侵犯包膜的前列腺癌中,有1/4不是来自体积最大的病灶[16]。本研究结果显示,22例(78.57%)患者未转至全身治疗、RT或RP,25例(89.29%)患者未出现手术相关并发症,27例(96.43%)患者可以自主控尿。
AYDIN等[2]和ORCZYK等[17]报道的RFA术后复发率分别为30%(3/10)和20%(4/20)。AYDIN等[2]报道RFA术后未出现需要使用尿垫的患者,术后6个月时患者性功能评分明显下降。ORCZYK等[17]报道尿垫使用率为11.11%(2/18),8.33%(1/12)的患者出现新发性功能障碍。在本研究中,有6例(21.43%)出现了局部复发,1例需要持续使用尿垫(3.57%),1例出现新发性功能障碍(1/9,11.11%),与文献报道的结果相当。
RFA治疗局限性前列腺癌的技术关键和难点依然在于准确靶向主要病灶,并准确输送能量。本中心通过术前mpMRI标注并规划消融区域、术中mpMRI-TRUS图像融合引导穿刺、术后超声造影评估消融范围3个步骤,以及手术医师多年、多例的前列腺穿刺活检经验,基本实现了准确定位和消融。本研究所有患者均在局部麻醉下完成RFA,而目前报道的绝大多数有关局灶治疗的案例则是在全身麻醉下进行的。本研究中患者的中位住院时间为3(2~6)d,术后手术相关并发症发生率为10.71%(3/28),与全身麻醉下开展的其他局灶治疗研究并无明显差异。未来可考虑开展更大规模的局部麻醉和全身麻醉下行RFA治疗局限性前列腺癌的对比研究。
既往接受过1次局灶治疗的局限性前列腺癌患者,确诊复发时可选择再次局灶治疗、ADT、RP、RT等多种挽救性治疗手段[5]。有研究认为,出现复发的患者可再接受1次局灶治疗,且此时依然认定为无治疗失败,同样可以计入FFS率[9,18]。本研究中,患者在术后随访时复查PSA,必要时复查mpMRI和接受穿刺活检,并最终通过活检病理确诊是否复发。确诊复发的患者与主管医师经过仔细讨论后,选择挽救性治疗手段。
专家共识指出,随着时间的推移和局灶治疗技术的进展,行局灶治疗患者的选择范围也建议逐渐扩大[19]。既往主要为低危患者提供局灶治疗,目前共识已将中危患者纳入适宜进行局灶治疗的范围。结合本中心经验和专家共识[4-5],本研究仅纳入了D-Amico预后风险分组低危与中危的患者。事实上,目前已有少量局灶治疗研究开始纳入高危患者[9]。未来亦可考虑开展扩大患者人群的相关研究。
本研究存在如下不足:单中心回顾性研究,可能存在一定的样本选择偏倚;样本量较少,随访时间较短。未来可开展多中心、长期随访、大规模的前瞻性临床研究,为RFA治疗局限性前列腺癌提供更多的循证依据。综上所述,RFA治疗低危与中危局限性前列腺癌患者疗效较好,术后并发症少,可作为该类患者的治疗选择。
参考文献:
[1] SUNG H,FERLAY J,SIEGEL RL,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2] AYDIN AM,GAGE K,DHILLON J,et al.Focal bipolar radiofrequency ablation for localized prostate cancer:safety and feasibility[J].Int J Urol,2020,27(10):882-889.
[3] 张梦洁,张青,郭宏骞.前列腺癌局灶治疗的新进展[J].现代泌尿外科杂志,2023,28(1):83-88,90.
[4] 黄健,张旭,魏强,等.中国泌尿外科和男科疾病诊断治疗指南(2022版)[M].北京:科学出版社,2022:141-143.
[5] LEBASTCHI AH,GEORGE AK,POLASCIK TJ,et al.Standardized nomenclature and surveillance methodologies after focal therapy and partial gland ablation for localized prostate cancer:an international multidisciplinary consensus[J].Eur Urol,2020,78(3):371-378.
[6] TOURINHO-BARBOSA RR,SANCHEZ-SALAS R,CLAROS OR,et al.Focal therapy for localized prostate cancer with either high intensity focused ultrasound or cryoablation:a single institution experience[J].J Urol,2020,203(2):320-330.
[7] WALSER E,NANCE A,YNALVEZ L,et al.Focal laser ablation of prostate cancer:results in 120 patients with low- to intermediate-risk disease[J].J Vasc Interv Radiol,2019,30(3):401-409.e2.
[8] VAN DEN BOS W,SCHELTEMA MJ,SIRIWARDANA AR,et al.Focal irreversible electroporation as primary treatment for localized prostate cancer[J].BJU Int,2018,121(5):716-724.
[9] GUILLAUMIER S,PETERS M,ARYA M,et al.A multicentre study of 5-year outcomes following focal therapy in treating clinically significant nonmetastatic prostate cancer[J].Eur Urol,2018,74(4):422-429.
[10] NICOLETTI R,ALBERTI A,CASTELLANI D,et al.Functional outcomes and safety of focal therapy for prostate cancer:a systematic review on results and patient-reported outcome measures (PROMs)[J].Prostate Cancer Prostatic Dis,2024,27(4):614-622.
[11] MENON M,DALELA D,JAMIL M,et al.Functional recovery,oncologic outcomes and postoperative complications after robot-assisted radical prostatectomy:an evidence-based analysis comparing the retzius sparing and standard approaches[J].J Urol,2018,199(5):1210-1217.
[12] HAMDY FC,DONOVAN JL,LANE JA,et al.10-year outcomes after monitoring,surgery,or radiotherapy for localized prostate cancer[J].New Engl J Med,2016,375(15):1415-1424.
[13] LARDAS M,LIEW M,VAN DEN BERGH RC,et al.Quality of life outcomes after primary treatment for clinically localised prostate cancer:a systematic review[J].Eur Urol,2017,72(6):869-885.
[14] HOPSTAKEN JS,BOMERS JGR,SEDELAAR MJP,et al.An updated systematic review on focal therapy in localized prostate cancer:what has changed over the past 5 years?[J].Eur Urol,2022,81(1):5-33.
[15] AHMED HU.The index lesion and the origin of prostate cancer[J].New Engl J Med,2009,361(17):1704-1706.
[16] RUIJTER ET,VAN DE KAA CA,SCHALKEN JA,et al.Histological grade heterogeneity in multifocal prostate cancer.Biological and clinical implications[J].J Pathol,1996,180(3):295-299.
[17] ORCZYK C,BARRATT D,BREW-GRAVES C,et al.Prostate radiofrequency focal ablation (ProRAFT) trial:a prospective development study evaluating a bipolar radiofrequency device to treat prostate cancer[J].J Urol,2021,205(4):1090-1099.
[18] SHAH TT,PETERS M,ELDRED-EVANS D,et al.Early-medium-term outcomes of primary focal cryotherapy to treat nonmetastatic clinically significant prostate cancer from a prospective multicentre registry[J].Eur Urol,2019,76(1):98-105.
[19] VAN LUIJTELAAR A,GREENWOOD BM,AHMED HU,et al.Focal laser ablation as clinical treatment of prostate cancer:report from a Delphi consensus project[J].World J Urol,2019,37(10):2147-2153.
(编辑 闫玉梅)