不同酵母添加对大黄鱼稚鱼育苗水质指标的影响
2025-03-01章霞王易帆陈爽殷小龙徐羡李伟业

摘要:为探究添加不同酵母对大黄鱼仔鱼育苗水质指标的影响,设置空白组、酿酒酵母组、胶红酵母组和锁掷酵母组4组,添加酵母使水体中酵母浓度为104 cfu/mL,研究各组不同时间水质指标的变化情况。结果表明:添加酿酒酵母、锁掷酵母和胶红酵母在一定时间内有助于提高大黄鱼稚鱼育苗水体中亚硝酸盐氮和氨氮的去除率,对总有机碳(TOC)指标无显著影响。且锁掷酵母对亚硝酸盐氮去除率在24~48 h时维持在8579%以上,氨氮去除率在36 h内均优于其他酵母组和空白组。综上,锁掷酵母对大黄鱼稚鱼育苗水体水质净化有促进作用。
关键词:大黄鱼;锁掷酵母;氨氮;亚硝酸盐
中图分类号:S949文献标识码:A
高密度养殖模式中鱼类代谢产生的粪便和残饵常常会造成养殖水环境的恶化,进而引发缺氧、鱼类生长缓慢甚至发生疾病等不良影响。在饲料端禁抗、养殖端限抗的养殖大背景下,添加以益生菌为核心的微生态制剂提高鱼类的抗逆性,减少水环境污染是必然选择[1-2]。其中,酵母菌作为一种常用的益生菌,因其营养丰富、适口性好、环境适应力及免疫作用强、易于培养,越来越受人们的重视,尤其是富含类胡萝卜素的海洋红酵母更是成为研究热点。
海洋红酵母(Marine Rhodotorula)是广泛存在于海洋中的一种单细胞生物,是一类抗逆性较强的水产动物益生菌[3]。海洋红酵母富含蛋白质、葡萄糖、不饱和脂肪酸和类胡萝卜素等多种天然营养物质,可以促进养殖生物生长、提高水产动物体内的抗氧化能力、改善水质[4],目前在水产养殖中已开展一些应用研究。陈昌福等[5]研究表明在饵料中添加海洋1号红酵母可以提高日本对虾幼虾的成活率,促进生长,增加对环境因子的耐受力。薛德林等[6]研究表明,海洋红酵母对提高海参幼体的成活率和变态率有显著成效;夏冬梅等[7]研究表明应用不超过05%的海洋红酵母制成的配合饲料对凡纳滨对虾生长及免疫有显著促进作用;Wang等[8]研究证明,饲粮中添加芽孢杆菌和胶红酵母能改善幼年大西洋鲑的生长性能和抗病能力。另外有研究证明,海洋红酵母可在48 h内有效去除氨氮,氨氮去除率可达86%[9];徐琴等[10]研究表明,粘红酵母(Rhodotorula glutinis)具有净化中国对虾育苗水环境的作用。因此,海洋红酵母作为水产养殖中的多功能益生菌有很大的应用前景。
本研究拟通过在水体中添加酿酒酵母(Saccharomyces cerevisiae)、海洋红酵母——锁掷酵母(Sporidiobolus pararoseus)和海洋红酵母——胶红酵母(Rhodotorula mucilaginosa)3种不同种的酵母,比较不同种酵母对大黄鱼仔鱼育苗水体中氨氮、亚硝酸盐、总有机碳(TOC)等重要指标的影响,为海洋红酵母在水产养殖中的开发应用提供科学依据。
1 材料与方法
11 酵母菌悬液的配制
酿酒酵母的菌种购买自中国工业微生物菌种保藏管理中心(CICC 1421),锁掷酵母、胶红酵母均由本实验室自主筛分保种。
将3种酵母菌分别接种于酵母膏胨葡萄糖液体培养基(YPD培养基)中,培养基采用自然海水进行配制,装液量为160 mL/1000 mL,28℃,1640 r/min,摇床培养48 h后离心,取菌体,自然海水配置菌悬液,现备现用。
12 育苗水体的处理
浙江省舟山市水产养殖研究所养殖池中大黄鱼稚鱼(体长约18 cm)养殖密度为25万尾/池,池体体积为4 m×4 m×12 m,试验期间大黄鱼正进行饲料换饵。通过吸污方式取中层养殖水60 L置于开口塑料桶中,设置空白组、酿酒酵母组、胶红酵母组和锁掷酵母组4组,分别在各组的水体中添加相应酵母,使酵母浓度为104 cfu/mL,微曝气处理3 d。
13 水质指标的测定
前12 h每隔6 h取样1次;12 h至48 h时,每12 h取样1次;48 h后,每24 h取样1次。水质指标测定氨氮、亚硝酸盐和总有机碳,每样测定3次。亚硝酸盐含量采用GB 173784—2007萘乙二胺分光光度法测定,氨氮采用GB 173784—2007次溴酸盐氧化法测定,总有机碳采用总有机碳分析仪(TOC-LCPH CN200)测定。
14 数据分析
试验结果用平均值±标准误(mean±SE)表示,试验数据采用SPSS 200软件进行统计分析,Tukey’s检验方法进行多重比较,Plt;005表示差异显著。
2 结果与分析
21 添加酵母对大黄鱼稚鱼育苗水质亚硝酸盐氮去除率的影响
由表1可知,在6 h时,酿酒酵母组的亚硝酸盐氮去除率显著高于空白对照组(Plt;005),略高于锁掷酵母组,锁掷酵母组略高于胶红酵母组,但差异不显著(P>005);12 h时,锁掷酵母组和酿酒酵母组亚硝酸盐氮去除率均高于胶红酵母组,但差异不显著(P>005),但显著高于空白组(Plt;005);24 h时,锁掷酵母组、胶红酵母组显著高于空白组,空白组显著高于酿酒酵母组(Plt;005);36 h时,锁掷酵母组显著高于胶红酵母组(Plt;005),胶红酵母组显著高于空白组和酿酒酵母组(Plt;005);48 h,胶红酵母组显著高于锁掷酵母组和酿酒酵母组,锁掷酵母组和酿酒酵母组显著高于空白组(Plt;005);72 h时,锁掷酵母组略高于胶红酵母组,显著高于酿酒酵母组,酿酒酵母组显著高于空白组(Plt;005)。总体看,添加酵母有助于提高水体中亚硝酸盐氮的去除率,锁掷酵母和胶红酵母组的亚硝酸盐氮去除率相较于酿酒酵母和空白组更为稳定。
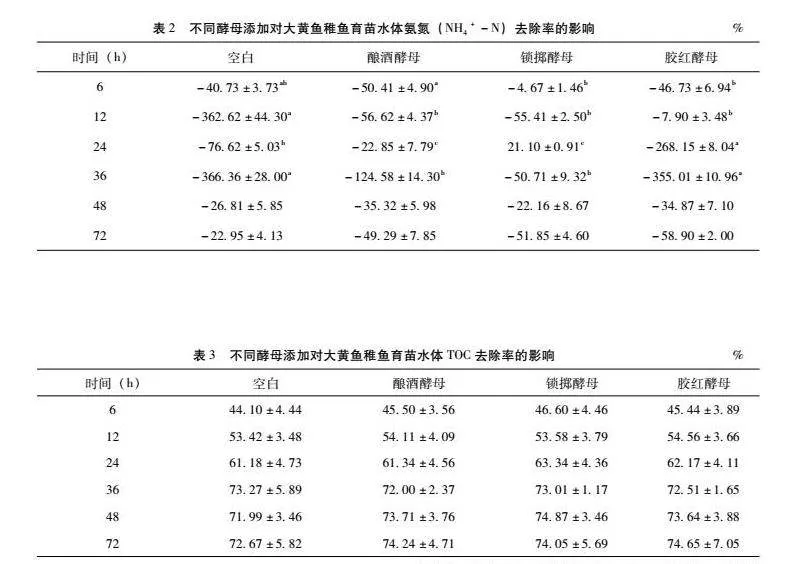
22 添加酵母对大黄鱼稚鱼育苗水质氨氮去除率的影响
由表2可知,4组大黄鱼育苗水体的氨氮去除率在前12 h呈现负增长,但在12 h时,酵母添加组氨氮去除率显著高于空白组(Plt;005)。在24 h时,锁掷酵母组的氨氮呈现正向去除,其他三组去除率呈现负增长,锁掷酵母组氨氮去除率高于酿酒酵母组,但差异不显著(Pgt;005),酿酒酵母组氨氮去除率显著高于空白组(Plt;005),空白组显著高于胶红酵母组(Plt;005)。在36 h时,锁掷酵母和酿酒酵母添加组氨氮去除率显著高于空白组(Plt;005),且锁掷酵母组去除率高于酿酒酵母组,但差异不显著(Pgt;005),锁掷酵母组去除率显著高于胶红酵母组和空白组(Plt;005)。在48 h、72 h时,各组氨氮去除率无显著差异(Pgt;005)。可见,添加酿酒酵母(Saccharomyces cerevisiae)、锁掷酵母(Sporidiobolus pararoseus)和胶红酵母(Rhodotorula mucilaginosa)对大黄鱼鱼苗水体氨氮的去除率影响不一,48 h内,添加酿酒酵母和锁掷酵母有助于提高水体中氨氮的去除率,且锁掷酵母的氨氮去除率优于酿酒酵母。
23 添加酵母对大黄鱼稚鱼育苗水质TOC去除率的影响
由表3可知,各组在各个时间段大黄鱼稚鱼育苗水质TOC去除率差异不显著(Pgt;005)。除36 h外,各时间段添加酵母组的大黄鱼育苗水质TOC去除率稍高于空白组,但差异不显著(Pgt;005)。各酵母组间TOC去除率最高值为48 h的7487%。总体看,添加酵母对育苗水体中的TOC影响不大。
3 讨论
酵母菌是一类单细胞真核微生物的统称,水产养殖中常用的酵母主要有酿酒酵母、汉逊德巴利酵母(Debaryomyces hansenii)和毕赤酵母(Pichia pastoris)等[11]。酵母主要用于饵料生物培养及营养强化、替代饲料蛋白源和抑制病害等。酿酒酵母作为重要的饲料酵母,常用于饲料添加或饲料替代。如Abu-Elala等[12]发现,将酿酒酵母以04%浓度添加进饲料,喂养尼罗罗非鱼(Oniloticus)8周后,鱼类肠道的TNF-α和IL-1β表达量显著上调,在嗜水气单胞菌攻毒实验中,酵母菌添加组死亡率43%显著低于对照组97%。Oliva-Teles等[13]研究发现,在鲈鱼养殖中添加酿酒酵母替代50%的鱼粉蛋白对鱼的生长无不良影响。在日粮中加入30%的酿酒酒酵母可提高饲料利用率。Abass等[14]给尼罗罗非鱼饲喂含有酿酒酵母(7%)的饲料84 d,在热应激和低氧应激试验中发现,酿酒酵母补充组尼罗罗非鱼在2种应激下存活率均为100%,显著高于对照组。众多的研究表明,酿酒酵母有助于提高水产养殖动物的生长性能,增强免疫力,但酿酒酵母在水产养殖用水水质净化方面研究相对较少。本研究表明,添加酿酒酵母可有效降低养殖水体中的亚硝酸盐,在12 h时,去除率可达9061%,在36 h内,可有效降低大黄鱼稚鱼养殖水体中的氨氮,可为该酿酒酵母菌种(CICC 1421)更广泛的开发利用提供科学参考。
海洋红酵母近些年来越来越受水产养殖户及水产养殖相关企业的青睐,因为海洋环境的特殊性使得海洋红酵母应用于海水养殖环境中具有其独到的自身优越性,众多的研究也证明了海洋红酵母作为多功能益生菌的适用性。Wang等[15]研究表明,饲粮中添加胶红酵母能提高凡纳滨对虾的生长性能和抗氧化能力;孙蕾[16]的研究表明胶红酵母HS-J4对海参养殖污水亚硝酸盐氮第3 d去除率达568%;谢凤行等[17]筛选获得的红酵母菌DN9和CN6能有效去除模拟水体中的亚硝态氮以及降解水中的化学需氧量(COD);郭静文[18]的研究表明低浓度组海洋红酵母对于模拟养殖废水氨氮48 h的去除率较高,为3404%,高浓度组海洋红酵母对于亚硝酸盐48 h的去除率较高,为499%。本研究表明,海洋红酵母——锁掷酵母和胶红酵母的添加可显著提升大黄鱼稚鱼育苗水体中的亚硝酸盐氮去除率,去除率最高可达9862%,且72 h内,去除效果比较稳定且显著高于对照组。在12 h内,锁掷酵母和胶红酵母的添加,可有效提升水体中氨氮的去除率,但24~72 h胶红酵母的氨氮去除率相较于空白组无显著差异。这可能与海洋红酵母的来源、种类、剂量和持续时间等有关系,因为上述因素均会影响益生菌的使用效果[19]。
4 结论
综上,在大黄鱼稚鱼育苗水体中,投放104 cfu/mL的锁掷酵母、胶红酵母和酿酒酵母,可有助于提高水体中的氨氮和亚硝酸盐的去除率,且以锁掷酵母水质净化效果为最佳。建议在今后的水产养殖中可开展更多的酵母应用和机理探究,对酵母作为益生菌的作用机制和效果进行全面解析,助力开发更多的鱼用益生菌产品,推动水产养殖业向绿色健康方向更快更好发展。
参考文献
[1]张煜,牛义然,詹吉东.酵母菌及其衍生物在水产养殖中的研究与应用[J].当代水产,2019,44(3):92-95.
[2]沈越,张耀丹,杨俊峰,等.饲料中添加产油红酵母菌株PR61干菌体对红鲫鱼生长性能及体色的影响[J].饲料研究,2023,46(18):36-40.
[3]靳博文,李海东,田相利,等.海洋红酵母不同添加形式对凡纳滨对虾生长、消化酶活性及免疫相关指标的影响[J].海洋湖沼通报,2022,44(5):18-26.
[4]杨秋明,蔡慧农,宋思扬,等.海洋红酵母产虾青素培养基优化的初步研究[J].微生物学杂志,2007,27(1):72-75.
[5]陈昌福,姚鹃,肖雪生,等.海洋1号红酵母饲养日本对虾幼虾的效果[J].淡水渔业,2004,34(6):55-57.
[6]薛德林,胡江春,王国安,等.海洋胶红酵母、光合细菌、生化黄腐酸在海参育苗和养成中的应用效果[J].腐植酸,2009(4):19-24.
[7]夏冬梅,杨铿,李卓佳,等.海洋红酵母对凡纳滨对虾生长及免疫的影响[J].广东农业科学,2013,40(14):133-137.
[8]Wang J,Zhao L,Liu J,et al. Effect of potential probiotic Rhodotorula benthica D30 on the growth performance,digestive enzyme activity and immunity in juvenile sea cucumber Apostichopus japonicus[J]. Fish amp; Shellfish Immunology,2015,43(2):330-336.
[9]Yun L,Wang W,Li Y,et al. Potential application values of a marine red yeast,Rhodosporidiums sphaerocarpum YLY01,in aquaculture and tail water treatment assessed by the removal of ammonia nitrogen,the inhibition to Vibrio spp.,and nutrient composition[J]. PLoS One,2021,16(2):e0246841.
[10]徐琴,李健,刘淇,等.噬菌蛭弧菌和粘红酵母对中国对虾生长及非特异免疫因子的影响[J].渔业科学进展,2007,28(5):42-47.
[11]Iwashita M K P,Nakandakare I B,Terhune J S,et al.Dietary supplementation with Bacillus subtilis,Sacchar-omyces cerevisiae and Aspergillus oryzae enhance immunity and disease resistance against Aeromonas hydrophila and Streptococcus iniae infection in juvenile tilapia Oreochromis niloticus[J]. Fish amp; Shellfish Immunology,2015,43(1):60-66.
[12]Abu-Elala N M,Younis N A,AbuBakr H O,et al. Influence of dietary fermented Saccharomyces cerevisiae on growth performance,oxidative stress parameters,and immune response of cultured Oreochromis niloticus[J].Fish Physiology and Biochemistry,2020,46(2):533-545.
[13]Oliva-Teles A,Gonalves P. Partial replacement of fishmeal by brewers yeast (Saccaromyces cerevisae) in diets for sea bass (Dicentrarchus labrax) juveniles[J]. Aquaculture,2001,202(3-4):269-278.
[14]Abass D A,Obirikorang K A,Campion B B,et al. Dietary supplementation of yeast (Saccharomyces cerevisiae) improves growth,stress tolerance,and disease resistance in juvenile Nile tilapia (Oreochromis niloticus)[J]. Aquaculture International,2018,26(3):843-855.
[15]Wang C,Liu Y,Sun G,et al. Growth,immune response,antioxidant capability,and disease resistance of juvenile Atlantic salmon (Salmo salar L.) fed Bacillus velezensis V4 and Rhodotorula mucilaginosa compound[J]. Aquaculture,2019,500:65-74.
[16]孙蕾.海洋益生菌对养殖水体的影响[D].大连:大连工业大学,2015.
[17]谢凤行,张峰峰,周可,等.水质净化酵母菌的分离筛选及鉴定[J].微生物学报,2015,55(5):635-642.
[18]郭静文.好氧反硝化细菌的筛选及菌藻联合对养殖废水的处理[D].广州:广州大学,2020.
[19]李菊.益生菌在水产养殖中的研究进展[J].水产养殖,2024,45(10):43-47.
