外周血单个核细胞中微小RNA200c-3p、核因子κB mRNA和膜联蛋白-5 mRNA对儿童哮喘诊断价值的比较研究
2025-02-27王静程亮吴杰梅田玲刘丹丹赵怡然



[摘 要]目的 比较外周血单个核细胞(PBMCs)中微小RNA200c-3p(miRNA-200c-3p)、核因子κB(NF-κB)mRNA和膜联蛋白-5(ANX-5)mRNA对儿童哮喘的诊断价值。方法 纳入2022年12月至2023年12月间在唐山市妇幼保健院儿科就诊的95例哮喘儿童作为哮喘组,并分成轻度组(30例),中度组(36例),重度组(29例),同期来该院体检健康儿童40例为对照组。使用实时荧光定量逆转录聚合酶链反应(qRT-PCR)法检测单个核细胞中miRNA-200c-3p、NF-κB mRNA和ANX-5 mRNA的表达量。测量肺功能、1s用力呼气量(FEV1)、用力肺活量(FVC)、最大呼气流量(PEF)及FEV1/FVC值。采用Spearman分析miRNA-200c-3p、NF-κB mRNA和ANX-5 mRNA与肺功能的相关性。使用受试者工作特征(ROC)曲线比较miRNA-200c-3p、NF-κB mRNA和ANX-5 mRNA对哮喘的诊断价值。结果 miRNA-200c-3p和NF-κB mRNA表达水平在重度组、中度组、轻度组及对照组间差异显著(F=12.58和14.81,P<0.01),并依次降低。ANX-5 mRNA表达水平在四组间差异显著(F=16.34,P<0.01),并依次升高。哮喘患儿单个核细胞中miR-200c-3p和NF-κB mRNA,与FEV1、PEF、FEV1/FVC均呈负相关(r介于-0.80~-0.48,P<0.05),ANX-5 mRNA与FEV1、PEF、FEV1/FVC呈正相关(r介于0.48~0.83,P<0.001)。ROC曲线显示,外周血PBMCs中miR-200c-3p诊断儿童哮喘的AUC为0.858,敏感度为0.760,特异度为0.893,截断值为2.24,高于NF-κB mRNA和ANX-5 mRNA单独诊断儿童哮喘。结论 单个核细胞中miRNA-200c-3p对儿童哮喘的诊断效能优于NF-κB mRNA及ANX-5 mRNA单独诊断,是儿童哮喘诊断的敏感分子标志物。
[关键词]儿童;哮喘;单个核细胞;微小RNA-200c-3p;膜联蛋白-5;NF-κB;诊断价值
Doi:10.3969/j.issn.1673-5293.2025.01.008
[中图分类号]R179 [文献标识码]A
[文章编号]1673-5293(2025)01-0044-06
Comparative study on the diagnostic value of miRNA-200c-3p,NF-κB mRNA and
annexin 5 mRNA in peripheral blood mononuclear cells for childhood asthma
WANG Jing,CHENG Liang,WU Jiemei,TIAN Ling,LIU Dandan,ZHAO Yiran
(Department of Pediatrics,Tangshan Maternal and Child Health Hospital,Hebei Tangshan 063000,China)
[Abstract] Objective To compare the diagnostic value of miRNA-200c-3p,nuclear factor κB (NF-κB) mRNA and annexin 5 (ANX-5) mRNA in peripheral blood mononuclear cells (PBMCs) for childhood asthma. Methods A total of 95 children with asthma who visited the Department of Pediatrics at Tangshan Maternal and Child Health Hospital between December 2022 and December 2023 were included as the asthma group.This group was further divided into a mild group (30 cases),a moderate group (36 cases),and a severe group (29 cases).Concurrently,40 healthy children who underwent physical examinations at the hospital were selected as the control group.The expression levels of miRNA-200c-3p,NF-κB mRNA,and ANX-5 mRNA in PBMCs were measured using real-time fluorescence quantitative reverse transcription polymerase chain reaction (qRT-PCR).Pulmonary function was assessed by measuring forced expiratory volume in 1 second (FEV1),forced vital capacity (FVC),peak expiratory flow (PEF),and the FEV1/FVC ratio.Spearman correlation analysis was used to evaluate the relationships between miRNA-200c-3p,NF-κB mRNA,ANX-5 mRNA,and pulmonary function.The diagnostic value of miRNA-200c-3p,NF-κB mRNA,and ANX-5 mRNA for asthma was compared using receiver operating characteristic (ROC) curve analysis. Results The expression levels of miRNA-200c-3p and NF-κB mRNA differed significantly among the severe,moderate,mild,and control groups (F=12.58 and 14.81,respectively,P<0.01),decreasing sequentially across the groups.In contrast,ANX-5 mRNA expression levels showed significant differences among the four groups (F=16.34,P<0.01),increasing sequentially.In children with asthma,miRNA-200c-3p and NF-κB mRNA were negatively correlated with FEV1,PEF,and FEV1/FVC (r ranging from -0.80 to -0.48,P<0.05),while ANX-5 mRNA was positively correlated with FEV1,PEF,and FEV1/FVC (r ranging from 0.48 to 0.83,P<0.001).The ROC curve analysis showed that miRNA-200c-3p in PBMCs had the highest diagnostic value for childhood asthma,with an area under the curve (AUC) of 0.858,sensitivity of 0.760,specificity of 0.893,and a cutoff value of 2.24,outperforming NF-κB mRNA and ANX-5 mRNA as standalone diagnostic markers. Conclusion miRNA-200c-3p in mononuclear cells demonstrates superior diagnostic performance for childhood asthma compared to NF-κB mRNA and ANX-5 mRNA alone,making it a sensitive molecular biomarker for the diagnosis of childhood asthma.
[Key words] child;asthma;peripheral blood mononuclear cell;miRNA-200c-3p;annexin 5;NF- κB;diagnostic value
哮喘是一种慢性呼吸道疾病,其特征是发作性和可逆性的喘息、胸闷、呼吸急促和咳嗽[1]。根据美国疾病控制与预防中心的报告[2],美国18岁以下儿童哮喘总患病率为8.3%。与成人相比,患有严重哮喘的儿童嗜酸性粒细胞数量、过敏原敏感性和IgE水平明显更高[3]。微小RNA(microRNA,miRNA)是人体组织内广泛存在的可参与炎症过程的RNA分子。最近研究发现哮喘患者血清中多种miRNA存在差异性表达,并参与哮喘气道慢性炎症进展[4]。miRNA-200c-3p是新近发现的miRNA分子,定位于3号染色体上,功能研究显示在急性呼吸窘迫综合征患者的肺泡灌洗液和血清中均发现miRNA-200c-3p浓度增加,是参与肺部炎症、免疫反应、肺泡损伤和修复的重要miRNA分子之一[5]。膜联蛋白-5(annexin 5,ANX-5)是膜联蛋白家族中最小的成员,具有独特的膜结合和自组装成有序二维阵列的特性[6],其可参与调节细胞自噬、肺纤维化[7]等多种生理过程。文献[8]报道ANX-5对儿童哮喘诊断也有一定的诊断价值。NF-κB信号通路的激活与气道炎症密切相关,在哮喘发病机制中也起着重要的作用[9]。目前尚鲜见报道关于微小RNA-200c-3p(microRNA-200c-3p,miRNA-200c-3p)、膜联蛋白-5及核因子κB(nuclear factor-κ-gene binding,NF-κB)对儿童哮喘诊断价值的比较。本研究旨在分析miRNA-200c-3p、ANX-5及NF-κB在儿童哮喘外周血单个核细胞中的表达差异,并比较三者对儿童哮喘的诊断价值。
1资料与方法
1.1研究对象及分组
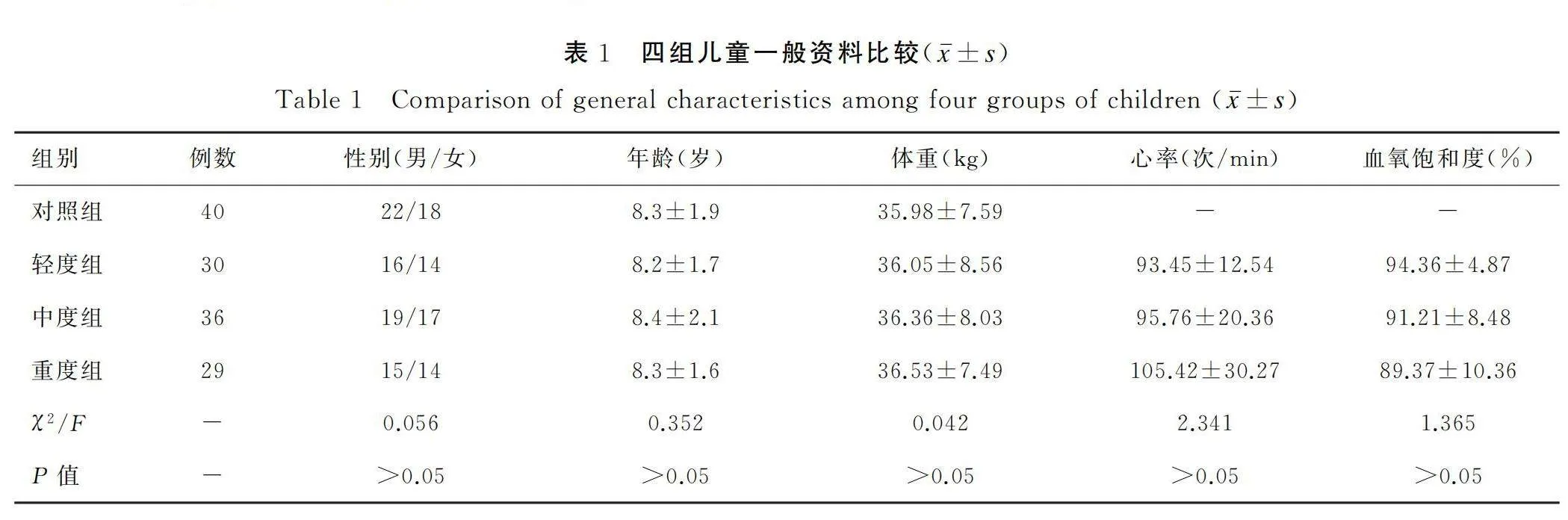
选取2022年12月至2023年12月间在唐山市妇幼保健院儿科就诊的95例哮喘儿童,为哮喘组,其中男童50例、女童45例,年龄(8.3±1.8)岁,根据哮喘严重程度标准指南[10]分成轻度组(30例),中度组(36例),重度组(29例)。另选取同期来该院体检健康儿童40例,为对照组,其中22例男童、18例女童,年龄(8.3±1.9)岁。四组一般资料比较差异不显著,见表1。
1.2纳入和排除标准
纳入标准:①按《儿童支气管哮喘诊断与防治指南》中的哮喘诊断标准[10];②入选患儿在72小时内未使用抗胆碱能类、β2受体激动剂、白三烯拮抗剂或糖皮质激素等哮喘治疗药物。排除标准:①不符合上述纳入标准者;②患者临床资料不全者;③患者家拒绝参与研究者。选择同期年龄和性别匹配的健康体检儿童作为对照组。本研究经我院医学伦理委员会批准(批号:2021-022-01),符合医学伦理规则和要求。
1.3方法
1.3.1标本采集和处理
采集轻度、中度及重度组哮喘患儿和对照组儿童体检期间空腹静脉血5mL,先使用人淋巴细胞分离液(cytiva*HyClone公司,货号:17-5442-02)分离出静脉血中的淋巴细胞,并按4 000r/min的标准离心处理30min,试管底部即人单个核细胞(peripheral blood mononuclear cell,PBMCs),经漂洗后以1×105/mL细胞计数加至12孔板,并在37℃、5%CO2条件下培养于RPMI1640培养基中,并孵育2h,收集细胞待下一步实验。
1.3.2外周血单个核细胞中miR-200c-3p、NF-κB mRNA和ANX-5 mRNA表达量的检测
提取单个核细胞总RNA后,采用反转录试剂盒(美国Invitrogen公司,货号11756500)进行反转录,获得cDNA,采用实时荧光定量逆转录聚合酶链反应(real-time quantitative reverse transcription PCR,qRT-PCR)法测定miR-200c-3p、NF-κB mRNA和ANX-5 mRNA的表达量。miR-200c-3p采用U6作为内参,NF-κB mRNA和ANX-5 mRNA的测定采用β-actin作为内参。引物序列见表2,反应体系:20μL:10μL SYBR premix Ex TaqTM(2x)、2μL PCR Forward Primer(5μmol/L)、2μL PCR Reverse Primer(5μmol/L)、2μL逆转录产物和4μL RNA聚合酶水。反应条件:95℃变性30s、55℃退火30s、72℃延伸30s,共进行45个循环。2-ΔΔCt法用于确定目标基因的相对表达水平。
1.3.3肺功能检测
使用儿科肺量计(德国MS-IOS JAEGER型)检测哮喘组及对照组儿童肺功能,气压计测量1s用力呼气量(forced expiratory volume in the first second,FEV1)、用力肺活量(forced vital capacity,FVC)、最大呼气流量(peak expiratory flow,PEF),并计算FEV1/FVC比值。
1.4统计学分析
采用graphpad 17.0行统计学分析,以均数±标准差(x-±s)表示计量资料,Levene检验用于检验方差齐性,多组间的比较采用单因素方差分析,在有统计学意义的基础上用LSD-t检验行两组间的比较,相关性分析采用Spearman分析,对哮喘诊断的分析采用受试者工作特征(receiver operating characteristic,ROC)曲线。
2结果
2.1四组间外周血单个核细胞miRNA-200c-3p、NF-κB mRNA和ANX-5 mRNA表达水平比较
miRNA-200c-3p表达水平在重度组、中度组、轻度组及对照组间差异显著(F=12.58,P<0.01),重度组、中度组、轻度组和对照组依次降低;NF-κB mRNA表达水平在四组间存在显著差异(F=14.81,P<0.01),重度组、中度组、轻度组和对照组依次降低;ANX-5 mRNA表达水平在四组间存在显著差异(F=16.34,P<0.01),重度组、中度组、轻度组和对照组依次升高,见表3。
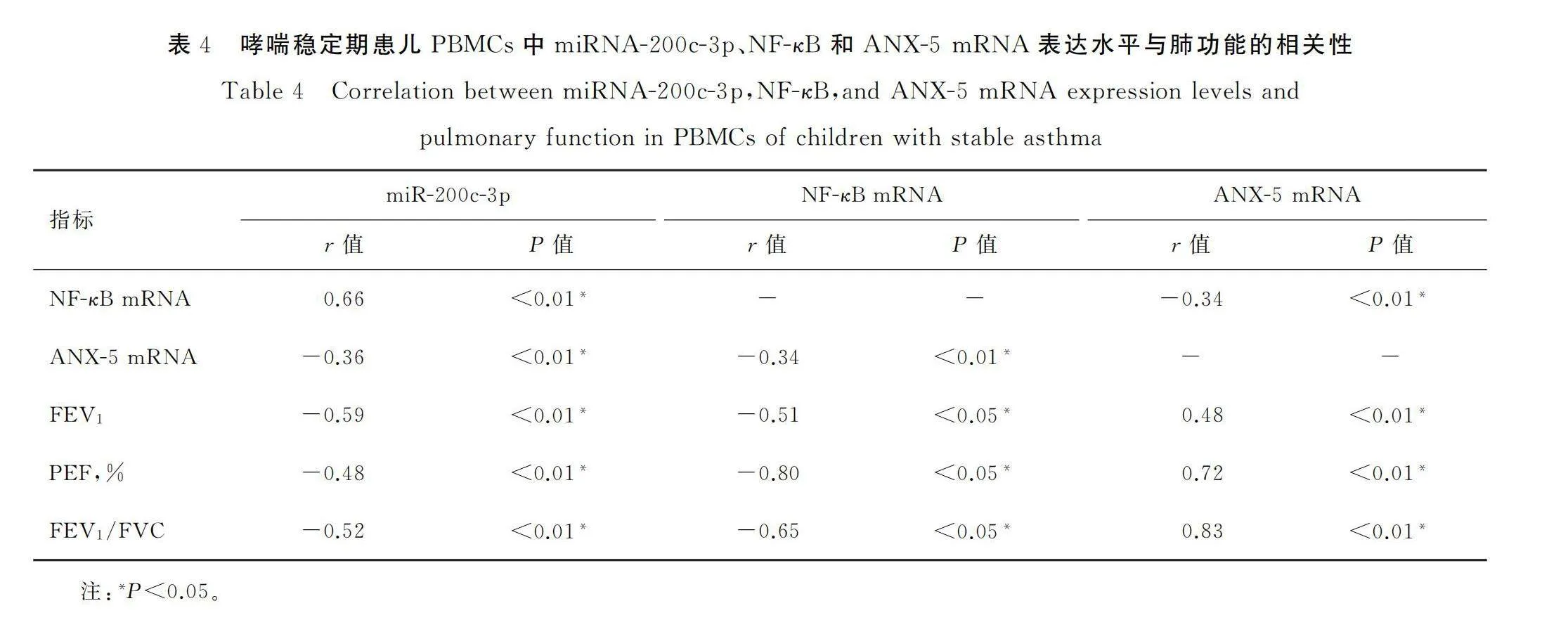
2.2 哮喘患儿PBMCs中miRNA-200c-3p、NF-κB和ANX-5及肺功能的相关性
哮喘患儿外周血PBMCs中miRNA-200c-3p表达水平与NF-κB mRNA表达水平呈正相关(r=0.66,P<0.01),miRNA-200c-3p与ANX-5 mRNA表达水平呈负相关(r=-0.36,P<0.01),ANX-5 mRNA和NF-κB mRNA相对表达水平之间呈负相关(r=-0.34,P<0.01)。
哮喘患儿PBMCs中miR-200c-3p与FEV1、PEF、FEV1/FVC呈负相关(r介于-0.59~-0.48,P<0.01),NF-κB与FEV1、PEF、FEV1/FVC呈负相关(r介于-0.80~-0.51,P<0.05),ANX-5 mRNA与FEV1、PEF、FEV1/FVC呈正相关(r介于0.48~0.83,P<0.01),见表4。
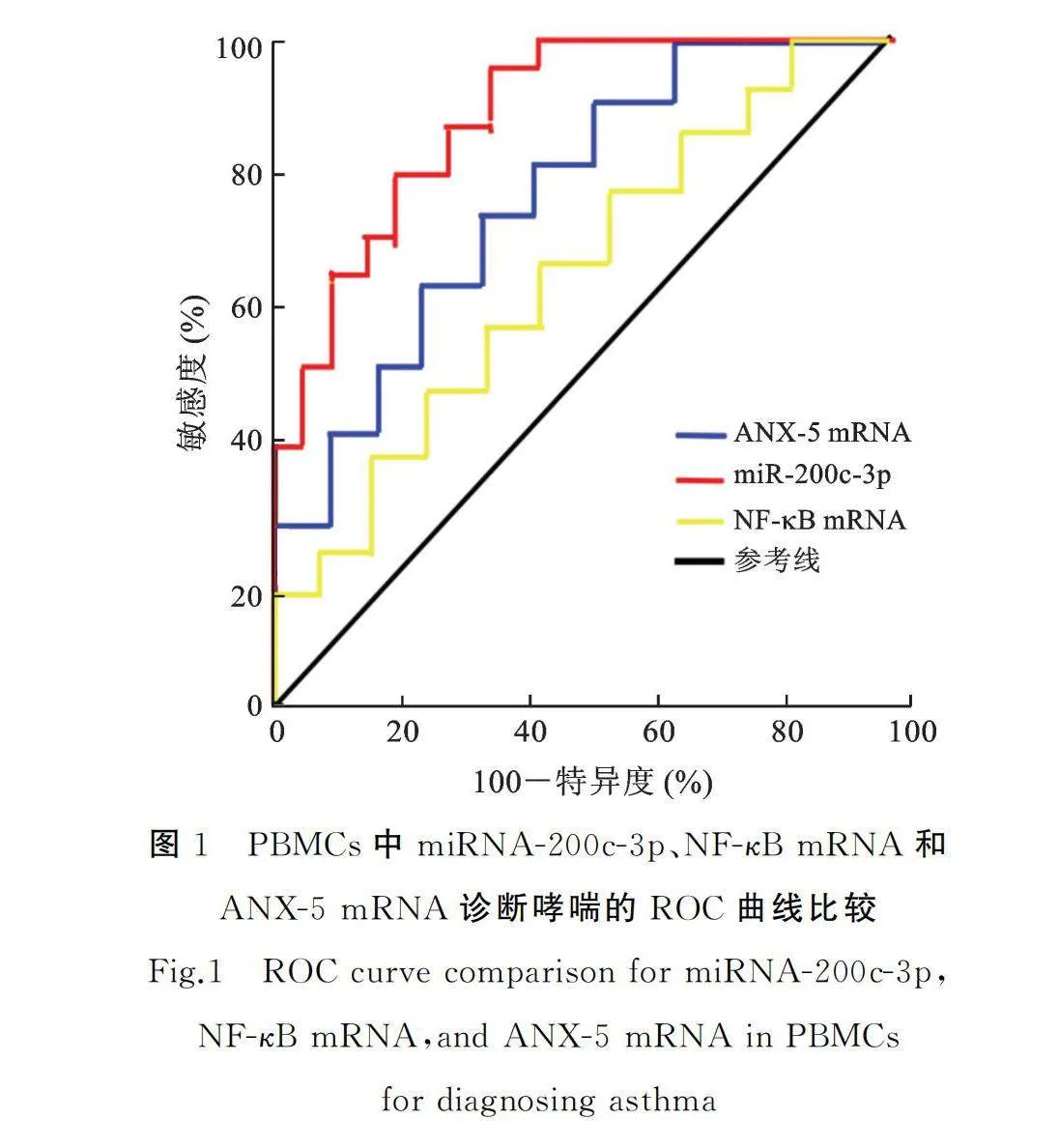
2.3 PBMCs中miRNA-200c-3p、NF-κB和ANX-5表达水平对哮喘的诊断价值
ROC曲线示,外周循环中PBMCs NF-κB mRNA表达水平诊断儿童哮喘的ROC曲线下面积(area under curve,AUC)为0.658,95%CI为0.609~0.717,敏感度为0.619,特异度为0.603,截断值为1.21;PBMCs中ANX-5 mRNA表达水平诊断儿童哮喘的AUC为0.731,95%CI为0.633~0.789,敏感度为0.745,特异度为0.779,截断值为2.27;外周血PBMCs中miR-200c-3p诊断儿童哮喘的AUC为0.858,95%CI为0.761~0.877,敏感度为0.760,特异度为0.893,截断值为2.24,见表5和图1。
3讨论
3.1 miRNA在儿童哮喘发病中的作用
儿童哮喘的发病机制复杂,涉及嗜酸性粒细胞、淋巴细胞、肥大细胞等多种炎症细胞介导的气道变态反应性和重塑[11]。及时诊断和规范治疗对于减少哮喘反复急性发作、预防气道重塑和肺功能不可逆损害至关重要[12]。因此,寻找与儿童哮喘诊断和预后相关的分子标志物是临床急需解决的难题。
miRNA在支气管哮喘发病过程中发挥了重要的调控作用[13]。研究发现[14],与健康对照者相比,支气管哮喘患者血清中含有53种差异表达(其中18种表达下调,35种表达上调)miRNA。另外,循环中的miR-223-5p、miR-339-3p和miR-454-3p被认为是预测儿童哮喘急性发作的重要标志物[15]。在本研究中发现哮喘患儿外周血单个核细胞中miRNA-200c-3p表达水平在重度组、中度组、轻度组及对照组间差异显著,且重度组中最高,提示miRNA-200c-3p可能参与了哮喘的急性发作过程。此外,本研究显示哮喘患儿外周血单个核细胞miRNA-200c-3p表达水平与肺功能指标呈负相关,提示其可能反映哮喘患儿肺功能受损程度。
3.2 ANX-5与哮喘发病的关系
ANX-5是Annexin家族中最小的成员,在膜表面具有独特的膜结合和自组装成有序二维阵列的特性[7]。作为一种在多种细胞类型中普遍表达的细胞内蛋白,ANX-5对磷脂酰丝氨酸具有特定的结合亲和力,且会干扰巨噬细胞对凋亡细胞的识别,减弱胞吞作用[16],从而发挥抑制炎症和炎症因子释放的作用。本研究发现ANX-5 mRNA表达水平在在重度组、中度组、轻度组及对照组间差异显著,且重度组中最低,提示ANX-5可能参与了哮喘的急性发作的过程。本研究后续研究还显示,哮喘患者外周血单个核细胞ANX-5 mRNA与FEV1、PEF、FEV1/FVC呈正相关,表明ANX-5 mRNA表达水平越低,肺功能受损程度越重。
3.3 细胞因子与哮喘发病的关系
哮喘发病机制涉及多种细胞和细胞因子的参与,其中NF-κB激活途径是目前研究较为深入的领域。NF-κB激活可诱导的多种细胞因子[肿瘤坏死因子α、白细胞介素(interleukin,IL)-4、IL-5、IL-6、IL-8、IL-9、IL-13]、生长因子、粘附因子及其受体均参与哮喘发病的分子机制[17]。在本研究中,重度组哮喘患儿外周血单个核细胞中NF-κB mRNA表达较中度及轻度组显著升高,同时发现其与与FEV1、PEF、FEV1/FVC呈负相关,与过去研究一致,显示NF-κB激活是参与哮喘发生和进展的重要分子机制[18]。
在本研究中,NF-κB mRNA表达水平与Annexin A5表达水平呈负相关,同时miRNA-200c-3p表达水平与NF-κB mRNA表达水平呈正相关,miRNA-200c-3p与二者是否存在调控关系是未来的研究重点。
3.4 儿童哮喘的诊断标志物
儿童哮喘缺乏特异性的诊断标志物,本研究发现外周血单个核细胞中miRNA-200c-3p水平诊断儿童哮喘的AUC为0.858,95%CI为0.761~0.877,敏感度为76.0%,特异度为89.3%,其诊断效能高于NF-κB mRNA及ANX-5 mRNA。相关文献[19]报道miR-21、miR-55、miR-106a表达水平在哮喘和过敏性鼻炎中存在显著差异,可能作为哮喘的诊断标志物。近期研究[20]选取血清中5种不同的miRNA诊断哮喘和非哮喘的患者,结果AUC为0.92,显示出其作为标志物的潜力,上述研究结果均表明,检测患者循环或外周血单个核细胞中miRNA表达可能为哮喘诊断的非侵入性的分子标志物。
综上所述,本研究发现重度哮喘患儿外周血单个核细胞中miRNA-200c-3p、NF-κB mRNA表达水平显著高于轻度及中度哮喘患儿,ANX-5 mRNA表达水平随着哮喘程度加重而显著降低,单个核细胞中miRNA-200c-3p对儿童哮喘的诊断效能优于NF-κB mRNA及ANX-5 mRNA,是儿童哮喘诊断的潜在分子标志物。
[参考文献]
[1]蒋萍影,唐国英.外周血EETs水平与咳嗽变异性哮喘患儿Th1和Th2及其细胞因子、小气道功能的相关性分析[J].中国妇幼健康研究,2024,35(2):38-43.
[2]Zahran H S,Bailey C M,Damon S A,et al.Vital signs:asthma in children-United States,2001-2016[J].MMWR Morb Mortal Wkly Rep,2018,67(5):149-155.
[3]路黎娟,徐梅佳,董焱,等.支气管哮喘患儿血清骨膜蛋白、IL-13和miR-155水平相关性的研究[J].中国妇幼健康研究,2022,33(5):41-46.
[4]Kho A T,McGeachie M J,Moore K G,et al.Circulating microRNAs and prediction of asthma exacerbation in childhood asthma[J].Respir Res,2018,19(1):128.
[5]Liu Q,Du J,Yu X,et al.MiRNA-200c-3p is crucial in acute respiratory distress syndrome[J].Cell Discov,2017,3:17021.
[6]Bouter A,Carmeille R,Gounou C,et al.Review:annexin-A5 and cell membrane repair[J].Placenta,2015,36 Suppl 1:S43-49.
[7]Luo C,Ji X,Fan J,et al.Annexin A5 promotes macrophage activation and contributes to pulmonary fibrosis induced by silica particles[J].Toxicol Ind Health,2016,32(9):1628-1638.
[8]Tahan F,Akar H H,Saraymen B.Exhaled breath condensate annexin A5 levels in exercise-induced bronchoconstriction in asthma:a preliminary study[J].Allergol Immunopathol (Madr),2015,43(6):538-542.
[9]Hoesel B,Schmid J A.The complexity of NF-κB signaling in inflammation and cancer[J].Mol Cancer,2013,12:86.
[10]中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,54(3):167-181.
[11]Saglani S,Custovic A.Childhood asthma:advances using machine learning and mechanistic studies[J].Am J Respir Crit Care Med,2019,199(4):414-422.
[12]Pavord I D,Afzalnia S,Menzies-Gow A,et al.The current and future role of biomarkers in type 2 cytokine-mediated asthma management[J].Clin Exp Allergy,2017,47(2):148-160.
[13]McGeachie M J,Davis J S,Kho A T,et al.Asthma remission:predicting future airways responsiveness using an miRNA network[J].J Allergy Clin Immunol,2017,140(2):598-600.
[14]Chen Y,Mao Z D,Shi Y J,et al.Comprehensive analysis of miRNA–mRNA–lncRNA networks in severe asthma[J].Epigenomics,2018,11(2):115-131.
[15]Kho A T,McGeachie M J,Moore K G,et al.Circulating microRNAs and prediction of asthma exacerbation in childhood asthma[J].Respir Res,2018,19(1):128.
[16]Ghislat G,Aguado C,Knecht E.Annexin A5 stimulates autophagy and inhibits endocytosis[J].J Cell Sci,2012,125(Pt1):92-107.
[17]Park M H,Hong J T.Roles of NF-κB in cancer and inflammatory diseases and their therapeutic approaches[J].Cells,2016,5(2):15.
[18]Panda L,Gheware A,Rehman R,et al.Linoleic acid metabolite leads to steroid resistant asthma features partially through NF-κB[J].Sci Rep,2017,7(1):9565.
[19]Panganiban R P,Lambert K A,Hsu M H,et al.Isolation and profiling of plasma microRNAs:biomarkers for asthma and allergic rhinitis[J].Methods,2019,152:48-54.
[20]Milger K,Gtschke J,Krause L,et al.Identification of a plasma mi RNA biomarker signature for allergic asthma:a translational approach[J].Allergy,2017,72(12):1962-1971.
[专业责任编辑:侯 伟]
[中文编辑:牛 惠;英文编辑:李晓雪]
