Costello综合征胎儿的遗传学分析并文献回顾
2025-02-27韩春晓闫露露张玉鑫李海波






[摘 要]目的 探讨Costello综合征胎儿的临床特征及致病基因的变异。方法 本研究选取2022年就诊于宁波市妇女儿童医院的两名孕妇作为研究对象,收集胎儿及家庭成员的临床资料和家族史,采用全外显子组测序(WES)分析患儿致病基因,确定可疑变异后对先证者及其父母进行Sanger测序验证,并在中国知网,万方数据库以及PubMed数据库中以“Costello综合征”,“Costello syndrome”,“prenatal diagnosis”,“HRAS”为关键词检索2000至2023年相关文献进行回顾分析。结果 胎儿1超声提示羊水过多,颈部水囊瘤,左心房偏小,肾盂分离,胃泡裂隙状,下颌略后缩。胎儿2超声提示羊水过多,心包积液,室壁增厚,左侧胸腔积液,肾盂分离,单脐动脉,下颌略后缩。WES结果为家系1胎儿携带HRAS基因的c.35G>T(p.G12V)杂合错义变异,家系2胎儿携带HRAS基因c.34G>T(p.G12C)杂合错义变异,两个家系父母亲均为野生型,Sanger测序验证两变异为新发变异。连同14篇文献报道的24例Costello综合征病例,多存在羊水过多(85%)、心血管异常(92%)、早产(83%)、特殊面容(81%)等临床症状,共检出7种HRAS基因变异,其中c.34G>A(p.G12S)突变占比最高(31%)。结论 Costello综合征胎儿的致病原因可能为HRAS基因的错义突变,Costello综合征可能存在基因型与表型的相关性。
[关键词]Costello综合征;HRAS基因;全外显子组
Doi:10.3969/j.issn.1673-5293.2025.01.015
[中图分类号]R173 [文献标识码]A
[文章编号]1673-5293(2025)01-0085-08
Genetic analysis and literature review of fetuses with Costello syndrome
HAN Chunxiao,YAN Lulu,ZHANG Yuxin,LI Haibo
(Center for Integrated Prevention and Treatment of Birth Defects,Women and
Children’s Hospital of Ningbo University,Zhejiang Ningbo 315000,China)
[Abstract] Objective To investigate the clinical characteristics and genetic variations associated with Costello syndrome in fetuses. Methods This study involved two pregnant women who visited Ningbo Women and Children’s Hospital in 2022.Clinical data and family history of the fetuses and family members were collected.Whole-exome sequencing (WES) was used to analyze the pathogenic genes of the fetuses.After identifying suspicious variations,Sanger sequencing was conducted to verify these in the probands and their parents.A literature review from 2000 to 2023 was conducted on China National Knowledge Infrastructure (CNKI),Wanfang Database,and PubMed using keywords of “Costello syndrome” or “prenatal diagnosis” or “HRAS”. Results Fetus 1 ultrasound findings showed polyhydramnios,cystic hygroma in the neck,a smaller left atrium,renal pelvis separation,slit-like gastric bubble,and slight retrognathia.Fetus 2 ultrasound findings revealed polyhydramnios,pericardial effusion,thickened ventricular walls,left-sided pleural effusion,renal pelvis separation,single umbilical artery,and slight retrognathia.WES results identified that fetus 1 carried a de novo heterozygous missense mutation in the HRAS gene,c.35G>T (p.G12V),while fetus 2 carried a de novo heterozygous missense mutation in the HRAS gene,c.34G>T (p.G12C).Sanger sequencing confirmed these mutations as de novo in both cases,as the parents of both families were wild-type.Combined with a literature review of 14 articles reporting 24 cases of Costello syndrome,most cases exhibited clinical features such as polyhydramnios (85%),cardiovascular abnormalities (92%),preterm birth (83%),and distinctive facial features (81%).Seven HRAS gene mutations were identified,with the c.34G>A (p.G12S) mutation being the most common (31%). Conclusion The pathogenic cause of fetal Costello syndrome is missense mutations in the HRAS gene,and there may be a correlation between genotype and phenotype in Costello syndrome.
[Key words] Costello syndrome;HRAS gene;whole exome sequencing
Costello综合征是一种常染色体显性遗传罕见病,由HRAS基因突变导致的生殖系衍生点突变,影响有丝分裂原激活蛋白激酶途径引起,多数为新发变异,发病率约1/300 000~1/1 250 000[1],临床特征是产前过度生长、产后生长缺陷、智力障碍、特殊面容、心血管异常(典型为肺动脉狭窄、肥厚性心肌病和/或心房心动过速)、肿瘤易感性、皮肤和肌肉骨骼异常,表型轻重不一。由于Costello综合征的表型与Noonan综合征、心-面-皮综合征的表型相互重叠,临床诊断难度大。Aoki Y[2]发现HRAS是目前唯一与Costello综合征相关的基因,使得该综合征的检出率提高。本文对两例羊水过多、心脏、肾脏异常等多发畸形的胎儿进行全外显子组测序(whole exome sequence,WES),发现两例胎儿携带HRAS基因错义突变,并通过总结文献报道Costello综合征胎儿的临床表型和遗传学特征,以提高临床医生对Costello综合征的认识。
1对象与方法
1.1研究对象
本研究选取2022年6月、10月就诊于宁波市妇女儿童医院的两名孕妇作为研究对象。
家系1:孕妇,30岁,G1P0,自然流产1次,胎儿父母系非近亲结婚,经遗传咨询,孕妇于23+5周选择终止妊娠,在征得家属同意后,剪取胎儿大腿内侧肌肉组织及父母外周血进行全外显子组测序分析。
家系2:孕妇,33岁,G1P0,妊娠期糖尿病,胎儿父母系非近亲结婚,经遗传咨询,孕妇28+4周选择终止妊娠。经孕妇知情同意于25+3周抽取羊水及父母外周血进行全外显子组测序分析。
本研究已通过医院医学伦理委员会的审查(EC2020-014)。
1.2DNA提取
抽取其父母外周静脉血各5mL,使用QIAamp DNA Blood Mini Kit试剂盒(德国QIAGEN公司,货号:51185)提取DNA用于全外显子组测序。
1.3全外显子组测序
使用Nano WES探针(北京贝瑞和康生物技术有限公司)进行全外显子组DNA杂交捕获富集后,在NovaSeq 6000系统行高通量测序(美国Illumina公司),相关测序数据质量标准:平均测序深度100×~150×,数据表质量Q20≥85%,Q30≥80%。将测序原始数据与人类参考基因序列比对,采用GATK和VarScan软件对变异进行识别和注释。检索1000 Genomes(http://gnomad-sg.org/)、dbSNP(http://www.ncbi.nlm.nih.gov/SNP/)、ExAC(http://exac.broadinstitute.org)、HGMD(https://www.hgmd.cf.ac.uk/ac/validate.php)、ClinVar(https://www.ncbi.nlm.nih.gov/clinvar/)Locus Specific Database list(https://grenada.lumc.nl/LSDB_list/lsdbs)等数据库用于筛选可能的致病性变异。
Sanger测序验证针对WES发现的可疑变异,对患儿及家庭成员DNA进行Sanger测序验证,使用Premier5.0软件针对HRAS基因杂合错义突变位点设计引物(表1),PCR产物纯化后与bigdyeTerinatorv3.1进行测序反应PCR,测序产物通过醋酸钠-乙醇法进行纯化,在ABI-3500DX(美国Applied Biosystems)公司上机测序。
1.4文献检索
在中国知网,万方数据库以及PubMed数据库中以“Costello综合征”,“Costello syndrome”,“prenatal diagnosis”,“HRAS”为关键词搜索2000至2023年相关文献并进行回顾分析。
2结果
2.1胎儿超声
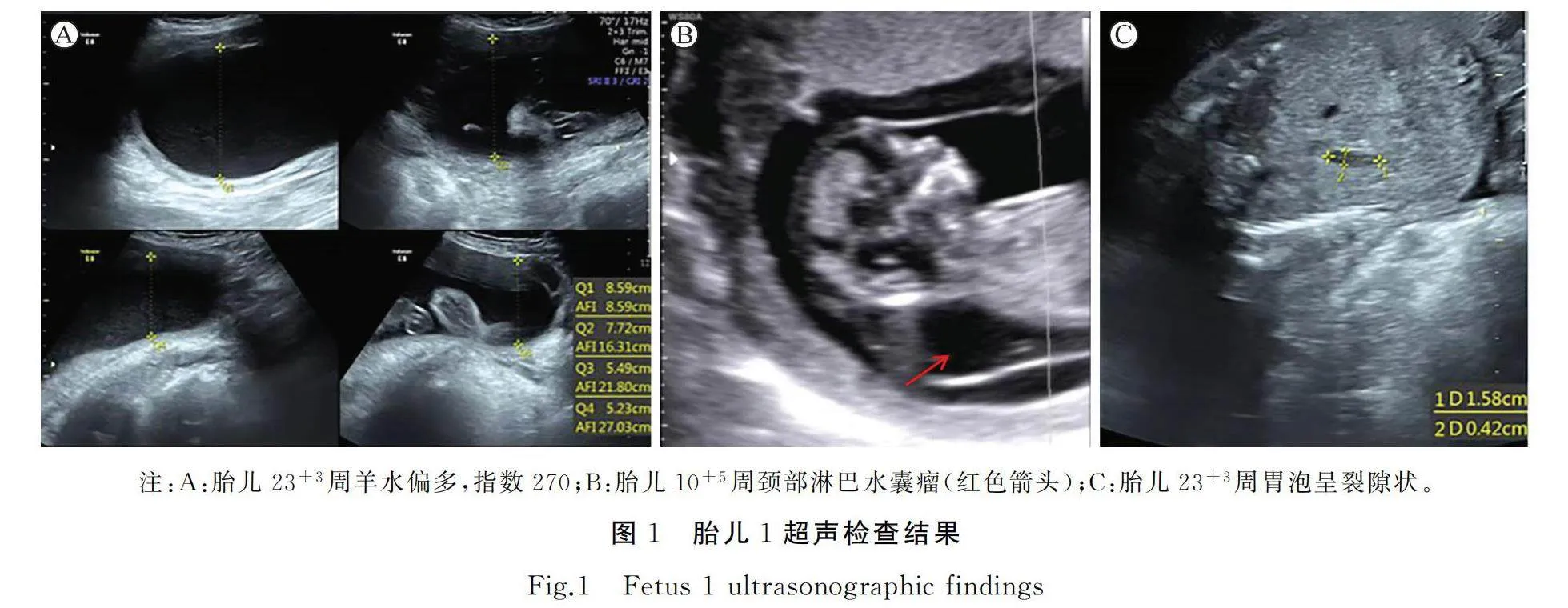
胎儿1:本次妊娠10+5周的胎儿超声提示颈部淋巴水囊瘤(25mm×11mm×21mm)(图1B),经患者知情同意后抽取绒毛进行染色体微阵列分析(chromosomal microarray analysis,CMA)检测,未发现胎儿拷贝数变异,17+3周的胎儿超声提示下颌略回缩,下颌骨长约19mm,颈背部水囊瘤,双肾肾盂分离约5mm,左心室强光点,23+3周的胎儿超声提示胎儿偏大两周,羊水过多,羊水指数270mm(图1A),双肾实质回声增强,胃泡裂隙状(图1C),生长比例不协调,颈背部淋巴水囊瘤,心脏超声提示心轴偏左,左心房偏小,卵圆孔血流受限。
胎儿2:本次妊娠超声提示单脐动脉,产前血清学筛查提示MOM值异常,NIPT提示低风险,21+1周超声提示羊水偏多,指数215mm,心率偏快,为164次/分钟。23周超声提示偏大约10天,羊水指数283mm,肾盂轻度分离,胎儿心超提示少量心包积液(图2C),胎心157次/分钟,24+5周超声提示羊水指数303,双肾肾盂分离,左侧4mm,右侧3mm,27+4周超声提示胎儿偏大2~3周(头围、腹围),羊水指数429mm(图2A),左侧胸腔少量积液(图2B),室壁增厚(图2B),胸腺增大,下颌略后缩,下颌面部角53.5度。
2.2遗传学检测及致病性基因变异
胎儿1、2的CNV结果为arr(1-22)x2、(XY)x1。WES结果提示两例胎儿分别携带HRAS基因c.35G>T(p.Gly12Val)和c.34G>T(p.Gly12Cys)杂合错义变异,父母均未携带相同变异,Sanger测序验证考虑为新发突变(图3、图4)。参照ACMG相关指南和标准判定胎儿1变异c.35G>T(p.Gly12Val)为致病性变异(PS3_Moderate+PS2+PM5+PP3+PM2_Supporting)。其评级依据如下:体外功能实验研究表明,该变异可能影响蛋白的功能(PS3_Moderate),Sanger测序结果提示患儿父母未检出该变异,证实为新发变异(PS2),同一氨基酸残基上存在其它致病变异(PM5),多个生信预测软件预测该变异可对基因或基因产物造成有害影响(PP3),该变异为罕见变异,在gnomAD东亚普通人群数据库中未收录(PM2_Supporting)。胎儿2变异c.34G>T(p.Gly12Cys)为致病性变异(PM2_Supporting+PS4+PP4+PS2_Moderate+PP3+PM5)。其评级依据如下:GnomAD等数据库均未收录该变异(PM2_Supporting),已有文献报道CSTLO患者中检测到HRAS基因变异c.34G>T(PS4+PP4),Sanger测序结果提示患儿父母未检出该变异,证实为新发变异(PS2_Moderate),REVEL功能预测软件结果偏向于致病性变异(PP3),同一氨基酸残基上存在其它致病变异(PM5)。
2.3文献汇总
共检索到符合条件的中文文献2篇,英文文献14篇,包括本研究中的2例,共发现26例HRAS基因变异的胎儿,其中男性15例,女性10例,1例性别未知,见表2。临床症状主要包括:羊水过多85%(22/26),心血管异常92%(24/26),早产83%(20/24),特殊面容81%(21/26),过度生长42%(11/26),心动过速54%(14/26),肾盂分离23%(6/26),股(长)骨偏短19%(5/26),手腕尺侧偏12%(3/26),NT增厚12%(3/26),积液35%(9/26),水肿19%(5/26),胃部异常12%(3/26),肿瘤12%(3/26),隐睾12%(3/26),眼球震颤8%(3/26)。共检出HRAS基因突变7种错义突变,其中c.34G>A(p.G12S)突变8例(40.9%),c.34G>T(p.G12C)突变6例,c.35G>A(p.G12D)突变5例,c.35G>C(p.G12A)突变2例,c.35G>T(p.G12V),c.35_36GC>AA(p.G12E),c.37G>T(p.G13C)突变各有1例,另有2例变异位点未知,所有变异均为新发变异。截至2023年11月,HGMD与Locus Specific Database list数据库中检索到HRAS基因共有38个错义突变,约37%(14/38)分布于2号外显子,第12,13位氨基酸错义突变占29%(11/38),具体分布见图5。
3讨论
3.1 Costello综合征的临床表现
Costello综合征于1971年首次发现,是一种涉及多系统异常的常染色体显性遗传罕见病,临床特征主要包括产前羊水过多、过度生长、出生后发育不良、喂养困难、面部特征粗糙、毛发稀疏卷曲、皮肤松弛柔软、手掌和足底有很深的皱纹、智力障碍、并引起心血管、内分泌和胃肠疾病等[1]。多数Costello综合征患者表现出多器官受累,表型谱很广,从轻型到出现致死性并发症均有涉及。羊水过多是Costello综合征产前超声诊断最典型的特征,占比超过70%[1]。由肥厚性心肌病、先天性心脏缺陷、心律失常和/或高血压等引起的呼吸窘迫、心力衰竭是Costello综合征早期婴幼儿死亡最常见原因,约占84%[17]。对Costello综合征胎儿回顾性分析发现,85%的胎儿出现了羊水偏多,心血管异常比例达到了92%,与文献报道较一致[8]。Myers等发现Costello综合征胎儿肾脏异常高达83%,主要表现为肾脏回声、肾盂扩张和肾盂扩张[18]。本研究中肾脏异常胎儿占比约27%,这与Myers等的研究结果相差较多,这可能由于文献中产前病例数较少。其他产前症状包括颈部透明层(nuchal translucency,NT)增厚、手腕尺侧偏、长骨股骨偏短、眼球震颤、隐睾等。Gripp等发现Costello综合征患者存在进行性中枢神经系统异常,主要表现为产前过度生长和出生后小脑过度生长,导致Chiari I型畸形的发生,并伴有后颅窝拥挤或小脑扁桃体疝等[19]。本研究发现的两例胎儿超声提示胎儿偏大、羊水过多、肾盂分离、心血管异常、下颌略回缩等,与Costello综合征特征相符。
3.2 Costello综合征的发病机制
HRAS基因突变后蛋白过度激活导致功能获得而引起Costello综合征,HRAS基因位于11p15.5,包含6个外显子,共编码189个氨基酸,是目前发现唯一与Costello综合征相关的基因,属于RAS癌基因家族,该家族基因还包括KRAS,NRAS,均在Ras/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中起重要作用[20]。Ras蛋白是一种小的鸟苷酸结合的GTPase,在活性GTP结合形式和非活性GDP结合形式之间循环,Ras在MAPK通路以生长因子的形式从细胞外输入激活,激活的Ras导致下游的Raf、MAPK激酶MEK1和/或MEK2依次磷酸化并最终激活效应器ERK1和ERK2。ERK1和ERK2底物可作为核组分、转录因子、膜蛋白和蛋白激酶参与和控制细胞的周期进程、生长、分化、转录、增殖、凋亡和运动[21]。MAPK通路的组分和调节因子发生种系基因突变导致的疾病统称为RASopathies病[1],每一种RASopathies病有独特的表型,由于共同的调节机制,同时特征相互重叠。在RASopathies患者中,Costello综合征患者发展为恶性肿瘤的风险最高,Costello综合征患者患肿瘤的风险约为15%,乳头状瘤和横纹肌瘤是Costello综合征中最常出现的良性和恶性肿瘤[22]。
3.3 HRAS基因型与表型相关性
截至2023年11月,HGMD与Locus Specific Database list数据库中检索到HRAS基因共38个错义突变,约95%Costello综合征是由12或13位甘氨酸突变引起[23],p.G12S错义改变会引起经典的Costello综合征,占比约80%[20]。本次回顾性分析24例Costello综合征胎儿的病例发现,p.G12S错义突变占31%,远低于既往报道,其原因可是统计病例数量较少,未涉及成人及儿童。同时还发现Costello综合征不同突变位点的胎儿表型略有差异。8例p.G12S变异胎儿中有4例出现了大头畸形,2例出现了隐睾、眼球震颤合并肿瘤。Shankar等发现Costello患者有屈光不正、斜视、眼球震颤、立体视缺失和视神经异常,提示HRAS和Ras通路在视觉系统发育中起重要作用[24]。另外,已报道的泌尿生殖系统异常包括鞘膜积液、腹股沟疝、阴唇发育不全或小阴唇突出[1]。本研究中2例p.G12A突变胎儿均表现出严重喂养困难,整体发育迟缓,肌张力低,预后不良,其中1例还存在NT增厚。Kerr等回顾了43例Costello综合征患者发现p.G12A变异的患者恶性肿瘤发生率可能更高,个体表型可能更严重[25]。p.G12C突变共6例,死因均为心肺功能异常,值得注意的是,本研究中有3例胎儿出现了肾盂扩张的症状,病例10出生后出现肝血管瘤,病例2出现手腕尺侧偏情况。5例p.G12D突变胎儿均出现呼吸衰竭或障碍,其中2例出现全身水肿情况,病例5、8出现了手腕尺侧偏的情况。p.G12E突变胎儿表现为头围偏大、股骨偏短、脑室肿胀,心室肥厚,最后死于呼吸衰竭。本文统计中,共11例出现心力衰竭或呼吸衰竭、窘迫或心包积液的症状,其中p.G12D、p.G12C和p.G12E错义突变占75%,Lo,Kerr,Weaver等先后报道了这些位点变异与严重的心肌病、胸膜和心包积液以及肺部异常相关[6,10,25]。Gripp等比较了12例Costello综合征p.G13C患者与p.G12S患者,发现p.G13C突变患者面容粗糙程度低,患肿瘤的机率相对较低,表型较温和[26]。本研究中有1例p.G13C杂合错义突变胎儿,29w早产,出生时左胸腔积液,呼吸困难,腹水,脑室透明隔囊肿,喂养困难,皮下脂肪组织减少,特殊面容、双侧隐睾,在治疗与康复后11个月龄神经、运动、社交等技能恢复良好,提示p.G13C突变胎儿结局可能更良好。病例25携带p.G12V错义突变,该突变并不常见,通常与严重的心肌病和心动过速以及导致早期死亡的呼吸窘迫有关[27]。Van等发现HRAS基因中p.G12V等四种突变会增强下游HRAS信号传导,这表明HRAS持续激活可能是骨骼肌发育异常原因[28]。Guimaraes在小鼠门牙作为模型系统证明了Ras信号在Costello综合征患者的牙釉质形成中的核心作用[29]。Schuhmacher发现p.G12V突变小鼠出现了与Costello综合征患者相似的表型,包括面部畸形、心肌病、高血压[30]。其他罕见的HRAS基因突变中,p.E63_D69dup,p.T58I,p.K117R,p.A146V,p.A146P突变患者的表型相对温和,肿瘤发病风险较低,粗糙面容程度较低等[25,31-32]。以上分析表明Costello综合征患者可能存在基因型-表型相关性,同一突变位点临床表型可能存在异质性,但仍需进一步研究。
综上所述,我们明确了HRAS基因突变为两例胎儿多发畸形的致病原因,并结合已报道的Costello综合征胎儿的临床症状及变异位点进行分析,发现HRAS基因突变导致的Costello综合征可能存在基因型与表型相关性,但由于产前表型有限及临床异质性,具体基因型与表型相关性仍需要更多的数据支持。
[参考文献]
[1]Gripp K W,Morse L A,Axelrad M,et al.Costello syndrome:clinical phenotype,genotype,and management guidelines[J].Am J Med Genet A,2019,179(9):1725-1744.
[2]Aoki Y,Niihori T,Kawame H,et al.Germline mutations in HRAS proto-oncogene cause Costello syndrome[J].Nat Genet,2005,37(10):1038-1040.
[3]Van den Bosch T,Van Schoubroeck D,Fryns J P,et al.Prenatal findings in a monozygotic twin pregnancy with Costello syndrome[J].Prenat Diagn,2002,22(5):415-417.
[4]Kaji M,Kurokawa K,Hasegawa T,et al.A case of Costello syndrome and glycogen storage disease type Ⅲ[J].J Med Genet,2002,39(2):E8.
[5]Piccione M,Piro E,Pomponi M G,et al.A premature infant with Costello syndrome due to a rare G13C HRAS mutation[J].Am J Med Genet A,2009,149A(3):487-489.
[6]LoI F,Brewer C,Shannon N,et al.Severe neonatal manifestations of Costello syndrome[J].J Med Genet,2008,45(3):167-171.
[7]Kuniba H,Pooh R K,Sasaki K,et al.Prenatal diagnosis of Costello syndrome using 3D ultrasonography amniocentesis confirmation of the rare HRAS mutation G12D[J].Am J Med Genet A,2009,149A(4):785-787.
[8]Lin A E,O’Brien B,Demmer L A,et al.Prenatal features of Costello syndrome:ultrasonographic findings and atrial tachycardia[J].Prenat Diagn,2009,29(7):682-690.
[9]Lorenz S,Petersen C,Kordass U,et al.Two cases with severe lethal course of Costello syndrome associated with HRAS p.G12C and p.G12D[J].Eur J Med Genet,2012,55(11):615-619.
[10]Weaver K N,Wang D,Cnota J,et al.Early-lethal Costello syndrome due to rare HRAS Tandem Base substitution (c.35_36GC>AA;p.G12E)-associated pulmonary vascular disease[J].Pediatr Dev Pathol,2014,17(6):421-430.
[11]Choi N,Ko J M,Shin S H,et al.Phenotypic andgenetic characteristics of five korean patients with Costello syndrome[J].Cytogenet Genome Res,2019,158(4):184-191.
[12]蒋鸿鹏,邢德强,王廷勇,等.1例试管婴儿患Costello综合征的基因诊断[J].中国优生与遗传杂志,2021,29(3):372-374.
[13]Nwakalor C,Said-Delgado S,Krinshpun S,et al.De novo HRAS gene mutation associated with Costello syndrome identified by non-invasive cell-free fetal DNA screening[J].Prenat Diagn,2021,41(1):11-14.
[14]Zhang P,Zhang R,Zhang L,et al.A case of Costello syndrome diagnosed by extremely rapid whole genome sequencing[J].Zhonghua Er Ke Za Zhi,2022,60(2):139-141.
[15]Syu Y M,Lee H C,Chang J H,et al.Rapid weight loss and severe failure to thrive mimicking lipodystrophy syndrome in a 1-year-old Taiwanese girl with Costello syndrome[J].Children(Basel),2022,9(6):905.
[16]Lan L B,Li D Z.Idiopathic polyhydramnios and foetal macrosomia in the absence of maternal diabetes:clinical vigilance for costello syndrome[J].J Obstet Gynaecol,2022,42(4):704-706.
[17]Chinton J,Huckstadt V,Moresco A,et al.Clinical and molecular characterization of children with Noonan syndrome and other RASopathies in Argentina[J].Arch Argent Pediatr,2019,117(5):330-337.
[18]Gripp K W,Lin A E.Costello syndrome:a Ras/mitogen activated protein kinase pathway syndrome (rasopathy) resulting from HRAS germline mutations[J].Genet Med,2012,14(3):285-292.
[19]Siegel D H,McKenzie J,Frieden I J,et al.Dermatological findings in 61 mutation-positive individuals with cardiofaciocutaneous syndrome[J].Br J Dermatol,2011,164(3):521-529.
[20]Leoni C,Viscogliosi G,Tartaglia M,et al.Multidisciplinary management of Costello syndrome:current perspectives[J].J Multidiscip Healthc,2022,15:1277-1296.
[21]Guo Y J,Pan W W,Liu S B,et al.ERK/MAPK signalling pathway and tumorigenesis[J].Exp Ther Med,2020,19(3):1997-2007.
[22]Ney G,Gross A,Livinski A,et al.Cancer incidence and surveillance strategies in individuals with RASopathies[J].Am J Med Genet C Semin Med Genet,2022,190(4):530-540.
[23]Hebron K E,Hernandez E R,Yohe M E.The RAS-opathies:from pathogenetics to therapeutics[J].Dis Model Mech,2022,15(2):dmm049107.
[24]Shankar S P,Fallurin R,Watson T,et al.Ophthalmic manifestations in Costello syndrome caused by Ras pathway dysregulation during development[J].Ophthalmic Genet,2022,43(1):48-57.
[25]Kerr B,Delrue M A,Sigaudy S,et al.Genotype-phenotype correlation in Costello syndrome:HRAS mutation analysis in 43 cases[J].J Med Genet,2006,43(5):401-405.
[26]Gripp K W,Hopkins E,Sol-Church K,et al.Phenotypic analysis of individuals with Costello syndrome due to HRAS p.G13C[J].Am J Med Genet A,2011,155A(4):706-716.
[27]Quezada E,Gripp K W.Costello syndrome and related disorders[J].Curr Opin Pediatr,2007,19(6):636-644.
[28]Fowlkes J L,Thrailkill K M,Bunn R C.RASopathies:the musculoskeletal consequences and their etiology and pathogenesis[J].Bone,2021,152:116060.
[29]Guimaraes L M,Coura B P,Gomez R S,et al.The molecular pathology of odontogenic tumors:expanding the spectrum of MAPK pathway driven tumors[J].Front Oral Health,2021,2:740788.
[30]Schuhmacher A J,Guerra C,Sauzeau V,et al.A mouse model for Costello syndrome reveals an Ang Ⅱ-
mediated hypertensive condition[J].J Clin Invest,2008,118(6):2169-2179.
[31]Chiu A T,Zhu L,Mok G T,et al.Before and after-nutritional transformation of dysmorphism in a case of Costello syndrome[J].Eur J Med Genet,2016,59(11):573-576.
[32]Singh J,Karunaraj P,Luf M,et al.Lysines K117 and K147 play conserved roles in Ras activation from drosophila to mammals[J].G3(Bethesda),2023,13(11):jkad201.
[专业责任编辑:于学文]
[中文编辑:向婉婉;英文编辑:方 柳]
