苏云金芽孢杆菌对茶尺蠖肠道细菌多样性的影响
2025-02-19金若珩李晓宇姚经武王蓓蓓曹春霞黄大野


摘要:茶尺蠖(Ectropis obliqua)是茶叶上的重要害虫,给茶叶产业带来严重经济损失。苏云金芽孢杆菌(Bacillus thuringiensis, Bt)作为防治茶尺蠖的关键生物杀虫剂,在茶尺蠖的绿色防控中发挥重要作用。为明确Bt处理对茶尺蠖幼虫肠道菌群的影响,基于Illumina平台,采用16S rDNA高通量测序技术对不同水平Bt悬浮液处理的茶尺蠖幼虫肠道细菌的群落结构和种群多样性进行比较分析。结果表明,使用低剂量Bt处理茶尺蠖幼虫后,其肠道细菌组成与对照处理相比并未发生明显变化;但在较高剂量Bt处理下,茶尺蠖幼虫肠道细菌的群落多样性及丰度显著增加,表明茶尺蠖幼虫肠道细菌群落参与了对Bt侵染的响应。以上研究结果为深入探究Bt杀虫机制提供依据,并为提高Bt杀虫毒力提供新的思路。
关键词:茶尺蠖;苏云金芽孢杆菌;生物防治;肠道细菌;16S rDNAdoi:10.13304/j.nykjdb.2023.0794
中图分类号:S476 文献标志码:A 文章编号:1008‐0864(2025)02‐0141‐09
在长期的协同进化过程中,昆虫与其肠道微生物形成了密不可分的互利共生关系[1]。寄主昆虫为微生物提供稳定的生存环境和必要的营养物质[2‐3],在影响微生物的群落结构和代谢活动的同时赋予肠道微生物种类多样性和符合宿主特异性的特点[4‐5]。昆虫肠道微生物是调控宿主生物学性状的重要调节因子,参与调控宿主食物分解和营养获取、解毒、免疫防御功能,促进昆虫生长、生殖和发育[6-9]。研究表明,甘蔗害虫小蔗杆草螟(Diatraea saccharalis)肠道中的克雷伯氏杆菌具有降解甘蔗残余废物的作用,能够协助宿主对甘蔗的取食和利用[10];舞毒蛾(Lymantria dispar)肠道中的不动杆菌属细菌能够降解山杨产生的酚苷类化合物,保护宿主在进食后不受有毒物质的影响[11]。肠道微生物群落在正常状态下维持正常生长模式,一旦肠道环境改变或受外源物质的胁迫,肠道微生物为应对环境变化会发生变化,从而导致肠道微生物在种群密度、物种丰富度以及物种优势度等方面产生差异[12‐13]。
苏云金芽孢杆菌(Bacillus thuringiensis, Bt)是一种自然界普遍存在的革兰氏阳性菌,对鞘翅目、双翅目、鳞翅目等500多种昆虫具有较好的杀虫活性,是目前世界范围内产量最大、应用最广的生物杀虫剂之一[14]。Bt的杀虫作用是通过产生具有杀虫活性的伴孢晶体,这种晶体可与昆虫中肠上皮细胞的特异性受体结合,造成中肠膜穿孔、细胞溶解,最终导致昆虫死亡[15]。研究表明,在Bt毒蛋白Cry2Ab 蛋白的影响下,捕食性昆虫龟纹瓢虫(Propylaea japonica)体内优势共生菌的基因拷贝数会发生明显变化[16]。但是,Bt毒蛋白是否会影响害虫体内肠道微生物的多样性及其组成,目前尚不得知。
茶尺蠖(Ectropis obliqua)属鳞翅目(Lepidoptera)尺蠖蛾科(Geometridae),是为害茶叶的毁灭性害虫[17]。茶尺蠖主要以幼虫大量取食茶树叶片为害,严重时将茶园茶树的叶片和嫩芽吃光,使茶树仅留秃枝,致使树势衰弱、耐寒力差、易受冻害,严重制约了茶叶的优质高效生产,常年造成茶叶产量损失约15%[18]。目前化学农药仍是茶园防治尺蠖的重要手段,但其容易导致“3R”问题,即抗性(resistance)、再增猖獗(resurgence)和残留(residue),不利于茶园的可持续发展。利用病毒、真菌和细菌进行生物防控是茶尺蠖绿色防控的关键[19-21]。Bt作为重要生物杀虫剂,在茶尺蠖的绿色防控中发挥了重要作用[22],通常和茶尺蠖核型多角体病毒混用对茶尺蠖具有较好的防治效果。但茶尺蠖受到Bt刺激后其肠道微生物是如何进行响应的,目前仍不清楚。
为明确Bt处理对茶尺蠖幼虫肠道菌群的影响,本研究基于16S rDNA 序列的高通量测序技术,对不同剂量Bt处理后的茶尺蠖肠道微生物多样性进行分析,为揭示昆虫肠道微生物对微生物杀虫剂的响应模式、茶尺蠖生物防治新靶标与新技术的开发提供理论依据。
1 材料与方法
1.1 供试菌株及试虫饲养
苏云金芽孢杆菌novonest4菌株为湖北省生物农药工程研究中心菌株资源库保藏菌株,保藏编号为CCTCC NO: M2018443。供试茶尺蠖幼虫由武汉科诺生物科技股份有限公司提供,在人工气候养虫室内使用茶树嫩苗继代饲养,选取3龄幼虫为供试虫源。饲养温度为(25±1)℃,相对湿度为85%±5%,光周期16 h光照/8 h黑暗。
1.2 试虫处理及样品采集
选取大小一致、生长健康的茶尺蠖3龄幼虫,分别配制Bt 悬液(1×109 CFU·mL-1)及其50、100和200倍稀释液。采用浸叶法[23]通过Bt悬液的50(Bt50)、100(Bt100)和200倍稀释液(Bt200)浸泡茶树嫩苗,以清水浸泡为对照(CK);然后用浸泡后的茶树嫩苗饲喂供试幼虫。
试虫处理24 h后收集茶尺蠖肠道组织,首先用75%乙醇对存活的茶尺蠖幼虫进行表面消毒后;使用无菌水漂洗虫体3次;然后在无菌操作条件下将幼虫解剖并取出完整肠道;用无菌水缓慢清洗后取其肠道内容物,放入已加入1 mL PBS缓冲液的离心管中。每管收集15头幼虫的肠道组织,每处理3次重复。采集的茶尺蠖肠道样品研磨均匀后冷冻保存于-80 ℃冰箱,用于后续试验。
1.3 茶尺蠖肠道微生物DNA 提取与测序
使用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取茶尺蠖幼虫肠道微生物总DNA,采用紫外可见分光光度计检验DNA的质量和含量后保存于-20 ℃待用。
以细菌基因组DNA 为模板,利用TransStartFastpfu DNA Polymerase (NEB, USA),使用带Barcode的特异性引物扩增16S rDNA基因V3~V4高变区。PCR产物经2%的琼脂糖凝胶电泳检测后,用AXYGEN公司的凝胶回收试剂盒进行切胶回收;然后将回收产物进行荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit,定量仪器为Microplate reader(BioTek,FLx800)。根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合,采用Illumina 平台TruSeqNano DNA LT Library Prep Kit制备测序文库,进行双端测序。
1.4 数据分析
利用FLASH 软件(v1.2.7,http://ccb.jhu.edu/software/FLASH/)对测序获得的原始数据进行截取和过滤,运用QIIME 软件(Quantitative InsightsInto Microbial Ecology,v1.8.0,http://qiime.org/)剔除5’端引物错配碱基数gt;1的序列、含有连续相同碱基数gt;8 的序列及嵌合体序列,即得到有效序列,用于后续分析。
使用QIIME 软件,调用序列比对工具UCLUST,对获得的有效序列按97% 的序列相似度进行归并和OTU(operational taxonomic units)划分,并选取每个OTU 中丰度最高的序列作为该OTU 的代表序列,OTU 丰度矩阵中需去除稀有OTU。以Greengenes 数据库(Release 13.8,http://greengenes.secondgenome.com/)为参考数据库进行物种注释分析。使用QIIME软件分别对每个样本计算Chao指数、ACE指数、Shannon指数、Simpson指数,并用R软件绘制稀释曲线、Venn图等,进行各分类上的生物类群统计。通过LEfSe(lineardiscriminant analysis effect size)聚类分析对样本在科和目水平进行统计检验和差异显著性分析。
2 结果与分析
2.1 不同 Bt 处理下茶尺蠖幼虫肠道细菌的OTU分析
由图1可知,随着各样本测序数量增大,曲线由起初的急剧增长逐步趋于平缓,表明所测序列能够反映当前样本所包含的多样性,继续增加测序深度已无法检测到大量新OTU。由此说明,本次测序量充足,可充分反映所测茶尺蠖肠道细菌的物种广度,可用于后续分析。
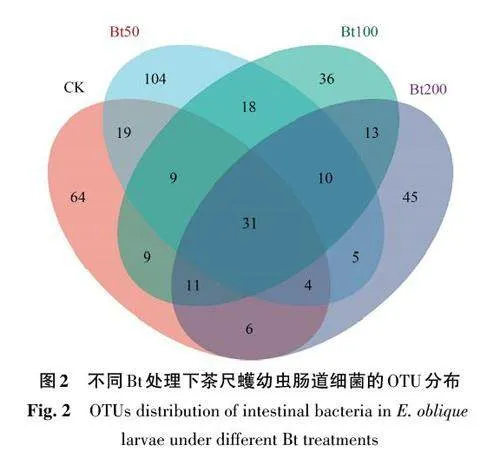
CK、Bt50、Bt100、Bt200处理茶尺蠖幼虫肠道细菌的OTU 数量分别为153、200、137 和125,Bt50处理茶尺蠖幼虫肠道细菌的OTU数量高于CK和其他Bt处理,细菌的种类也较其他处理更加丰富(表1)。
由图2可知,4个处理共有的OTU数量为31,而CK、Bt50、Bt100和Bt200处理特有的OTU数量分别为64、104、36和45。综上表明,不同Bt处理对茶尺蠖幼虫肠道细菌组成存在显著影响。
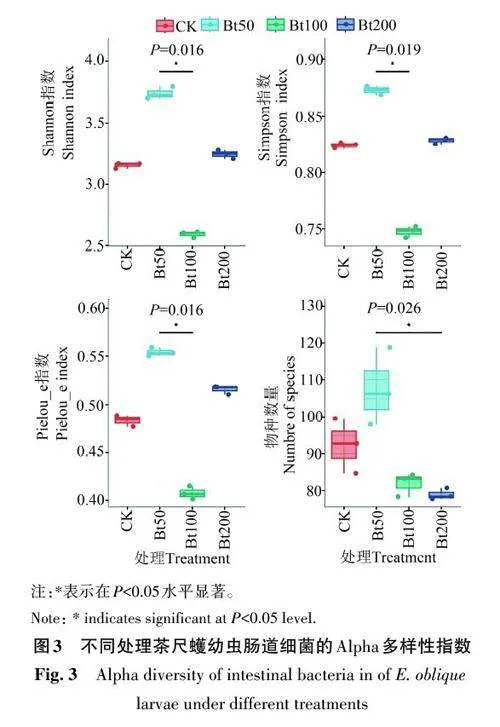
2.2 不同Bt 处理对茶尺蠖幼虫肠道细菌群落Alpha 多样性的影响
Shannon 指数、Simpson 指数和Pielou_e 指数分别代表微生物群落的多样性、丰富度和均匀度,使用QIIME软件分析不同处理茶尺蠖肠道细菌群落的Alpha多样性,结果如图3所示。Bt50处理茶尺蠖幼虫肠道细菌群落的多样性、丰富度和均匀度均最高。此外,Bt10和Bt200处理茶尺蠖肠道细菌群落的物种数量较CK 处理有所降低,而Bt50处理的物种数量显著增加。综上表明,Bt对茶尺蠖幼虫肠道细菌群落Alpha多样性的影响因Bt剂量的不同而存在差异。
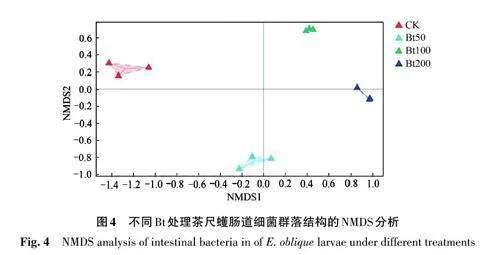
2.3 不同Bt 处理对茶尺蠖幼虫肠道细菌群落Beta 多样性的影响
无度量多维标定法(non-metric multidimensionalscaling, NMDS, stresslt;0.2)统计是一种基于样本距离矩阵的分析方法,通过降维处理展现样本特定的距离分布,能够有效反映不同样本间细菌种类差异性,如图4所示。不同Bt处理的数据散点独立分开,即不同处理间均存在显著差异,说明不同剂量Bt处理的茶尺蠖幼虫肠道细菌群落在种类组成上具有显著差异。
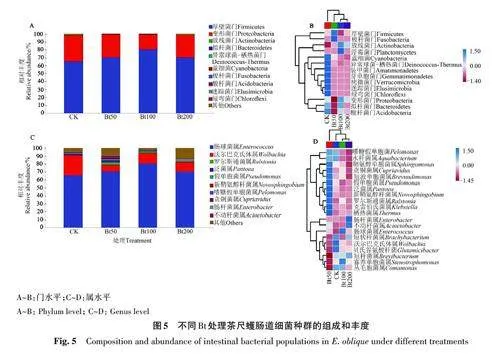
2.4 不同Bt 处理对茶尺蠖肠道细菌种群组成和丰度的影响
不同Bt处理茶尺蠖肠道细菌群落在各分类水平上的物种组成如图5所示。在门水平上,不同Bt处理茶尺蠖肠道的细菌群落组成与CK差异较小,优势菌门均为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)(图5A);但随着Bt剂量的增加,厚壁菌门的相对丰度呈现先升高后降低趋势,而变形菌门的相对丰度表现为先降低后升高趋势(图5B)。在属水平上,不同处理间肠道细菌群落的组成也没有明显差异,优势菌属均为肠球菌属(Enterococcus)和沃尔巴克氏菌属(Wolbachia)(图5C);此外,肠球菌属的丰度随Bt剂量的增加呈先上升后下降趋势,而沃尔巴克氏菌属的丰度表现出先降后升的趋势(图5D)。
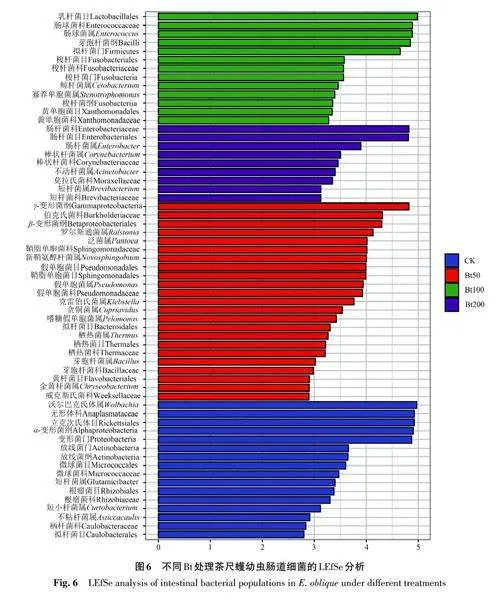
2.5 不同Bt 处理后茶尺蠖幼虫肠道样本组间物种差异显著性分析
为寻找不同样本间具有统计学差异的生物标志物,采用LEfSe分析筛选出不同Bt处理茶尺蠖幼虫肠道的特征微生物,结果如图6所示。其中Bt50处理后茶尺蠖幼虫的肠道细菌类群与其他处理相比差异较大,有23个类群存在显著差异,其中γ-变形菌纲(Gamma Proteobacter)最具鉴别性;在CK处理中,有16个类群存在显著差异,主要集中在沃尔巴克氏菌属(Wolbachia)、无形体科(Anaplasmataceae)、立克次氏体目(Rickettsiales)、α-变形菌纲(AlphaProteobacteria)和变形菌门(Proteobacteria)。
3 讨论
昆虫体内存在丰富的共生菌群落,在长期的进化过程中,肠道微生物与其宿主形成了共生关系,对宿主的生长发育、繁殖及免疫等生理功能具有重要作用。昆虫体内的共生菌种群动态受多种因素影响,如宿主生物型和地理种群、寄主植物种类、温度等环境条件均能影响共生菌的感染[24]。本研究通过Illumina平台采用16S rDNA高通量测序分析比较不同Bt处理下茶尺蠖幼虫肠道共生菌的群落结构和多样性,结果表明,高剂量Bt胁迫会显著增加茶尺蠖幼虫肠道共生菌的群落多样性及丰度,暗示其肠道共生菌参与抵御苏云金芽孢杆菌的侵染,能够协同提高宿主对昆虫病原细菌的免疫作用。
本研究表明,4个处理下茶尺蠖幼虫肠道细菌群落中最主要优势菌属均为肠球菌属,而肠球菌属也是拥有Bt蛋白抗性的棉铃虫肠道共生细菌的优势菌属[25]。肠球菌为革兰氏阳性菌,在自然界和昆虫肠道中广泛分布,是多种鳞翅目昆虫如稻纵卷叶螟(Cnaphalocrocis medinalis)、菜青虫(Pieris rapae)、甜菜夜蛾(Spodoptera exigua)、舞毒蛾等肠道中的优势菌[26]。由于鳞翅目昆虫的肠道大多为碱性环境,肠球菌可通过乙酸盐的生成来平衡肠道pH,从而降低外界毒素对昆虫的损害。研究表明,草地贪夜蛾(Spodoptera frugiperda)的食物从人工饲料转换为寄主植物时,其通过调节肠球菌属的相对丰度来降低食物变换带来的不利影响[27]。大蜡螟(Galleria mellonella)幼虫中肠的肠球菌数量会随着抗菌肽基因表达水平的升高而增加,从而提高宿主抗性[28]。此外,肠球菌属能够降低Bt杀虫蛋白对舞毒蛾和烟草天蛾(Manducasexta)的杀虫活性[29‐30]。本研究结果表明,茶尺蠖幼虫受Bt胁迫后,虽然肠球菌属的相对丰度随Bt剂量的增加呈先升高后降低趋势,但与CK处理相比,Bt 处理下肠球菌属的相对丰度均显著增加,因此,肠球菌属在茶尺蠖抵御外源细菌侵染过程中对宿主昆虫起到一定的保护作用。
除肠球菌属外,沃尔巴克氏菌属在不同处理下的相对丰度也发生了明显变化。Bt胁迫后,茶尺蠖幼虫肠道中沃尔巴克氏菌属的相对丰度显著降低,一方面是由于 Bt作为昆虫病原微生物侵入虫体后激活了昆虫的免疫系统,导致了对沃尔巴克氏菌的消除;另一方面Bt侵染后消耗了过多的营养物质,导致沃尔巴克氏菌的营养匮乏,从而使其丰度显著降低。研究表明,沃尔巴克氏菌属在对化学杀虫剂敏感的茶尺蠖肠道菌群中的相对丰度高达36.69%,而在对联苯菊酯抗性的茶尺蠖中仅占0.61%[31]。沃尔巴克氏菌是一种革兰氏阴性胞内次生共生细菌,在节肢动物体内广泛存在,并经卵传播[32‐33],其对宿主昆虫的作用主要表现在3个方面:一是改变昆虫适应环境的能力;二是通过胞质不亲和、产雌孤雌生殖、雌性化或者杀雄作用等多种方式调控昆虫生殖;三是调控媒介昆虫对一些病毒病的复制和传播能力[34-36]。然而昆虫体内的沃尔巴克氏菌属是否与宿主昆虫自身的防御及免疫体系相关以及该菌属如何调控昆虫响应异源微生物的刺激仍有待进一步研究。
宿主肠道微生物受病原微生物感染发生改变的同时,其在病原微生物侵染过程中对杀虫活性也会产生一定作用。在清除肠道共生菌的家蚕幼虫中重建一种土著肠道菌后,家蚕幼虫对Cry毒素的敏感性显著提高,其死亡率增加约40%,说明该肠道菌对Bt的杀虫效应具有增效作用[37]。然而对舞毒蛾研究发现,舞毒蛾幼虫接种库斯塔克亚种Bt菌株后,其肠道菌群数量明显增加,但肠道菌群缺失时该Bt菌株对幼虫仍具有致病力[38]。本研究基于16S rDNA测序发现,高剂量Bt处理对茶尺蠖幼虫肠道的细菌组成造成显著影响,且显著增加其肠道共生菌的群落多样性及丰度,由此推断茶尺蠖幼虫的肠道共生微生物可能参与抵御Bt的侵染,但Bt与肠道菌群之间的作用机制仍需进一步研究。
近年来,利用肠道微生物防治害虫的新理论和新策略受到广泛关注,其中,利用昆虫沃尔巴克氏菌的胞质不相容性操纵细菌导致害虫“不孕不育”,从而有效防控蚊媒疾病和农业虫害已有相关实例[39-41]。然而相关技术在茶叶害虫防治领域尚未展开应用,因此利用茶尺蠖关键肠道微生物、结合目前已有的生物防治手段是未来发展茶叶害虫绿色防控的新思路之一,相关措施和策略仍有待进一步研究。
参 考 文 献
[1] ENGEL P, MORAN N A. The gut microbiota of insectsdiversity
in structure and function [J]. FEMS Microbiol. Rev.,
2013, 37(5):699-735.
[2] PANG X J, XIAO X P, LIU Y, et al .. Mosquito C-type lectins
maintain gut microbiome homeostasis [J/OL]. Nat. Microbiol.,
2016, 1(5):16023 [2023-09-26]. https://doi.org/10.1038/nmicrobiol.
2016.23.
[3] PETERSON B F, SCHARF M E. Lower termite associations
with microbes: synergy, protection, and interplay [J/OL]. Front.
Microbiol., 2016, 7:422 [2023-09-26]. https://doi.org/10.3389/
fmicb.2016.00422.
[4] KIM J K, KIM N H, JANG H A, et al .. Specific midgut region
controlling the symbiont population in an insect-microbe gut
symbiotic association [J]. Appl. Environ. Microbiol., 2013,
79(23):7229-7233.
[5] KURAISHI T, HORI A, KURATA S. Host-microbe
interactions in the gut of Drosophila melanogaster [J/OL].
Front. Physiol., 2013, 4: 375 [2023-09-26]. https://doi.org/
10.3389/fphys.2013.00375.
[6] 黄云,詹先进,蓝家样,等.昆虫肠道微生物的研究进展[J].湖
北农业科学,2009,48(11):2888-2890.
HUANG Y, ZHAN X J, LAN J Y, et al .. Research progress on
intestinal tract microorganism of insect [J]. Hubei Agric. Sci.,
2009, 48(11):2888-2890.
[7] 张振宇,圣平,黄胜威,等.昆虫肠道微生物的多样性、功能及
应用[J].生物资源,2017,39(4):231-239.
ZHANG Z Y, SHENG P, HUANG S W, et al .. Diversity,
function and application of insect gut microbiota [J]. Biotic
Resour., 2017, 39(4):231-239.
[8] DOUGLAS A E. Multiorganismal insects: diversity and
function of resident microorganisms [J]. Ann. Rev. Entomol.,
2015, 60:17-34.
[9] HAMMER T J, BOWERS M D. Gut microbes may facilitate
insect herbivory of chemically defended plants [J]. Oecologia,
2015, 179(1):1-14.
[10] DANTUR K I, ENRIQUE R, WELIN B, et al .. Isolation of
cellulolytic bacteria from the intestine of Diatraea saccharalis
larvae and evaluation of their capacity to degrade sugarcane
biomass [J/OL]. AMB Express, 2015, 5:15 [2023-09-26]. https:
//doi.org/10.1186/s13568-015-0101-z.
[11] MASON C J, LOWE-POWER T M, RUBERT-NASON K F,
et al .. Interactions between bacteria and aspen defense
chemicals at the phyllosphere-herbivore interface [J]. J. Chem.
Ecol., 2016, 42(3):193-201.
[12] 姚志超,白帅,张宏宇.昆虫肠道防御及微生物稳态维持机
制[J].微生物学报,2018,58(6):1036-1048.
YAO Z C, BAI S, ZHANG H Y. Intestinal defense system and
mechanism of maintenance of microbiota homeostasis in
insects [J]. Acta Microbiol. Sin., 2018, 58(6):1036-1048.
[13] 王倩,刘玉升.蝗虫肠道微生物研究进展[J].微生物学通报,
2023,50(7):3137-3145.
WANG Q, LIU Y S. Advances in locust gut microbiome [J].
Microbiology, 2023, 50(7):3137-3145.
[14] SCHNEPF E, CRICKMORE N, VAN RIE J, et al .. Bacillus
thuringiensis and its pesticidal crystal proteins [J]. Microbiol.
Mol. Biol. Rev., 1998, 62(3):775-806.
[15] 刘子铎,喻子牛.苏云金芽孢杆菌及其杀虫晶体蛋白作用机
制的研究进展[J].昆虫学报,2000,43(2):207-213.
LIU Z D, YU Z N. Progress in the studies on the action
mechanism of Bacillus thuringiensis and insecticidal crystal
protein [J]. Acta Entomol. Sin., 2000, 43(2):207-213.
[16] ZHANG S, LUO J Y, JIANG W L, et al .. Response of the
bacterial community of Propylea japonica (Thunberg) to
Cry2Ab protein [J/OL]. Environ. Pollut., 2019, 254: 113063
[2023-09-26]. https://doi.org/10.1016/j.envpol.2019.113063.
[17] 葛超美,殷坤山,唐美君,等.灰茶尺蠖的生物学特性[J].浙江
农业学报,2016,28(3):464-468.
GE C M, YIN K S, TANG M J, et al .. Biological characteristics
of Ectropis grisescens Warren [J]. Acta Agric. Zhejiangensis,
2016, 28(3):464-468.
[18] 王业胜.茶叶害虫茶尺蠖的识别与防治[J].农业灾害研究,
2015,5(8):6-8,17.
WANG Y S. Study on identification and control method of tea
pest Ectropis oblique hypulina Wehrli [J]. J. Agric. Catastrophol.,
2015, 5(8):6-8,17.
[19] 陈雨思,周孝贵,曾维健,等.不同茶园灰茶尺蠖和茶尺蠖对5种
杀虫剂的抗药性监测[J].环境昆虫学报,2023,45(4):1103-1110.
CHEN Y S, ZHOU X G, ZENG W J, et al .. Resistance
monitoring of two tea geometrid moths (Ectropis obliqua and E.
grisescens) to five frequently used insecticides in different tea
plantations [J]. J. Environ. Entomol., 2023, 45(4):1103-1110.
[20] 李红莉,崔宏春,余继忠.茶尺蠖生物学特性及防治技术研究
现状[J].安徽农业科学,2017,45(19):150-151,233.
LI H L, CUI H C, YU J Z. Research advances in biological
characteristic and controlling of Ectropiso blique (Prout) [J]. J.
Anhui Agric. Sci., 2017, 45(19):150-151,233.
[21] 陈宗懋.茶园有害生物绿色防控技术发展与应用[J].中国茶
叶,2022,44(1):1-6.
CHEN Z M. Development and application of green pest control
technology in tea garden [J]. China Tea, 2022, 44(1):1-6.
[22] 李晓宇,黄大野,华登科,等.植保无人机喷施BT与藜芦碱混
配药剂对灰茶尺蠖和小贯小绿叶蝉防治效果研究[J].现代
农业科技,2021(20):89-91,105.
LI X Y, HUANG D Y, HUA D K, et al .. Control effect of BT
and veratrine mixture sprayed by plant protection UAV on
Ectropis grisescens and Empoasca onukii [J]. Modern Agric. Sci.
Technol., 2021(20):89-91,105.
[23] 林荣华,倪珏萍,姜辉,等.农药室内生物测定试验准则 杀虫
剂第14部分:浸叶法:NY/T 1154.14—2008[S].北京:中国农
业出版社,2008.
[24] GUO Z M, JIN R H, GUO Z P, et al .. Insecticide susceptibility
and mechanism of Spodoptera frugiperda on different host
plants [J]. J. Agric. Food Chem., 2022, 70:11367-11376.
[25] 姜玮瑜,梁革梅,林毅,等.对Bt蛋白抗性和敏感的棉铃虫中
肠细菌群落的比较[J].微生物学报,2010,50(6):828-834.
JIANG W Y, LIANG G M, LIN Y, et al .. Comparison of midgut
bacterial community between Bt resistant and sensitive Helicoverpa
armigera [J]. Acta Microbiol. Sin., 2010, 50(6):828-834.
[26] 杨焊.四种鳞翅目害虫肠道细菌多样性分析[D].南京:南京
农业大学,2012.
YANG H. Diversity of gut bacteria in larval of four
Lepidopteran insect species [D]. Nanjing: Nanjing Agricutural
University, 2012.
[27] 吴丽红.寄主植物对草地贪夜蛾发育与繁殖、交配行为及
肠道微生物的影响[D].贵阳:贵州大学,2022.
WU L H. Effects of host plants on the development,
reproduction, mating behavior and gut microbiota of fall
armyworm (Spodoptera frugiperda) [D]. Guiyang: Guizhou
University, 2022.
[28] 廖春丽,袁源,李绍冲,等.昆虫病原线虫共生菌NK杀虫蛋白
处理后大蜡螟幼虫中肠细菌群落的变化[J].河南城建学院
学报,2022,31(2):85-92.
LIAO C L, YUAN Y, LI S C, et al .. Change in diversity of
bacterial community in larval midguts of Galleria mellonella
after treatment with insecticidal proteins of symbiotic bacteria
NK of entomopathogenic nematodes [J]. J. Henan Univ. Urban
Construct., 2022, 31(2):85-92.
[29] BRODERICK N A, RAFFA K F, GOODMAN R M, et al ..
Census of the bacterial community of the gypsy moth larval
midgut by using culturing and culture-independent methods [J].
Appl. Environ. Microbiol., 2004, 70(1):293-300.
[30] JOHNSTON P R, CRICKMORE N. Gut bacteria are not
required for the insecticidal activity of Bacillus thuringiensis
toward the tobacco hornworm, Manduca sexta [J]. Appl.
Environ. Microbiol., 2009, 75(15):5094-5099.
[31] 赵天宇.茶尺蠖幼虫肠道细菌与联苯菊酯抗药性间关系的
研究[D].合肥:安徽农业大学,2020.
ZHAO T Y. Study on the relationship between gut bacteria of
Ectropis obliqua larva and bifenthrin resistance [D]. Hefei:
Anhui Agricutural University, 2020.
[32] WERREN J H. Biology of Wolbachia [J]. Annu. Rev. Entomol.,
1997, 42:587-609.
[33] WERREN J H, WINDSOR D M. Wolbachia infection
frequencies in insects: evidence of a global equilibrium? [J].
The Royal Soc. Proc. B, 2000,267(1450):1277-1285.
[34] BI J, WANG Y F. The effect of the endosymbiont Wolbachia on the
behavior of insect hosts [J]. Insect Sci., 2020, 27(5):846-858.
[35] BOURTZIS K, PETTIGREW M M, O'NEILL S L. Wolbachia
neither induces nor suppresses transcripts encoding antimicrobial
peptides [J]. Insect Mol. Biol., 2000, 9(6):635-639.
[36] RAINEY S M, SHAH P, KOHL A, et al .. Understanding the
Wolbachia mediated inhibition of arboviruses in mosquitoes:
progress and challenges [J]. J. Gen. Virol., 2014, 95:517-530.
[37] 郎晓磊.肠道菌对苏云金芽胞杆菌家蚕杀虫活性的作用[D].
武汉:华中农业大学,2010.
LANG X L. Effects of gut bacteria to the insecticidal activity of
Bacillus thuringiensis toward silkworm larvae [D]. Wuhan:
Huazhong Agricutural University, 2010.
[38] RAYMOND B, JOHNSTON P R, WRIGHT D J, et al .. A midgut
microbiota is not required for the pathogenicity of Bacillus
thuringiensis to diamondback moth larvae [J]. Enviorn.
Microbiol., 2009, 11:2556-2563.
[39] 朱翔宇,尤士骏,刘天生,等.节肢动物内共生菌Wolbachia 的
研究进展[J].昆虫学报,2020,63(7):889-901.
ZHU X Y, YOU S J, LIU T S, et al .. Research progress on
Wolbachia endosymbionts in arthropods [J]. Acta Entomol.
Sin., 2020, 63(7):889-901.
[40] GONG J T, LI Y, LI T P, et al .. Stable introduction of plantvirus-
inhibiting Wolbachia into planthoppers for rice protection [J].
Curr. Biol., 2020, 30(24):4837-4845.
[41] XIAO Y, CHEN H, WANG H, et al .. Structural and
mechanistic insights into the complexes formed by Wolbachia
cytoplasmic incompatibility factors [J/OL]. Proc. Natl. Acad.
Sci. USA, 2021, 118(41):e2107699118 [2023-09-26]. https://
doi.org/10.1073/pnas.2107699118.
