基于WGCNA构建的免疫相关基因模型对皮肤黑素瘤及免疫微环境的影响
2025-02-16凌晨宋攀叶金茂张海洋孙敏
[摘要]目的:基于加权基因共表达网络分析(WGCNA)构建免疫相关基因预后模型,筛选预后标记物,探索与肿瘤微环境的关系。方法:黑素瘤基因表达数据和相关临床数据从癌症基因组图谱(TCGA)和表达综合(GEO)数据库中下载。采用加权基因共表达网络分析、单因素Cox回归分析和LASSO回归分析对黑素瘤预后进行分类。采用ESTIMATE和CIBERSORT算法探讨风险评分与肿瘤免疫微环境的关系。GSEA分析用于探索生物信号通路。结果:共获得1 793个标志性的免疫相关基因,其中与黑素瘤的总生存期相关的基因有246个。五个免疫相关基因的风险评分模型显示了很强的预测能力。与当前临床特征对疾病预后预测能力相比,该评分模型具有更好的预测能力。同时高、低风险评分组之间基因集富集分析(GSEA)存在多种差异信号通路。此外,风险评分模型基因作为生物标志物与肿瘤微环境中的多种免疫细胞和免疫浸润息息相关。结论:基于加权基因共表达网络分析构建了皮肤黑色素免疫相关基因预后评估模型,为预测预后提供参考,且可能通过影响肿瘤微环境中的免疫细胞的生物学功能发挥作用。
[关键词]皮肤黑素瘤;免疫;预后;肿瘤微环境;免疫浸润
[中图分类号]R739.5" " [文献标志码]Anbsp; " [文章编号]1008-6455(2025)02-0007-07
Effects of Immune Related Gene Model Constructed Based on WGCNA on Skin Melanoma and Immune Microenvironment
LING Chen, SONG Pan, YE Jinmao, ZHANG Haiyang, SUN Min
( Department of General Surgery, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, Hubei, China )
Abstract: Objective" To construct an immune related gene prognosis model, screen prognostic markers, and explore the relationship with tumor microenvironment based on weighted gene co-expression network analysis. Methods" Melanoma gene expression data and related clinical data were downloaded from the Cancer Genome Map (TCGA) and Expression Synthesis (GEO) databases. The prognosis of melanoma was classified using weighted gene co-expression network analysis, univariate Cox regression analysis, and LASSO regression analysis. The relationship between risk score and tumor immune microenvironment was investigated using ESTIMATE and CIBERSORT algorithms. GSEA analysis was used to explore signaling pathways. Results" A total of 1793 significantly immune related genes were obtained, of which 246 genes were associated with the overall survival of melanoma. The risk scores model for five immune related genes showed strong predictive power. Compared to the current clinical features' ability to predict prognosis, this risk scores model had a better predictive capability. At the same time, there were multiple different signaling pathways in gene set enrichment analysis (GSEA) between high and low risk scores groups. In addition, five immune related genes were closely related to multiple immune cells and infiltration in the tumor microenvironment. Conclusion" Based on weighted gene co-expression network analysis and immune related genes, a prognostic evaluation model for skin melanoma was constructed, which provided a reference for predicting prognosis and might play a role by influencing the biological functions of immune cells in the tumor microenvironment.
Key words: skin melanoma; immune; prognosis; tumor microenvironment; immune cell infiltration
黑素瘤是一种威胁人民生命的恶性肿瘤,具有极高的转移率和死亡率[1-2]。2020年全球约有324 635例新增的黑素瘤患者,同年有死亡患者57 043例[3]。黑素瘤预后不良和早期诊断差导致极高死亡率。因此,提出早期诊断的方法极其重要,目前TNM分期是检测癌症分期的有效方法,对癌症预后非常重要,并为正确的治疗方法提供指导[4]。然而,有研究观察到TNM分期法相关的总生存率之间也存在差异[5]。目前随着肿瘤研究的深入,TNM分期法的临床局限性逐渐显现。因此,有必要探寻新的黑素瘤标志物来用于指导临床治疗和改善黑素瘤的预后。随着人类基因测序的进展,基于基因的生物标志物变得越来越流行。
研究发现大多数免疫系统成分与黑素瘤的发生和发展有关[6]。在肿瘤免疫中,肿瘤细胞充当抗原,而免疫细胞和白细胞通过免疫防御的趋化性浸润肿瘤组织功能。免疫逃逸也是肿瘤发生的一个重要因素。目前,许多新的免疫疗法用于治疗黑素瘤,包括PD1、PD-L1和CTLA-4抑制剂。然而,这些方法仅对少数患者有效,而大多数患者对治疗反应局限或无反应,尤其是在黑素瘤进展期间。因此,全面分析免疫基因和黑素瘤总生存率之间的相关性对于探索免疫基因和新生物标志物的潜在预后价值非常重要。
本研究目标是利用TCGA和GEO数据,基于加权基因共表达网络分析(WGCNA)构建一种新的免疫相关基因的预后模型,用于黑素瘤的免疫治疗和预后监测。同时,探索生物标志物在肿瘤中的潜在机制、与免疫细胞浸润的关系。这项研究为黑素瘤的后续个性化诊断和治疗提供了潜在指导作用。
1" 材料和方法
1.1 数据获取与处理:检索TCGA-SKCM黑素瘤样本的转录组和临床数据,用于R包分析。排除没有随访信息和生存时间小于1 d的样本。TCGA的428个黑素瘤样本用于分析。GSE65904数据集从基因表达综合数据库(GEO:https://www.ncbi.nlm.nih.gov/geo/)中检索下载。在这项研究中,生存数据小于1 d的剔除。检索了210个黑素瘤样本用于R包的外部验证分析。此外,GEO表达式文件被转换为log2(表达),以便进一步分析。免疫相关基因数据从免疫报告数据库(https://immport.niaid.nih.gov)中检索。选择来自GEO数据集、TCGA数据集和免疫组的重叠免疫相关基因进行进一步分析。
1.2 统计方法分析:所有分析均由R-4.2.1版本和相应的包进行。Kaplan-Meier生存曲线被进一步用来评估免疫评分和总生存率之间的关系,中间值设定为截断值。glmnet包用于LASSO分析。
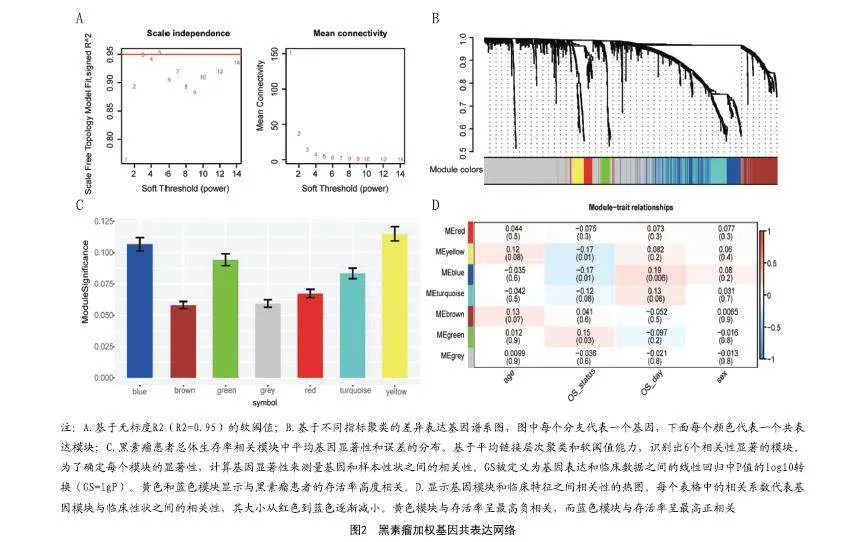
1.3 加权基因共表达网络分析:TCGA表达数据使用WGCNA包进行加权基因共表达网络分析(WGCNA)。用WGCNA探讨临床特征与表达模块的关系。模块特征基因(MEs)被定义为每个基因模块的第一主成分,并被用作每个模块中所有基因的代表。基因显著性(GS),作为每个基因的中介P值(GS=lg P),表示该模块的基因表达和临床特征之间的线性相关程度。根据P≤0.01定义生存相关模块,提取较高的GS值用于进一步分析。
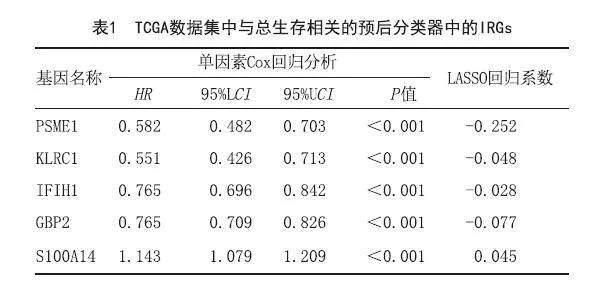
1.4 模型的建立:进行单变量Cox回归分析,以探讨每个基因对总生存率的影响。P<0.01的生存相关模块的免疫相关基因(Immune-related genes,IRG)被确定为生存相关IRG,并整合到最小绝对收缩和选择算子(LASSO)回归中,用于识别预后风险特征。每个样本的风险评分(Risk Score,RS)使用以下公式计算:风险评分=Σexpgenei* βi,构建风险预测模型。进一步进行Kaplan-Meier曲线分析,以评估风险评分与总生存率之间的关系。采用单因素和多因素Cox回归分析研究该指标与临床特征的关系。为了预测模型的准确性和预测能力,在验证集GSE65904中计算ROC曲线下面积并进行比较,以使用timeROC包检查风险预测模型的性能。
1.5 风险评分与肿瘤微环境的关系:为了探讨风险评分与黑素瘤预后的关系,本研究分析了风险评分与肿瘤微环境的关系。肿瘤微环境包括多种细胞类型,包括间充质细胞、内皮细胞、免疫细胞、炎症介质和细胞外基质分子。使用ESTIMATE算法,使用R软件确定每个样本的免疫评分,并通过Wilcoxon检验进一步比较高风险组和低风险组之间免疫细胞浸润程度的差异。
1.6 高、低风险评分组之间22种免疫细胞亚型的比较:为了探索免疫细胞亚型的差异,使用R语言中CIBERSORT软件包评估了22种免疫细胞亚类型的比例。参数设定在1 000。CIBERSORT分析结果中P<0.05的样品用于进一步分析。Mann-Whitney U检验用于比较高风险评分和低风险评分组中免疫细胞亚型的差异。
1.7 基因集富集分析(GSEA):为了确定高低风险评分组之间差异激活的信号通路,本研究通过limma包选择了一个有序的基因列表,并使用cluster包进行了基因集富集分析(GSEA),选取矫正后P<0.05。
2" 结果
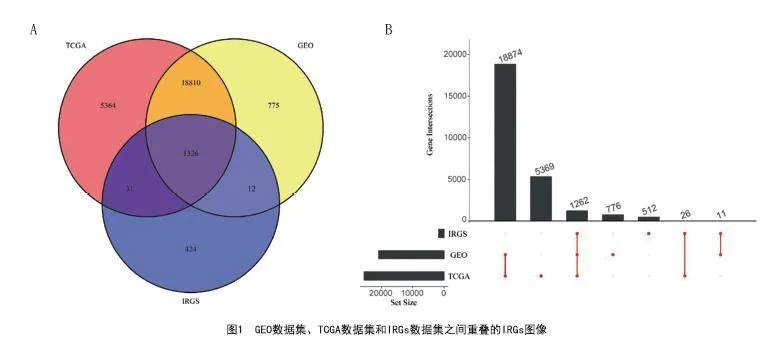
2.1 用WGCNA方法鉴定出与生存相关模块:对1326个重叠的免疫相关基因进行了WGCNA分析(见图1)。三个数据集中有1 326个IRG重叠,所用的数值代表了整体标识和探针标识所覆盖的基因符号的数量,被注释的基因数量显示在y轴上。基于无标度R2(R2=0.95)确定WGCNA的软阈值。基于平均链接层次聚类和软阈值能力识别出六个模块。其中黄色和蓝色模块显示出与黑素瘤总生存率高度相关,选择这两个模块的数据进行下一步分析(见图2)。
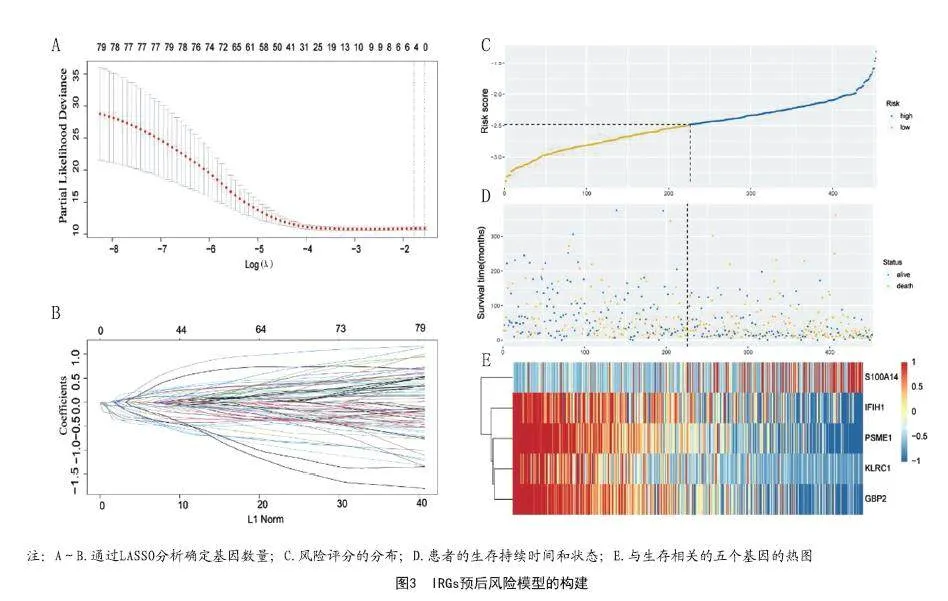
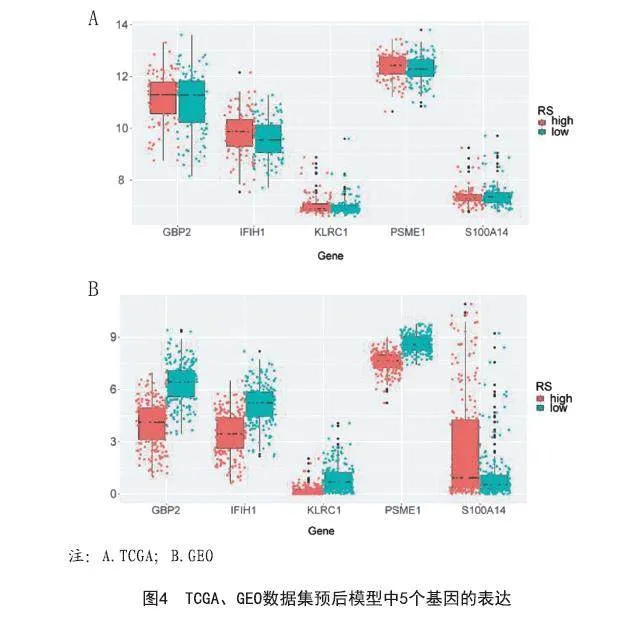
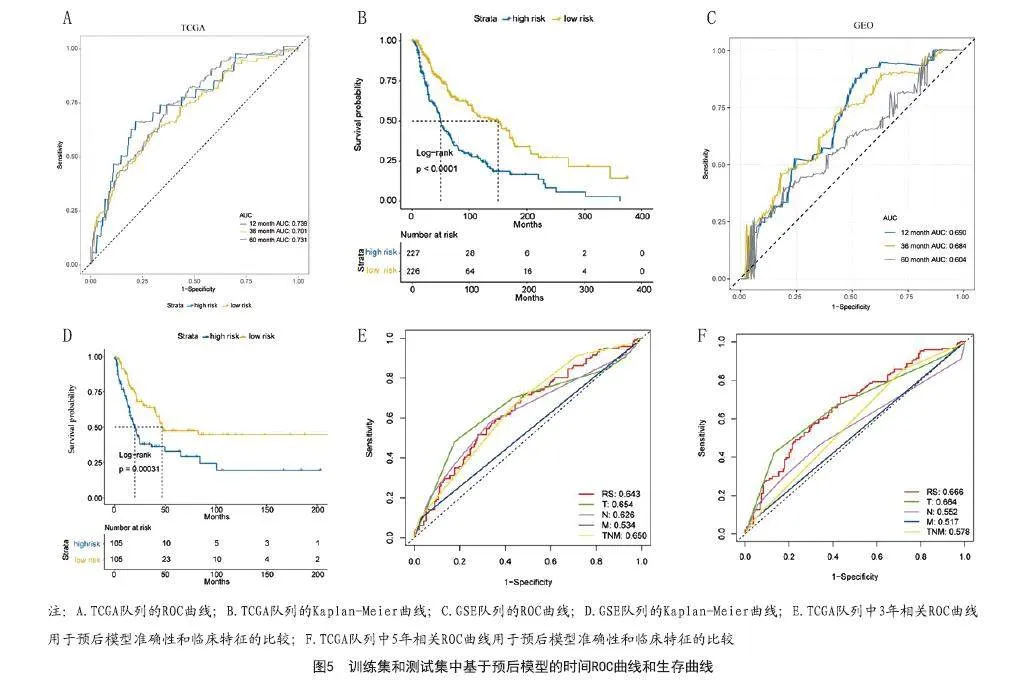
2.2 基于免疫相关基因的预测预后模型的构建:黄色和蓝色模块的IRGs被鉴定为黑素瘤的生存最佳相关的免疫相关基因,标准为P<0.01。LASSO分析确定了五个IRG(S100A14、PSME1、IFIH1、GBP2、KLRC1)(见图3)并构建预后模型(见表1)。图4显示了其表达水平。时间相关的ROC曲线表明,该预后模型在TCGA数据集上具有很强的预测能力(见图5A)。在训练集中,1年的AUC为0.739,3年为0.701,5年为0.731(见图5A)。根据Kaplan-Meier生存分析,高、低RS组相比,高RS组显示出较差的总体生存率(见图5B)。
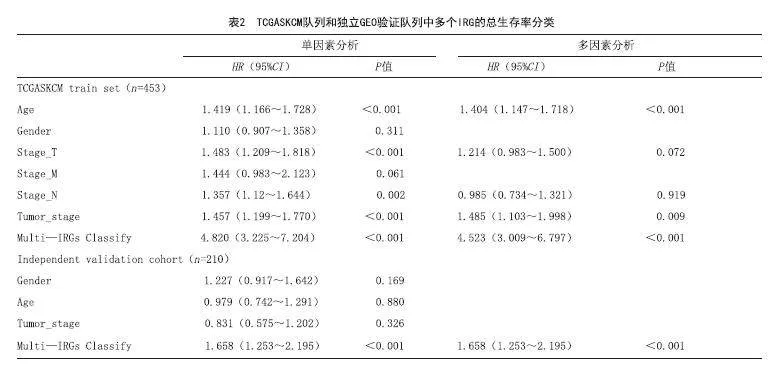
2.3 GEO队列作为测试集对预后风险模型进行验证:本研究使用GEO数据库中的GSE队列来验证预后模型的预测能力。时间相关的ROC曲线显示,预后模型具有良好的准确性,1年为0.690,3年为0.684,5年为0.604(见图5C)。Kaplan-Meier生存分析表明,高评分组的整体存活率很低(P<0.05),见图5D。此外,与其他临床特征相比,该风险模型具有更好的预测能力和准确性(见图5E~F)。此外,预后模型的RS是多因素Cox分析中的一个独立预后因素,预后相关因素和总生存期的单因素和多因素分析结果见表2。
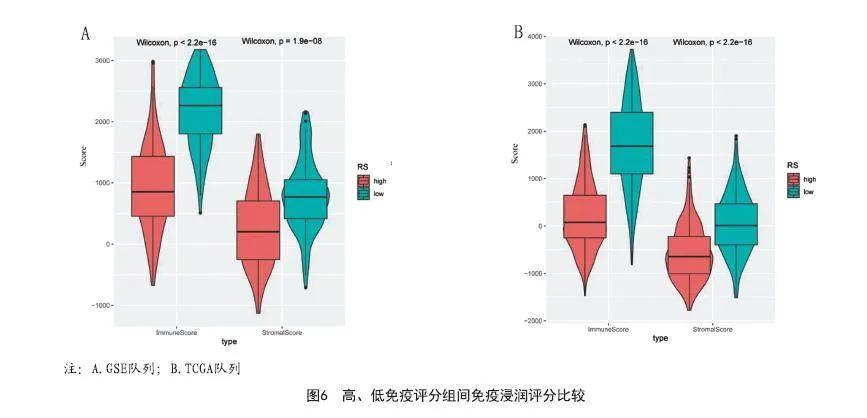
2.4 高、低免疫评分组间免疫浸润评分:免疫评分、基质评分显示高和低风险评分组之间有显著差异,无论是训练集还是测试集低风险评分组的免疫评分和基质评分都高于高风险评分组(见图6)。
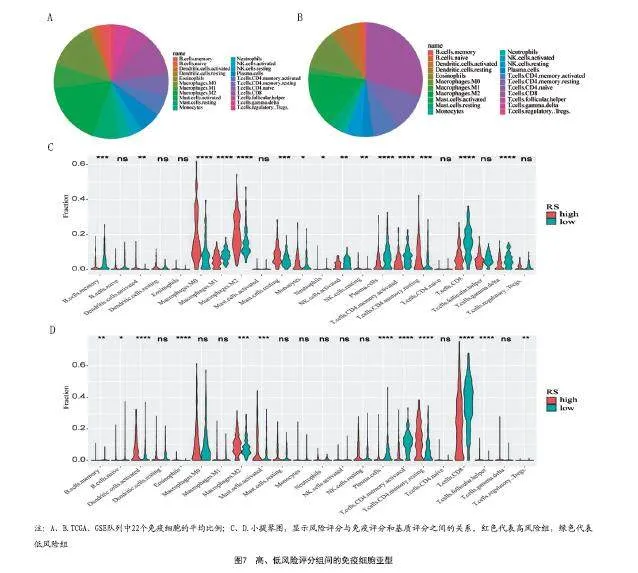
2.5 高、低风险评分组间的免疫细胞亚型:黑素瘤的22种免疫细胞比例结果显示,M0巨噬细胞、M2巨噬细胞和CD8+T细胞占黑素瘤免疫细胞浸润的很大比例。高和低RS组显示不同的免疫细胞表达(见图7)。
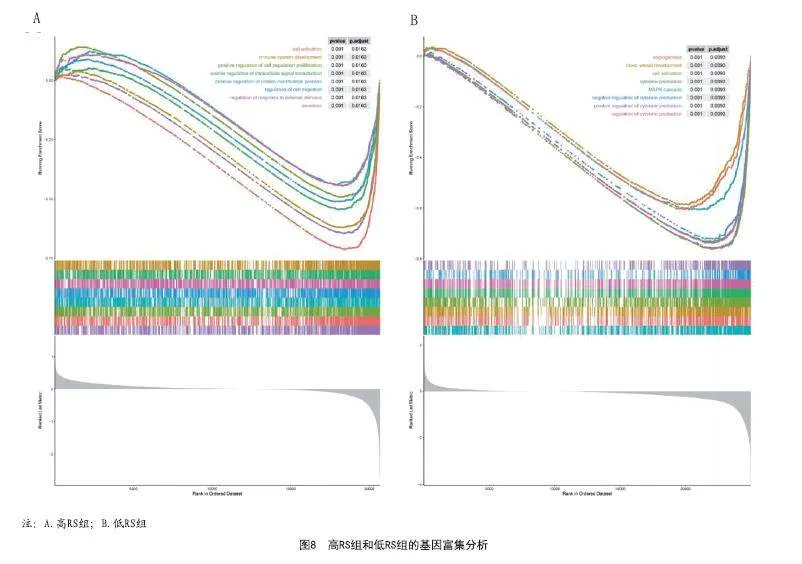
2.6 GSEA分析:GSEA分析显示了15种与风险评分相关的显著KEGG通路,包括MAPK信号通路、血管生成、血管发育、细胞活化、细胞因子产生及活化调节、免疫系统发育、细胞增殖的正调控、细胞内信号转导的正调节、蛋白质修饰过程的正向调节、细胞迁移的调节。(见图8)。
3" 讨论
黑素瘤是一种致命的皮肤癌[7]。目前,免疫疗法是黑素瘤患者一种成功的治疗选择[8-10]。许多研究人员证明了免疫细胞对肿瘤细胞的作用[11]。黑素瘤组织中的免疫成分可用于评估患者的治疗效果和黑素瘤预后[12-13]。在本研究中,246个免疫相关基因与黑素瘤预后相关,其中5个显著基因被用来构建模型。该模型具有可靠的预测价值和准确性。此外,本研究还探讨了风险评分(RS)与黑素瘤预后之间的内在关系。研究结果表明,高RS组和低RS组的免疫细胞浸润和多种信号通路存在差异。
模型中使用了S100A14、PSME1、IFIH1、GBP2、KLRC1这5个与免疫相关的标志基因(IRGs)。在以前的研究中,这些IRG被报道与肿瘤预后相关。S100A14调节肿瘤免疫逃逸,促进肿瘤转移与肿瘤的预后息息相关[14-16]。PSME1免疫治疗肿瘤逃逸有关,GBP2的低表达与SKCM中免疫细胞浸润较少和预后不良相关,GBP2的高启动子甲基化是SKCM预后不良的有希望的生物标志物[17-18]。IFIH1基因突变体能以不同的方式作用于癌症免疫力,比如,携带能赋予1型糖尿病风险的IFIH1突变体的个体机体中更易于出现炎性肿瘤,但研究人员还看到了与克罗恩病相关突变体患者的效果恰恰相反,这就提示这类患者或许并不会受益[19]。目前IFIH1对于肿瘤关系还不清楚需要进一步研究。有研究表明KLRC1受体在细胞毒性淋巴细胞上表达,包括NK细胞和活化的CD8+T细胞亚群。阻断KLRC1抗体释放了这些效应细胞的反应性,从而控制了肿瘤[20-22]。
有研究表明,免疫细胞成分比例失衡与癌症患者预后不良和存活率低高度相关[23-24]。为了进一步探索免疫和风险评分的关系,本研究使用CIBERSORT算法计算免疫细胞亚型。结果表明,两个风险评分组表达不同的免疫细胞亚型。先前的一项研究报告称,CD8+T细胞产生粒细胞和穿孔素来杀死肿瘤细胞。在本研究中,发现的免疫细胞主要包括M0巨噬细胞、M2巨噬细胞和CD8+T细胞。在这项研究中,高风险组的CD8+T水平较低,而M0和M2巨噬细胞水平较高。这寓意着CD8+T细胞和M0、M2巨噬细胞比例失衡可能会降低高危组患者的生存率。CD8+T细胞的高表达可以改善黑素瘤患者的预后,减少危险因素。
GSEA分析显示了高和低RS组之间15条重要信号通路的差异。MAPK信号通路的抑制剂通过增强黑素瘤抗原表达和下调免疫抑制细胞因子来改善黑素瘤免疫微环境。此外,趋化因子信号通路参与肿瘤生长。
在本研究中,LASSO回归分析被用来建立一个新的预后模型,并使用独立队列验证了该模型[25]。目前,很少有研究使用ESTIMATE和CIBERSORT算法来探索黑素瘤的免疫浸润。这些初步结果为探讨免疫浸润在黑素瘤中的作用提供了一个视角。然而,本研究有以下局限性。首先,由于缺乏体内外实验,分子机制分析结果的可靠性有限;第二,这项研究是一项回顾性研究,因此,应进行前瞻性研究,以验证本次研究结果。
综上所述,本研究成功地构建了一个黑素瘤预后模型,其具有强大的预测功能。高、低风险组总生存率的差异与免疫浸润、肿瘤微环境和多种信号通路的相互作用密切相关,为黑素瘤发病机制和临床治疗的分析提供了潜在指导作用。
[参考文献]
[1]Rastrelli M, Tropea S, Rossi C R, et al. Melanoma: epidemiology, risk factors, pathogenesis, diagnosis and classification[J]. In Vivo, 2014,28(6):1005-1011.
[2]Wei D. A multigene support vector machine predictor for metastasis of cutaneous melanoma[J]. Mol Med Rep, 2018,17(2):2907-2914.
[3]Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021,71(3):209-249.
[4]Bertero L, Massa F, Metovic J, et al. Eighth edition of the UICC classification of malignant tumours: an overview of the changes in the pathological tnm classification criteria-what has changed and why?[J]. Virchows Arch, 2018,472(4):519-531.
[5]Perakis S O, Thomas J E, Pichler M. Non-coding RNAs enabling prognostic stratification and prediction of therapeutic response in colorectal cancer patients[J]. Adv Exp Med Biol, 2016,937:183-204.
[6]Angell H, Galon J. From the immune contexture to the Immunoscore: the role of prognostic and predictive immune markers in cancer[J]. Curr Opin Immunol, 2013,25(2):261-267.
[7]董小龙,马勇光,杨欣.皮肤恶性黑素瘤诊断及外科治疗策略[J].中国美容医学,2016,25(6):108-112.
[8]Valpione S, Campana L G. Immunotherapy for advanced melanoma: future directions[J]. Immunotherapy, 2016,8(2):199-209.
[9]高正君,谢沛霖,司小强,等.不同来源黑素瘤BRAF V600E基因突变分析[J].中国美容医学,2018,27(1):74-76.
[10]刘洋,刘林嶓.抗原负载的DC-CIK联合化疗治疗晚期恶性黑素瘤的临床研究[J].中国美容医学,2015,24(2):25-30.
[11]Fischer G M, Vashisht Gopal Y N, McQuade J L, et al. Metabolic strategies of melanoma cells: Mechanisms, interactions with the tumor microenvironment, and therapeutic implications[J]. Pigment Cell Melanoma Res, 2018,31(1):11-30.
[12]Ladányi A. Prognostic and predictive significance of immune cells infiltrating cutaneous melanoma[J]. Pigment Cell Melanoma Res, 2015,28(5):490-500.
[13]张学军,亓发芝.内质网应激蛋白ATF4调控STAT3信号通路促进黑素瘤细胞生长及转移的研究[J].中国美容医学,2018,27(7):83-86.
[14]Li X, Ding F, Wang L, et al. Disruption of enhancer-driven S100A14 expression promotes esophageal carcinogenesis[J]. Cancer Lett, 2022,545:215833.
[15]Li X, Wang M, Gong T, et al. A S100A14-CCL2/CXCL5 signaling axis drives breast cancer metastasis[J]. Theranostics, 2020,10(13):5687-5703.
[16]Xiao M, Liang X, Yan Z, et al. A DNA-methylation-driven genes based prognostic signature reveals immune microenvironment in pancreatic cancer[J]. Front Immunol, 2022,13:803962.
[17]Zhang S, Chen K, Zhao Z, et al. Lower expression of GBP2 associated with less immune cell infiltration and poor prognosis in skin cutaneous melanoma (SKCM)[J]. J Immunother, 2022,45(6):274-283.
[18]Ji G, Luo B, Chen L, et al. GBP2 is a favorable prognostic marker of skin cutaneous melanoma and affects its progression via the Wnt/β-catenin pathway[J]. Ann Clin Lab Sci, 2021,51(6):772-782.
[19]Sayaman R W, Saad M, Thorsson V, et al. Germline genetic contribution to the immune landscape of cancer[J]. Immunity, 2021,54(2):367-386.e8.
[20]Parrot T, Oger R, Allard M, et al. Transcriptomic features of tumour-infiltrating CD4(low)CD8(high) double positive αβ T cells in melanoma[J]. Sci Rep, 2020,10(1):5900.
[21]Saputro R D, Rinonce H T, Iramawasita Y, et al. Potential prognostic value of PD-L1 and NKG2A expression in Indonesian patients with skin nodular melanoma[J]. BMC Res Notes, 2021,14(1):206.
[22]van Hall T, André P, Horowitz A, et al. Monalizumab: inhibiting the novel immune checkpoint NKG2A[J]. J Immunother Cancer, 2019,7(1):263.
[23]Ali H R, Chlon L, Pharoah P D, et al. Patterns of immune infiltration in breast cancer and their clinical implications: a gene-expression-based retrospective study[J]. PLoS Med, 2016,13(12):e1002194.
[24]Bense R D, Sotiriou C, Piccart-Gebhart M J, et al. Relevance of tumor-infiltrating immune cell composition and functionality for disease outcome in breast cancer[J]. J Natl Cancer Inst, 2017,109(1):djw192.
[25]沈剑,廖海英,黄谦.基于生物信息学构建GOPC的皮肤黑素瘤预后模型[J].中国美容医学,2023,32(3):70-74.
[收稿日期]2023-03-23
本文引用格式:凌晨,宋攀,叶金茂,等.基于WGCNA构建的免疫相关基因模型对皮肤黑素瘤及免疫微环境的影响[J].中国美容医学,2024,34(2):7-14.
