四物汤含药血清对多囊卵巢综合征卵巢颗粒细胞自噬的影响
2025-02-11邵艳社许雪梅杨宝芹李会娟姬霞

中图分类号 R965 文献标志码 A 文章编号 1001-0408(2025)02-0185-06
DOI 10.6039/j.issn.1001-0408.2025.02.09
摘要 目的 探讨四物汤含药血清对多囊卵巢综合征(PCOS)卵巢颗粒细胞自噬的影响及潜在机制。方法 取3 月龄雌性SD大鼠,分别以生理盐水和不同剂量四物汤灌胃,制备空白血清和不同浓度[0.52、1.04、2.08 g/(kg·d)]四物汤含药血清。筛选四物汤含药血清干预浓度后,将人卵巢颗粒细胞KGN分为对照组(细胞不进行任何处理)、脱氢表雄酮(DHEA)组(以50 μmol/L 的DHEA处理细胞48 h)、空白血清组(以50 μmol/L 的DHEA处理细胞48 h 后,再用10% 空白血清处理72 h)、中浓度四物汤含药血清组(以50 μmol/L 的DHEA处理细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h),观察各组细胞中的自噬体数量以及通路相关蛋白[果糖-1,6-二磷酸酶1(FBP1)、哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)]、自噬相关蛋白[p62、微管相关蛋白1 轻链3(LC3)]和FBP1 mRNA的表达水平。将(转染)细胞分为四物汤组(以50 μmol/L 的DHEA处理细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h)、四物汤+si-NC组(以50 μmol/L 的DHEA处理阴性对照小干扰RNA转染细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h)、四物汤+si-FBP1 组(以50 μmol/L 的DHEA处理FBP1 小干扰RNA转染细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h),考察敲低FBP1 对四物汤上述作用的影响。结果 与对照组比较,DHEA组细胞的自噬体数量明显增加,LC3-Ⅱ/LC3-Ⅰ、p-mTOR/mTOR、FBP1 蛋白及mRNA的表达水平均显著升高,p62 蛋白的表达水平显著降低(P<0.05)。与DHEA组和空白血清组比较,中浓度四物汤含药血清组细胞的自噬体数量明显减少,LC3-Ⅱ/LC3-Ⅰ显著降低,p-mTOR/mTOR和p62 蛋白、FBP1 蛋白及mRNA的表达水平均显著升高(P<0.05)。敲低FBP1 后,与四物汤+si-NC组比较,四物汤+si-FBP1 组细胞的存活率、p62 蛋白的表达水平、FBP1 蛋白及mRNA 的表达水平、p-mTOR/mTOR 均显著降低,LC3-Ⅱ/LC3-Ⅰ显著升高(P<0.05)。结论 四物汤可通过上调KGN细胞中FBP1 蛋白及mRNA的表达来促进mTOR蛋白的磷酸化,从而抑制其自噬。
关键词 四物汤;含药血清;多囊卵巢综合征;卵巢颗粒细胞;FBP1/mTOR信号通路
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄期女性最常见的生殖内分泌疾病之一,是导致女性无排卵性不孕的最常见原因,以高胰岛素血症、高雄激素血症、卵巢多囊样改变、月经不调等为主要症状[1]。PCOS是高血压、2 型糖尿病、妊娠期糖尿病、心血管疾病及子宫内膜癌等疾病的重要危险因素[2]。研究指出,卵泡发育异常是PCOS的主要特征,而卵泡内卵巢颗粒细胞的增殖、分化及自噬在卵泡生长发育过程中发挥着十分重要的作用[3]。其中,卵巢颗粒细胞在卵泡发育不同阶段出现的过度自噬均会导致卵母细胞质量下降,从而导致排卵障碍和性激素合成失调,最终诱发PCOS[4]。
四物汤始载于《仙授理伤续断秘方》,以熟地黄、当归、川芎、白芍4 味药材熬制而成,是中医补血、养血的经典方。四物汤作为“妇科第一方”,可刺激卵泡发育、减少卵泡闭锁,在治疗PCOS方面独具优势[5],但其作用机制尚不明确。本课题组前期网络药理学初筛发现,FBP1 是四物汤的潜在靶基因;同时,全基因组关联分析发现,FBP1 是PCOS 易感基因之一[6]。Liu 等[7]研究表明,果糖-1,6-二磷酸酶1(fructose-1,6-bisphosphatase 1,FBP1)在以高雄激素培养的小鼠卵巢颗粒细胞中表达异常,提示FBP1 蛋白可能参与了PCOS的发生发展过程。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型的丝氨酸/苏氨酸蛋白激酶,是参与自噬负向调控的主要因子[8]。mTOR可通过影响细胞自噬、氧化应激、炎症反应、线粒体功能、葡萄糖摄取等途径来影响卵泡的发育和成熟,进而调控PCOS 进程[9]。研究发现,FBP1 可通过调控mTOR而抑制前列腺癌细胞自噬[10]。基于此,本研究从FBP1/mTOR 信号通路出发,初步探讨四物汤含药血清对卵巢颗粒细胞自噬的影响,以期为阐明该方治疗PCOS的机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括JY300HC型通用型电泳仪(北京君意华鑫科技有限公司)、MK3 型酶标仪和LSC0150型CO2细胞培养箱(美国Thermo Fisher Scientific公司)、FluorChem FC3 型化学发光凝胶成像系统(美国ProteinSimple 公司)、MyGo Pro 型实时荧光定量聚合酶链式反应(PCR)仪(英国IT-IS 公司)、Axio Observer 3 型倒置荧光显微镜(德国Zeiss公司)等。
1.2 主要药品与试剂
熟地黄、当归、白芍、川芎配方颗粒[批号分别为2105012W、2201005C、2104012W、2109027C,规格分别为每袋装3 g(相当于饮片10 g)、2 g(相当于饮片3 g)、1g(相当于饮片10 g)、1 g(相当于饮片3 g)],均购自河南省中医院/河南中医药大学第二附属医院;胎牛血清和DMEM/F12 培养基( 批号分别为SH30070.01、SH30023.02)均购自美国Hyclone 公司;脱氢表雄酮(dehydroepiandrosterone,DHEA;批号252805)购自美国Sigma 公司;兔微管相关蛋白1 轻链3(microtubuleassociatedprotein 1 light chain 3,LC3)、p62、FBP1、mTOR、磷酸化mTOR (phosphorylated mTOR,pmTOR)、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体和辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(批号分别为ab63817、ab109012、ab109732、ab134903、ab109268、ab8245、ab6721)均购自英国Abcam 公司;RIPA细胞裂解液和BCA蛋白定量试剂盒(批号分别为P0013J、P0010)均购自上海碧云天生物技术股份有限公司;绿色荧光蛋白(green fluorescent protein,GFP)-LC3质粒、FBP1 小干扰RNA及其阴性对照小干扰RNA(批号分别为91822、91889、91890)均购自上海吉玛制药技术有限公司;TurboFect 转染试剂和RNA反转录试剂盒(批号分别为R0531、K1691)均购自美国Thermo FisherScientific公司。
1.3 动物
3 月龄SPF 级雌性SD大鼠40 只,体重(290±50)g,用于含药血清的制备。大鼠由河南省实验动物中心提供,动物生产许可证号为SCXK(豫)2020-0001。所有动物均饲养于温度(23±1)˚C、相对湿度(50±5)%、每12 h明暗循环的环境下,自由摄食、饮水。本动物实验方案经河南省中医院/河南中医药大学第二附属医院实验动物福利伦理委员会批准(批准文号PZ-HNSZYY-2022-070)。
1.4 细胞
人卵巢颗粒细胞KGN(批号CL-0603)购自武汉普诺赛生命科技有限公司。
2 方法
2.1 四物汤颗粒药液制备
按相关文献[11]的组方配比制备四物汤颗粒药液:取熟地黄、当归、白芍、川芎配方颗粒,按饮片质量15∶10∶10∶6 混合,溶于生理盐水中,制成相应浓度的四物汤颗粒药液,备用。
2.2 空白血清和含药血清制备
所有雌性SD大鼠适应性喂养3 d 后,随机分为空白血清组和低、中、高剂量四物汤含药血清组,每组10 只。四物汤颗粒成人用量为5 g/d,按成人体重60 kg 换算得日剂量,为0.083 3 g/(kg·d);再进一步换算得大鼠给药低剂量,为0.52 g/(kg·d)[12]。空白血清组大鼠灌胃等体积生理盐水,低、中、高剂量四物汤含药血清组大鼠分别灌胃四物汤颗粒0.52、1.04、2.08 g/(kg·d),每天灌胃2次,持续3 d。末次灌胃后3 h,各组大鼠经腹腔麻醉并于腹主动脉取血;血样于4 ˚C下静置1 h,再以3 000 r/min离心10 min,收集上层血清,过滤;血清于56 ˚C 下灭活30 min,即得空白血清和低、中、高浓度四物汤含药血清,于-20 ˚C保存,备用。
2.3 药物干预浓度筛选
取KGN 细胞,接种于含10% 胎牛血清的DMEM/F12 培养基中,于37 ˚C、5%CO2条件下培养。待细胞生长至对数期后,以2×104个/孔接种于96 孔板中,并分为对照组(不进行任何处理)、DHEA 组(以50 μmol/L 的DHEA 处理48 h,以构建PCOS 细胞模型[13])、空白血清组(以50 μmol/L 的DHEA处理48 h 后,再用10% 空白血清处理72 h)和低、中、高浓度四物汤含药血清组(以50μmol/L 的DHEA 处理48 h 后,分别再用10% 低、中、高浓度四物汤含药血清处理72 h[14]),并设置不含细胞、不含药物的调零组,每组设置6 个复孔。每孔加入CCK-8溶液10 μL,反应2 h,使用酶标仪于450 nm波长下检测各孔的吸光度(A)值并按下式计算细胞存活率:细胞存活率(%)=(实验组A值-调零组A值)/(对照组A值-调零组A值)×100%。根据检测结果筛选后续实验含药血清的干预浓度。
2.4 细胞中自噬体数量检测
取KGN 细胞,按2×105个/孔接种于24 孔板中,于37 ˚C、5%CO2条件下孵育24 h,待细胞融合至70% 时进行GFP-LC3 质粒转染(将GFP-LC3 质粒0.5 μg 与无血清DMEM/F12 培养基100 μL 混合,随后加入TurboFect转染试剂2 μL混匀,转染48 h),若荧光显微镜下可见细胞发出明显的绿色荧光即为转染成功。取转染后的细胞,分为对照组、DHEA组、空白血清组、中浓度四物汤含药血清组(四物汤含药血清干预浓度根据“2.3”项下结果设置),各组细胞均按“2.3”项下方法处理,每组设置6个复孔。取各组细胞,用4% 多聚甲醛溶液于室温下固定20 min,再加入0.02%Triton X-100 试剂于室温下孵育5 min,用4′,6-二脒基-2-苯基吲哚(DAPI)染色后,使用荧光显微镜观察细胞中的自噬体(GFP-LC3 绿色荧光斑点)并记录其数量。
2.5 细胞中自噬相关蛋白、mTOR蛋白、FBP1 蛋白及mRNA表达检测
采用Western blot 法检测相关蛋白表达。取对数生长期的KGN 细胞,按5×105 个/孔接种于6 孔板中,按“2.4”项下方法分组、处理。收集各组细胞,加入RIPA裂解液提取总蛋白,以BCA法测定蛋白浓度后加热变性。取变性蛋白30 μg 进行聚丙烯酰胺凝胶电泳分离并转移到硝酸纤维素膜上,用5% 脱脂奶粉于室温下孵育2 h;洗膜后,加入自噬相关蛋白一抗(LC3、p62,稀释比例分别为1∶900、1∶800)、通路相关蛋白一抗(FBP1、mTOR、p-mTOR,稀释比例分别为1∶700、1∶700、1∶1 000)、内参蛋白一抗(GAPDH,稀释比例为1∶1 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶2 000),于37 ℃下孵育1 h;洗膜后,加入发光试剂,并置于化学发光凝胶成像分析系统下显影曝光。使用Image Lab 软件分析各蛋白条带灰度值,以目的蛋白与内参蛋白的条带灰度值比值表示目的蛋白的表达水平,再以LC3-Ⅱ与LC3-Ⅰ的表达水平比值(LC3-Ⅱ/LC3-Ⅰ)表示自噬活性,以p-mTOR 与mTOR 的表达水平比值(p-mTOR/mTOR)表示mTOR蛋白的磷酸化水平。结果以对照组为参照进行归一化处理。
采用实时荧光定量PCR法检测FBP1 mRNA表达。取对数生长期的KGN细胞,按5×105个/孔接种于6 孔板中,按“2.4”项下方法分组、处理。收集细胞,经Trizol试剂裂解后,提取总RNA,经纯度、含量检测后,将其反转录合成cDNA,再以此cDNA为模板,进行PCR扩增。PCR 反应体系包括cDNA 模板 1 μL,PCR 正/反向引物各0.5 μL,SYBR Premix Ex TaqⅡ(2×)10 μL,双蒸水 8μL,共20 μL。PCR 反应条件为95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火延伸30 s,共循环40 次。以GAPDH 为内参,用2-ΔΔCt法计算FBP1 mRNA的表达水平。PCR 引物由北京擎科生物科技有限公司设计、合成。FBP1 正向引物序列为5′-CTCTATGGCATTGCTGGTTCTA-3′,反向引物序列为5′-CGTGGCAAAGGATGACTTTAAC-3′,扩增产物长度为108 bp;GAPDH正向引物序列为5′-TACTAGCGGTTTTACGGGCG-3′,反向引物序列为5′-ATTGGGCTCTTCCACACAGG-3′,扩增产物长度为166 bp。结果以对照组为参照进行归一化处理。
2.6 敲低FBP1 对四物汤含药血清作用的影响检测
取KGN 细胞,按2×105个/孔接种于24 孔板中,于37 ˚C、5%CO2条件下培养24 h,待细胞融合至80% 时进行细胞转染[取阴性对照小干扰RNA 和FBP1 小干扰RNA各1 μg,分别与不含血清的DMEM/F12 培养基(含TurboFect 转染试剂2.5 μL)1 mL 混合,再与KGN 细胞共同孵育24 h,即得阴性对照小干扰RNA 转染细胞和FBP1 小干扰RNA 转染细胞,Western blot 检测示二者FBP1 蛋白表达水平分别较未转染细胞变化不大或显著降低,即为转染成功]。将KGN细胞和转染细胞分为四物汤组(以50 μmol/L 的DHEA处理KGN细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h)、四物汤+si-NC 组(以50 μmol/L 的DHEA 处理阴性对照小干扰RNA转染细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h)、四物汤+si-FBP1 组(以50 μmol/L 的DHEA 处理FBP1 小干扰RNA 转染细胞48 h 后,再用10% 中浓度四物汤含药血清处理72 h),每组设置6 个复孔。取各组细胞,按“2.3”项下方法检测其存活率,按“2.5”项下方法检测LC3-Ⅱ/LC3-Ⅰ、p-mTOR/mTOR 和p62蛋白、FBP1 蛋白及mRNA的表达水平。
2.7 统计学方法
采用SPSS 22.0 软件对数据进行统计分析。实验数据以x±s 表示,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni检测。检验水准α=0.05。
3 结果
3.1 四物汤含药血清干预浓度的筛选结果
与对照组(100%)比较,DHEA 组细胞的存活率[(35.4±3.6)%]显著降低(P<0.05)。与DHEA 组和空白血清组[(34.8±4.5)%]比较,低、中、高浓度四物汤含药血清组细胞的存活率[(52.5±6.7)%、(78.3±7.8)%、(81.6±6.9)%]均显著升高(P<0.05)。其中,中浓度四物汤含药血清组细胞的存活率与高浓度四物汤含药血清组比较差异无统计学意义(P>0.05),遂后续仅使用中浓度四物汤含药血清进行实验。
3.2 四物汤含药血清对KGN细胞自噬及相关蛋白表达的影响
与对照组比较,DHEA组细胞中自噬体数量明显增多,LC3-Ⅱ/LC3-Ⅰ显著升高,p62 蛋白的表达水平显著降低(P<0.05)。与DHEA 组和空白血清组比较,中浓度四物汤含药血清组细胞中自噬体数量明显减少,LC3-Ⅱ/LC3-Ⅰ显著降低,p62 蛋白的表达水平显著升高(P<0.05)。结果见图1、图2、表1。
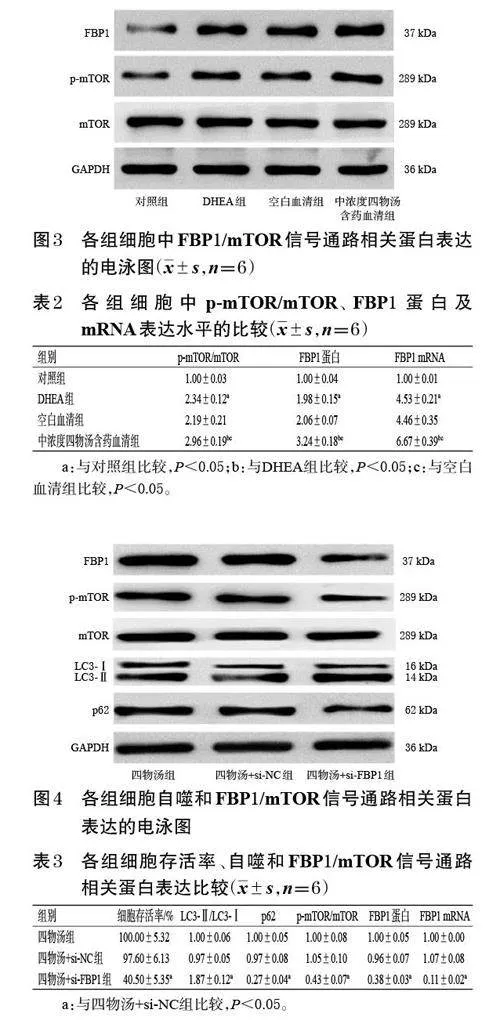
3.3 四物汤含药血清对KGN 细胞中通路相关蛋白、mRNA表达的影响
与对照组比较,DHEA 组细胞中p-mTOR/mTOR、FBP1 蛋白及mRNA的表达水平均显著升高(P<0.05)。与DHEA组和空白血清组比较,中浓度四物汤含药血清组细胞中p-mTOR/mTOR、FBP1 蛋白及mRNA的表达水平亦显著升高(P<0.05)。结果见图3、表2。
3.4 敲低FBP1 对四物汤含药血清相关作用的影响
与四物汤组比较,四物汤+si-NC组细胞的存活率、LC3-Ⅱ/LC3-Ⅰ、p-mTOR/mTOR、p62 蛋白、FBP1 蛋白及mRNA的表达差异均无统计学意义(P>0.05)。与四物汤+si-NC组比较,四物汤+si-FBP1 组细胞的存活率、p62蛋白的表达水平、FBP1 蛋白及mRNA 的表达水平、pmTOR/mTOR 均显著降低,LC3- Ⅱ/LC3- Ⅰ显著升高(P<0.05)。结果见图4、表3。
4 讨论
PCOS 患者的主要临床表现包括卵泡发育异常、排卵障碍及流产[1]。作为卵泡发育的标志,卵巢颗粒细胞的生长分化是原始卵泡启动和生长的关键,其能通过受体介导途径调控生长期卵泡的发育及卵泡闭锁,从而在卵泡发育过程中发挥重要的调控作用[15]。长期的临床应用表明,四物汤用于女性月经紊乱相关疾病的疗效确切[16]。现代中医学认为,PCOS属于“不孕”“闭经”范畴,主要病机为痰湿瘀血。该方中,君药熟地黄可补血滋阴,臣药当归可补血行血,佐药川芎可祛瘀止痛,佐药白芍可养血调经,契合PCOS上述病机。本研究使用不同剂量的四物汤灌胃大鼠,制备了3 种不同浓度的四物汤含药血清,CCK-8 实验结果显示,各浓度四物汤含药血清对KGN细胞的存活均有促进作用。
研究表明,PCOS模型动物/患者的卵巢颗粒细胞自噬会被异常激活[17]。过度自噬会引起细胞结构受损,影响卵细胞正常发育,从而导致排卵障碍和性激素合成失调[4]。因此,通过改变卵巢颗粒细胞的自噬水平有望成为PCOS治疗的有效途径之一。根据研究报道,四物汤活性成分豆甾醇、β-谷甾醇及山柰酚均可抑制细胞自噬[18―19],由此本课题组推测,该方可能具有调控卵巢颗粒细胞自噬水平的作用。本研究结果显示,四物汤含药血清可显著下调KGN 细胞中自噬体数量和LC3-Ⅱ/LC3-Ⅰ,上调p62 蛋白的表达,升高mTOR 蛋白的磷酸化水平,说明四物汤含药血清可抑制KGN细胞自噬。
学者发现,在高雄激素培养的小鼠卵巢颗粒细胞及源自PCOS患者的诱导性多能干细胞中,FBP1 蛋白的表达均明显升高[20―21]。本研究结果发现,经DHEA 处理后,KGN细胞中FBP1 蛋白及mRNA的表达水平均显著升高,与之前报道一致[7];经四物汤含药血清处理后,KGN细胞中FBP1 蛋白及mRNA的表达水平进一步升高;敲低FBP1 后,四物汤含药血清对KGN细胞存活率的促进作用和对自噬的抑制作用均被减弱,说明FBP1在PCOS进展过程中具有保护作用,高水平的FBP1 可抑制卵巢颗粒细胞的自噬。
综上所述,四物汤含药血清可通过上调KGN细胞中FBP1 蛋白及mRNA的表达来促进mTOR蛋白的磷酸化,从而抑制其自噬,这可能是四物汤改善PCOS的潜在作用机制。
参考文献
[ 1 ] WALKER K,DECHERNEY A H,SAUNDERS R. Menstrual
dysfunction in PCOS[J]. Clin Obstet Gynecol,2021,
64(1):119-125.
[ 2 ] XU Y L,QIAO J. Association of insulin resistance and elevated
androgen levels with polycystic ovarian syndrome
(PCOS):a review of literature[J]. J Healthc Eng,2022,
2022:9240569.
[ 3 ] ZHENG Y X,MA L Z,LIU N,et al. Autophagy and apoptosis
of porcine ovarian granulosa cells during follicular
development[J]. Animals(Basel),2019,9(12):1111.
[ 4 ] SAMARE-NAJAF M,NEISY A,SAMAREH A,et al.
The constructive and destructive impact of autophagy on
both genders’ reproducibility,a comprehensive review[J].
Autophagy,2023,19(12):3033-3061.
[ 5 ] ZHOU F R,SONG Y F,LIU X,et al. Si-wu-tang facilitates
ovarian function through improving ovarian microenvironment
and angiogenesis in a mouse model of premature
ovarian failure[J]. J Ethnopharmacol,2021,280:
114431.
[ 6 ] ZHAO S G,TIAN Y,GAO X,et al. Family-based analysis
of eight susceptibility loci in polycystic ovary syndrome[
J]. Sci Rep,2015,5:12619.
[ 7 ] LIU T,ZHAO H,WANG J F,et al. The role of fructose-1,
6-bisphosphatase 1 in abnormal development of ovarian
follicles caused by high testosterone concentration[J]. Mol
Med Rep,2017,16(5):6489-6498.
[ 8 ] XU Z R,HAN X,OU D M,et al. Targeting PI3K/AKT/
mTOR-mediated autophagy for tumor therapy[J]. Appl
Microbiol Biotechnol,2020,104(2):575-587.
[ 9 ] 马桦,齐大河,陈雯玥,等. AMPK及mTOR与多囊卵巢
综合征的关系及中药干预研究进展[J]. 中华中医药学
刊,2024,42(2):164-170.
MA H,QI D H,CHEN W Y,et al. Chinese medicine regulates
AMPK or mTOR to treat polycystic ovary syndrome:
a review[J]. Chin Arch Tradit Chin Med,2024,42(2):
164-170.
[10] LI X R,ZHOU K Q,YIN Z,et al. Knockdown of FBP1
enhances radiosensitivity in prostate cancer cells by activating
autophagy[J]. Neoplasma,2020,67(5):982-991.
[11] 徐王彦君. 基于UPLC-QTOF MS技术的四物汤灌胃大
鼠代谢组学初步研究[D]. 合肥:安徽医科大学,2015.
XU W Y J. Preliminary study on metabonomics in rats
after oral administration of Si-wu-tang based on UPLCQTOF
MS[D]. Hefei:Anhui Medical University,2015.
[12] 陈梦,石丹宁,张则业,等. 四物汤在大鼠脑和骨骼肌组
织中发挥雌激素样效应的机制研究[J]. 中国医药,2021,
16(10):1580-1584.
CHEN M,SHI D N,ZHANG Z Y,et al. Study on mechanism
of Siwu decoction exerting estrogenic effects on rats
brain and skeletal muscle tissues[J]. China Med,2021,16
(10):1580-1584.
[13] 谢芬芬. 褪黑素对青春期DHEA暴露致PCOS的保护机
制研究[D]. 合肥:安徽医科大学,2020.
XIE F F. Protective mechanism of melatonin on PCOS induced
by DHEA exposure in adolescence[D]. Hefei:
Anhui Medical University,2020.
[14] 林陶秀,张文娟,张悦健,等. 最佳中药含药血清浓度的
筛选方法研究现状[J]. 中国实验方剂学杂志,2023,29
(2):195-202.
LIN T X,ZHANG W J,ZHANG Y J,et al. Screening
methods for optimal serum concentration of Chinese medicine:
a review[J]. Chin J Exp Tradit Med Formulae,2023,
29(2):195-202.
[15] ZHANG T J,BASANG W D,CHANG W H,et al. Dynamics
of apoptosis-related gene expression during follicular
development in yak[J]. J Anim Physiol Anim Nutr
(Berl),2021,105(6):1002-1013.
[16] HUANG G C,TSAI Y Z,LEE C J,et al. Elucidation of
the effects of Si-wu tang on menstrual disorder patterns
through activation of aromatase and antioxidation[J]. Evid
Based Complement Alternat Med,2019,2019:4761651.
[17] KUMARIYA S,UBBA V,JHA R K,et al. Autophagy in
ovary and polycystic ovary syndrome:role,dispute and future
perspective[J]. Autophagy,2021,17(10):2706-2733.
[18] ZHAO H G,ZHANG X,WANG M,et al. Stigmasterol simultaneously
induces apoptosis and protective autophagy
by inhibiting Akt/mTOR pathway in gastric cancer cells
[J]. Front Oncol,2021,11:629008.
[19] KIM M J,SONG Y R,KIM Y E,et al. Kaempferol stimulation
of autophagy regulates the ferroptosis under the oxidative
stress as mediated with AMP-activated protein kinase[
J]. Free Radic Biol Med,2023,208:630-642.
[20] LI D,YOU Y,BI F F,et al. Autophagy is activated in the
ovarian tissue of polycystic ovary syndrome[J]. Reproduction,
2018,155(1):85-92.
[21] MIN Z Y,GAO Q,ZHEN X M,et al. New insights into
the genic and metabolic characteristics of induced pluripotent
stem cells from polycystic ovary syndrome women[J].
Stem Cell Res Ther,2018,9(1):210.
(收稿日期:2024-07-23 修回日期:2024-12-25)
(编辑:邹丽娟)
