加味芍药甘草汤对慢传输型便秘大鼠肠道传输功能、肠道菌群及代谢产物含量的影响
2025-02-11张紫麒周鸿雲赵琼邓媛占煜

中图分类号 R965 文献标志码 A 文章编号 1001-0408(2025)02-0154-06
DOI 10.6039/j.issn.1001-0408.2025.02.04
摘要 目的 观察加味芍药甘草汤对慢传输型便秘(STC)大鼠肠道传输功能、肠道菌群及共代谢产物γ氨基丁酸(GABA)和5-羟色胺(5-HT)含量的影响。方法 将SD大鼠随机分为空白组(10只)和造模组(30只),雌雄各半。造模组大鼠以复方地芬诺酯灌胃法构建STC模型。将造模成功的大鼠随机分为模型组、加味芍药甘草汤组[56 g/(kg·d),以生药量计]、阳性对照药组[乳果糖2.09g/(kg·d)],每组10 只。各药物组大鼠灌胃相应药液,空白组和模型组大鼠灌胃等体积生理盐水,每天1 次,连续14 d。实验期间,观察各组大鼠的一般情况;末次给药后,称定其体重并对粪便性状进行Bristol 评分,检测粪便含水率、肠道推进率和肠内容物中GABA、5-HT含量,考察肠内容物中肠道菌群的多样性,并分析GABA、5-HT含量与菌群相对丰度的关联性。结果 与模型组比较,加味芍药甘草汤组大鼠体形瘦小、皮毛稀疏粗糙、行动迟缓等一般情况均有所改善,体重、Bristol 评分、粪便含水率、肠道推进率、5-HT含量、Chao1 和Shannon 指数均显著升高,GABA含量、Simpson 指数均显著降低(P<0.05)。该组大鼠的肠道菌群可与空白组归为一类,但与模型组相距较远;该组脱硫杆菌门、厚壁菌门、拟杆菌门的相对丰度虽有回调,但与模型组比较差异均无统计学意义(P>0.05);脱硫杆菌门是组间差异因素(P<0.05)。GABA含量与拟杆菌门、蓝菌门、髌骨菌门、放线菌门的相对丰度呈负相关(P<0.01 或P<0.05),5-HT含量与弯曲杆菌门的相对丰度呈正相关(P<0.05)。结论 加味芍药甘草汤可改善STC模型大鼠粪便性状和肠道动力,上述作用可能与改善肠道菌群,进而影响肠内容物中GABA、5-HT含量有关;此外,GABA、5-HT含量可能与拟杆菌门、弯曲杆菌门等特定菌门的相对丰度显著相关。
关键词 加味芍药甘草汤;慢传输型便秘;肠道菌群;γ氨基丁酸;5-羟色胺
功能性便秘是临床多发病之一,根据病理生理改变分为正常传输型、慢传输型、排便障碍型和混合型。其中,慢传输型便秘(slow transit constipation,STC)是一类以结肠传输减慢为特点的顽固性便秘,约占功能性便秘的45.5%,是功能性便秘的常见类型[1―2]。目前,STC 发病机制尚不明确,学界普遍认为与肠动力障碍、肠道菌群失调、肠神经系统和中枢神经系统异常、神经递质改变等密切相关[3]。研究表明,STC 的发生与肠道菌群及其与宿主的共代谢产物[如γ氨基丁酸(γ aminobutyricacid,GABA)、5-羟色胺(5-hydroxytryptamine,5-HT)等]有关[4]。同时,有研究显示,STC患者存在明显的肠道菌群失调,其体内有害菌种(如大肠埃希菌等)明显增多,肠道益生菌(如双歧杆菌等)大幅减少[5―6]。多项研究报道指出,双歧杆菌属和乳酸杆菌属成员均能通过生成GABA来影响肠道5-HT 的含量,进而改善STC 患者的肠道动力[7―9]。
加味芍药甘草汤由白芍、麦冬、玄参、火麻仁、枳实、厚朴、太子参、生白术、甘草组成,是成都中医药大学赵琼教授根据酸甘化阴名方“芍药甘草汤”并结合长期临床实践化裁而来,具酸甘化阴、养阴增液、益气通便之功效。本课题组前期研究证实了加味芍药甘草汤改善小儿便秘的疗效,并对其理法方药及主要成分的通便活性进行了初步探索[10]。近期药理学研究报道,加味芍药甘草汤活性成分可提高便秘模型动物的结肠推进率、粪便含水率及排便量,并可改善其便秘症状,上述作用可能是通过正向调节肠道菌群的方式来实现的[11―12]。基于此,本研究拟采用复方地芬诺酯灌胃构建STC大鼠模型,从肠道菌群及产物(GABA、5-HT)含量角度出发,进一步探讨加味芍药甘草汤改善STC的潜在机制,以期为STC的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括QuantiFluorTM ST 型蓝色荧光定量系统(美国Promega 公司),A200 型聚合酶链式反应(PCR)仪(杭州朗基科学仪器有限公司),REPS300型电泳仪(上海天能科技有限公司),1290 Infinity Ⅱ型超高效液相色谱仪、6495 LC/TQ 型三重四极杆质谱仪(美国Agilent公司)等。
1.2 药品与试剂
白芍、麦冬、玄参、火麻仁、枳实、厚朴、太子参、生白术、甘草饮片(批号分别为D2209079、2210048、2206147、2206142、2207091、2210036、2111091、D2207058、2206076)均购自四川新荷花中药饮片股份有限公司,经成都中医药大学中药学教研室黄勤挽副教授鉴定均为真品。
乳果糖口服溶液(批号366197,规格15 mL∶10 g)由Fresenius Kabi Austria GmbH生产;复方地芬诺酯片(批号220501,每片含盐酸地诺酚酯2.5 mg、硫酸阿托品25μg)由广西河丰药业有限责任公司生产;活性炭、阿拉伯树胶(批号分别为C14358027、C14362403)均购自上海麦克林生化科技股份有限公司;AxyPrep DNA凝胶回收试剂盒购自美国Axygen Biosciences 公司;SMRTbellTMTemplate 制备试剂盒购自美国Pacific Biosciences 公司;GABA、5-HT对照品(批号分别为1ST7512、1ST157682,纯度分别为99.6%、99.9%)均购自天津阿尔塔科技有限公司;甲醇、乙腈、甲酸为色谱纯,其余试剂为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
SPF级健康SD大鼠40 只,雌雄各半,4 周龄,购自斯贝福(北京)生物技术有限公司,实验动物许可证号为SCXK(京)2019-0010。所有实验动物均饲养于成都中医药大学温江校区药理学实验室动物饲养中心[相对湿度(55±10)%,温度(25±2)℃,每12 h 明暗交替,定时通风换气],以普通饲料喂养并自由饮水。所有实验程序均经过四川省实验动物学会福利伦理委员会批准(批准文号P202303201)。
2 方法
2.1 药液和墨汁的制备
2.1.1 加味芍药甘草汤
称取饮片白芍15 g、麦冬10 g、玄参10 g、火麻仁10g、枳实8 g、厚朴8 g、太子参8 g、生白术8 g、甘草5 g(共82 g),混合,以10 倍量水浸泡30 min 后,武火煮沸,转文火煎煮30 min,过滤;取药渣,同法再煎煮1 次。合并2次水煎液,过滤,浓缩,得质量浓度为5.6 g/mL(以生药量计)的加味芍药甘草汤煎液。
2.1.2 阳性对照药
取乳果糖口服溶液适量,用生理盐水制成质量浓度为208.44 mg/mL的溶液,即配即用。
2.1.3 复方地芬诺酯
将复方地芬诺酯片研磨为细粉,用生理盐水配制成质量浓度为1.5 mg/mL的混悬液,即配即用。
2.1.4 墨汁
取阿拉伯胶50 g,加水400 mL,混合,煮沸至澄清透明,再加活性炭25 g,混匀并煮沸3 次,冷却,用水定容至500 mL,于4 ℃下保存,使用前搅拌均匀。
2.2 分组、造模与给药
大鼠适应性饲养3 d 后,按随机数字表法分为空白组(10 只)和造模组(30 只),雌雄各半。造模组大鼠参考相关文献[2,13―14],采用复方地芬诺酯[15 mg/(kg·d),每天1 次,连续14 d]灌胃的方式构建STC 模型;空白组大鼠灌胃等体积生理盐水。造模后,若大鼠出现体形干瘪瘦小、毛发竖立、拱背、活动减少、粪便质量减轻及颗粒变细等症状,大便Bristol 评分较空白组显著降低,且首粒黑便排出时间(造模结束后立即禁食24 h,经口灌入墨汁10 mL/kg。从灌胃完毕开始计时,记录首粒黑便排出时间)较空白组显著延长,则视为STC模型复制成功。
造模期间大鼠无死亡,全部存活。将造模成功的大鼠随机分为模型组(10 只),加味芍药甘草汤组(10 只),阳性对照药组(10 只),雌雄各半。本课题组前期临床研究表明,加味芍药甘草汤常规剂量治疗STC 的疗效显著,故参考此剂量,予加味芍药甘草汤组大鼠相应药液56 g/(kg·d)(以生药量计);同法予阳性对照药组大鼠相应药液2.09 g/(kg·d),空白组和模型组大鼠灌胃等体积生理盐水;每天1 次,连续14 d。
2.3 大鼠一般情况观察及体重、Bristol 评分、粪便含水率检测
2.3.1 一般情况观察
实验期间,观察各组大鼠的精神、活动、毛发、摄食、饮水等一般情况。
2.3.2 体重、Bristol评分、粪便含水率检测
(1)体重:观察各组大鼠实验期间的体重变化情况,并记录末次给药后各组大鼠的体重。
(2)粪便Bristol 评分:末次给药后,将大鼠单笼饲养,收集其24 h 粪便,并按Bristol 评分标准评估其粪便性状,具体标准如下:粪便存在分散的硬块,似坚果,记1分;粪便呈腊肠状,且成块,记2 分;粪便呈腊肠状,但表面有裂缝,记3 分;粪便似腊肠或蛇状,光滑柔软,记4分;粪便为软团,边缘清楚,记5 分;粪便似糊状、绒状物,边缘不清,记6 分;粪便为水样,无固状物,记7 分[13]。
(3)粪便含水率:取各组大鼠上述24 h 粪便,称定粪便湿重;于60 ℃下恒温烘干12 h 后,称定其干重,按下式计算粪便含水率:粪便含水率=(粪便湿重-粪便干重)/粪便湿重×100%[13]。
2.4 大鼠肠道推进功能检测
采用墨汁灌胃法检测。结束上述指标检测后,随机选取每组4 只大鼠,禁食、不禁水24 h,以墨汁10 mL/kg灌胃,30 min 后以戊巴比妥钠30 mg/kg 腹腔注射麻醉,再以颈椎脱臼法处死,随后立即剖开腹部,快速取出其肠道,在无张力的状态下测量大鼠的肠道全长及墨汁在肠道内的推进长度,按下式计算肠道推进率:肠道推进率=墨染肠管长度/肠道全长×100%[13]。
2.5 大鼠肠内容物中GABA、5-HT含量的检测
取每组剩余6 只大鼠,按“2.4”项下方法麻醉、处死、解剖,快速取出其肠内容物,采用液相色谱-串联质谱法检测其中GABA、5-HT含量。
(1)色谱与质谱条件:色谱柱为Agilent Eclipse PlusC18(3.0 mm×150 mm,1.8 μm),以0.6% 甲酸溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~0.3 min,98%A;0.3~5 min,98%A→90%A;5~10 min,90%A→10%A;10~14.5 min,10%A→98%A),柱温为35 ℃,进样量为5 μL。采用电喷雾离子源以多反应监测模式进行正离子扫描,用于定量分析的离子对分别为m/z 104.1→87.1(GABA)、m/z 177.4→160.0(5-HT)。
(2)样品检测:精密称取各组大鼠的肠内容物50mg,置于2 mL EP 管中,加入-20 ℃预冷的80% 乙腈400 μL 沉淀蛋白,涡旋提取20 min,于4 ℃下以12 000r/min 离心10 min;取上清液,以氮气流吹干,残渣以初始流动相100 μL 复溶,于4 ℃下以12 000 r/min 离心10min;取上清液,按上述色谱与质谱条件进样测定,记录峰面积,以外标法计算肠内容物中GABA、5-HT 含量。方法学考察结果显示,GABA、5-HT检测质量浓度的线性范围分别为1.00~50.0、2.00~100 ng/mL(r>0.999);精密度、重复性等结果均符合2020 年版《中国药典》(四部)的相关要求。
2.6 大鼠肠道菌群检测
采用第三代16S rRNA 高通量测序技术检测。取“2.5”项下各组大鼠的肠内容物样本适量,使用相应试剂盒对样本进行基因提取和定量后,使用特定引物(515 正向引物为5′-AGRGTTYGATYMTGGCTCAG-3′,806 反向引物为5′-RGYTACCTTGTTACGACTT-3′,由杭州联川生物技术股份有限公司设计、合成)扩增16S rRNA的V1~V9 区域。所得产物经回收、纯化后,使用蓝色荧光定量系统定量;以SMRTbellTM Template 制备试剂盒构建测序文库,并进行测序分析。采用DADA 2 软件对测序数据进行去噪处理,得到扩增子序列变体(amplicon sequencevariants,ASV)特征序列和丰度表格,使用SILVA数据库(https://www.arb-silva.de)进行分类学注释,通过Chao1、Goods_coverage、Shannon、Simpson 指数( 以Chao1 指数表征群落丰度,Shannon、Simpson 指数表征群落多样性,Goods_coverage 指数反映测序深度)进行肠道菌群的α 多样性分析,通过计算4 种距离(weighted_unifrac、unweighted_unifrac、jaccard、bray_curtis)以主成分分析(principal component analysis,PCA)法进行肠道菌群的β多样性评价;同时,从门水平分析肠道菌群的物种组成,并通过方差分析进行组间比较。
2.7 GABA、5-HT含量与肠道菌群相对丰度的相关性分析
对各组大鼠肠内容物中GABA、5-HT含量与肠道菌群相对丰度进行Pearson 相关性分析,并绘制热图。
2.8 统计学方法
采用SPSS 22.0 软件对数据进行统计分析。符合正态分布的计量资料以x±s 表示,两组间比较采用t 检验(方差齐)或校正t 检验(方差不齐);多组间比较采用单因素方差分析,事后多重比较采用LSD-t 检验(方差齐)或Tamhane’s T 2检验(方差不齐)。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。检验水准α=0.05。
3 结果
3.1 加味芍药甘草汤对大鼠一般情况、体重、Bristol 评分、粪便含水率的影响
与空白组比较,模型组大鼠形体瘦小,皮毛稀疏粗糙,行动变迟缓,其体重、Bristol 评分、粪便含水率均显著降低(P<0.05);与模型组比较,各药物组大鼠上述一般情况均有所改善,其体重、Bristol 评分、粪便含水率均显著升高(P<0.05)。结果见表1。
3.2 加味芍药甘草汤对大鼠肠道推进率的影响
与空白组[(81.34±11.19)%]比较,模型组大鼠的肠道墨汁推进长度明显缩短,肠道推进率[(33.51±9.52)%]显著降低(P<0.01);与模型组比较,加味芍药甘草汤组和阳性对照药组大鼠的肠道墨汁推进长度均有所延长,其推进率[(75.57%±12.44)% 、(52.64±15.38)%]均显著升高(P<0.05)。结果见图1。
3.3 加味芍药甘草汤对大鼠肠内容物中GABA、5-HT含量的影响
与空白组比较,模型组大鼠肠内容物中GABA含量显著升高,5-HT 含量显著降低(P<0.05);与模型组比较,加味芍药甘草汤组大鼠肠内容物中GABA含量显著降低,5-HT含量显著升高(P<0.05),而阳性对照药组大鼠肠内容物中上述指标含量的差异均无统计学意义(P>0.05)。结果见图2。
3.4 加味芍药甘草汤对大鼠肠道菌群的影响
3.4.1 α多样性
与空白组比较,模型组大鼠的Chao1、Shannon 指数均显著降低(P<0.05);与模型组比较,加味芍药甘草汤组大鼠的Chao1、Shannon 指数均显著升高(P<0.05),而阳性对照药组大鼠的Chao1、Shannon 指数和加味芍药甘草汤大鼠的Simpson 指数均显著降低(P<0.05);各组大鼠的Goods_coverage 指数比较,差异均无统计学意义(P>0.05)。结果见表2。
3.4.2 β多样性
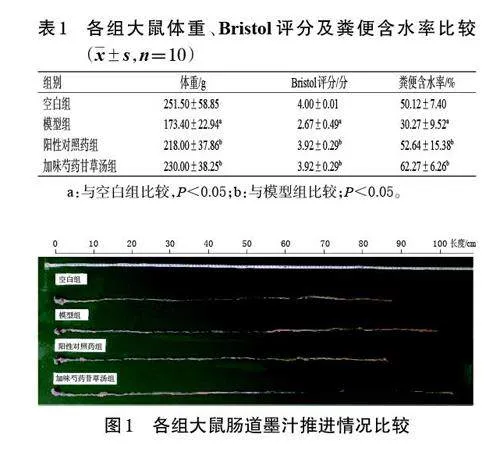
PCA结果提示,空白组与加味芍药甘草汤组肠道菌群可归为一类,与模型组距离较远;而阳性对照药组大鼠肠道菌群与模型组距离较近。结果见图3。
3.4.3 物种组成
门水平上,与空白组比较,模型组大鼠肠内容物中脱硫杆菌门Desulfobacterota 的相对丰度显著升高(P<0.05);厚壁菌门Firmicutes 的相对丰度虽有所降低,但差异无统计学意义(P>0.05)。与模型组比较,加味芍药甘草汤组大鼠肠内容物中脱硫杆菌门、厚壁菌门、拟杆菌门Bacteroidota 的相对丰度虽有回调,但差异均无统计学意义(P>0.05)。方差分析结果显示,脱硫杆菌门是组间差异因素(P<0.05)。结果见图4。
3.5 GABA、5-HT含量与肠道菌群相对丰度的相关性
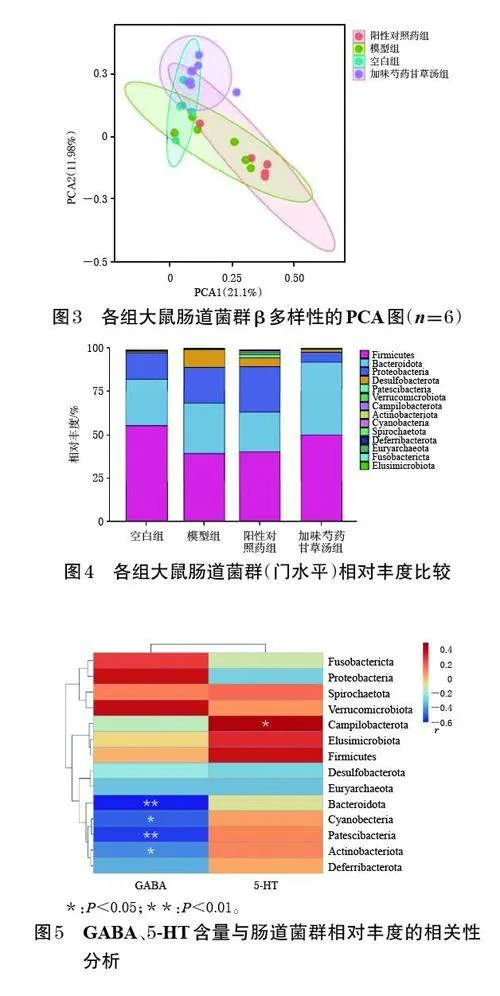
Pearson 分析结果提示,GABA的含量与拟杆菌门、蓝菌门Cyanobacteria、髌骨菌门Patescibacteria、放线菌门Actinobacteriota 的相对丰度呈负相关(r<0,P<0.01或P<0.05);5-HT 的含量与弯曲杆菌门Campilobacterota的相对丰度呈正相关(r>0,P<0.05)。结果见图5。
4 讨论
STC是一类以结肠传输减慢为特点的顽固性便秘,病情易反复且病程持久,严重影响患者的生活质量[1―2]。现代医学治疗STC一般以基础治疗为主,手段有限且远期效果不佳[15―16]。我国中医学认为,STC的病位在大肠,病机为大肠传输功能失常。研究证实,中医药治疗STC具有疗效确切、安全可靠、作用持久等优势[5,17]。加味芍药甘草汤由经典名方“芍药甘草汤”化裁而得,用于小儿STC的疗效确切[10]。本方重用白芍化阴降下为君,与甘草配伍酸甘化阴、养阴增液,且《本经疏证》记载“芍药合甘草以破肠胃之结”,因此白芍、甘草合用既能滋阴润燥,也能破肠胃之结以通下;辅以玄参、麦冬,可滋阴润燥、清热生津;枳实清脾热且理脾气,使气机得以通畅;厚朴一则增强枳实理气下行之功,二则制约玄参、枳实寒性太过,使脾气既不为热约、又不为寒凝;火麻仁润肠通便;生白术、太子参益脾气,降阴浊,升清阳,消水谷;全方共奏酸甘化阴、养阴增液、益气通便之功[10]。
GABA、5-HT 是反映肠道功能的重要介质,在STC发生发展中具有特殊的作用。近期研究表明,GABA能系统在肠神经系统中广泛表达,可与其他神经递质协同作用以维持肠道稳态,并可参与调节肠神经系统功能及肠激素分泌[11―12]。研究表明,GABA能激活肠道组织中的GABA A型受体(type A γ aminobutyric acid receptor,GABAAR),引起上皮细胞氯离子(Cl-)外流,从而使肠道基底侧水、电解质向肠腔内流动,从而调节肠道的水液代谢;同时,GABAAR激活后,可刺激肠嗜铬细胞分泌5-HT,5-HT分泌的增加可有助于改善机体的肠道传导功能[15―16]。此外,有研究指出,GABA具有一定的肠道动力促进作用,但高浓度GABA的作用可能与之相反;同时,GABA也是肠道菌群的营养来源之一,其在肠道菌群中的稳态是维持肠道动力正常的关键[5]。本研究结果显示,经加味芍药甘草汤干预后,大鼠肠内容物中GABA含量较模型组显著降低,5-HT含量较模型组显著升高,提示加味芍药甘草汤可能通过调节肠内容物中GABA 和5-HT 含量,进而改善模型大鼠的粪便Bristol评分、粪便含水率、肠道推进率等STC相关指标。
研究指出,肠道菌群失调是STC 等疾病的重要病因,而GABA和5-HT 作为肠道菌群与宿主的共代谢产物,在胃肠道疾病的发生发展中具有关键作用[18―20]。本研究结果表明,加味芍药甘草汤能够改善模型大鼠肠道菌群的多样性,使其接近空白组水平,且效果优于阳性对照药;同时,加味芍药甘草汤组拟杆菌门、厚壁菌门相对丰度均有增加趋势,且两者比例相较模型组更接近空白组;Pearson 分析结果显示,GABA的含量与拟杆菌门、蓝菌门、髌骨菌门、放线菌门的相对丰度呈负相关,5-HT的含量与弯曲杆菌门的相对丰度呈正相关,提示肠道菌群与宿主共代谢产物GABA、5-HT的含量与特定菌门显著相关。以上结果表明,各组大鼠肠道菌群组成具有高度的特异性,STC大鼠肠道菌群中有害菌(厚壁菌门、脱硫杆菌门等)的相对丰度增加,而加味芍药甘草汤可改善大鼠的肠道菌群结构,并可一定程度地下调有害菌的相对丰度,进而影响大鼠肠道菌群中GABA、5-HT的含量[21]。但本研究并未具体到菌属、菌种,这可能是药物组与模型组菌群丰度差异无统计学意义的原因,尚需后续实验予以完善。
综上所述,加味芍药甘草汤可改善STC模型大鼠粪便性状和肠道动力,上述作用可能与改善肠道菌群,进而影响肠内容物中GABA、5-HT含量有关;GABA、5-HT含量可能与拟杆菌门、弯曲杆菌门等特定菌门的相对丰度显著相关。
参考文献
[ 1 ] ROBIN S G,KELLER C,ZWIENER R,et al. Prevalence
of pediatric functional gastrointestinal disorders utilizing
the Rome Ⅳ criteria[J]. J Pediatr,2018,195:134-139.
[ 2 ] 许明敏. 基于肠道菌群探讨针刺改善FC小鼠胃肠传输
功能的效应机制研究[D]. 成都:成都中医药大学,2020.
XU M M. Study on the mechanism of acupuncture improving
gastrointestinal transmission function in FC mice
based on intestinal flora[D]. Chengdu:Chengdu University
of Traditional Chinese Medicine,2020.
[ 3 ] 中华医学会消化病学分会胃肠动力学组,功能性胃肠病
协作组. 中国慢性便秘专家共识意见:2019,广州[J]. 中
华消化杂志,2019,39(9):577-598.
Neurogastroenterology and Motility Committee,Chinese
Society of Gastroenterology,Functional Gastrointestinal
Disorder Group. Chinese expert consensus on chronic
constipation:2019,Guangzhou[J]. Chin J Dig,39(9):
577-598.
[ 4 ] CERESOLA E R,FERRARESE R,PRETI A,et al. Targeting
patients’ microbiota with probiotics and natural fibers
in adults and children with constipation[J]. Eur Rev
Med Pharmacol Sci,2018,22(20):7045-7057.
[ 5 ] ZHAO Y,YU Y B. Intestinal microbiota and chronic
constipation[J]. Springerplus,2016,5(1):1130.
[ 6 ] KOPPEN I J N,BENNINGA M A,TABBERS M M. Is
there a role for pre-,pro- and synbiotics in the treatment
of functional constipation in children? A systematic review
[J]. J Pediatr Gastroenterol Nutr,2016,63(Suppl. 1):S27-
S35.
[ 7 ] STRANDWITZ P. Neurotransmitter modulation by the
gut microbiota[J]. Brain Res,2018,1693:128-133.
[ 8 ] CHEN M J,RUAN G C,CHEN L,et al. Neurotransmitter
and intestinal interactions:focus on the microbiota-gutbrain
axis in irritable bowel syndrome[J]. Front Endocrinol
(Lausanne),2022,13:817100.
[ 9 ] SCHWÖRER H,RACKÉ K,KILBINGER H. GABA receptors
are involved in the modulation of the release of 5-
hydroxytryptamine from the vascularly perfused small intestine
of the guinea-pig[J]. Eur J Pharmacol,1989,165
(1):29-37.
[10] 万什方. 芍药甘草汤加味治疗儿童功能性便秘肠燥津亏
证的临床观察[D]. 成都:成都中医药大学,2023.
WAN S F. Clinical observation on the treatment of functional
constipation in children with intestinal dryness and
fluid deficiency by Modified shaoyao gancao decoction
[D]. Chengdu:Chengdu University of Traditional Chinese
Medicine,2023.
[11] DENG Y,ZHAO Q,ZHOU H Y,et al. Activation of
ASIC3/ERK pathway by paeoniflorin improves intestinal
fluid metabolism and visceral sensitivity in slow transit
constipated rats[J]. Kaohsiung J Med Sci,2024,40(6):
561-574.
[12] NGO D H,VO T S. An updated review on pharmaceutical
properties of gamma-aminobutyric acid[J]. Molecules,
2019,24(15):2678.
[13] ZHAN Y,WEN Y,ZHANG L L,et al. Paeoniflorin
improved constipation in the loperamide-induced rat
model via TGR5/TRPA1 signaling-mediated 5-hydroxytryptamine
secretion[J]. Evid Based Complement Alternat
Med. 2021:6076293.
[14] 宋攀. 中药高位保留灌肠对STC 大鼠结肠ICC 与血清
VIP的影响研究[D]. 南充:川北医学院,2017.
SONG P. Effect of high retention enema with traditional
Chinese medicine on colon ICC and serum VIP in STC
rats[D]. Nanchong:North Sichuan Medical College,2017.
[15] KOH W,KWAK H,CHEONG E,et al. GABA tone regulation
and its cognitive functions in the brain[J]. Nat Rev
Neurosci,2023,24(9):523-539.
[16] LUND M L,EGEROD K L,ENGELSTOFT M S,et al.
Enterochromaffin 5-HT cells:a major target for GLP-1
and gut microbial metabolites[J]. Mol Metab,2018,11:
70-83.
[17] BARBARA G,FEINLE-BISSET C,GHOSHAL U C,et
al. The intestinal microenvironment and functional gastrointestinal
disorders[J]. Gastroenterology,2016,150(6):
1305-1318.e8.
[18] DROSSMAN D A,HASLER W L. Rome Ⅳ:functional
GI disorders:disorders of gut-brain interaction[J]. Gastroenterology,
2016,150(6):1257-1261.
[19] HUNGIN A P S,MITCHELL C R,WHORWELL P,et al.
Systematic review:probiotics in the management of lower
gastrointestinal symptoms:an updated evidence-based international
consensus[J]. Aliment Pharmacol Ther,2018,
47(8):1054-1070.
[20] 陈振海,冯江毅,胡淞,等. 枯草芽孢杆菌通过TGR5/
TRPA1 信号通路调节慢性传输型便秘小鼠的肠蠕动[J].
中国现代应用药学,2022,39(7):878-884.
CHEN Z H,FENG J Y,HU S,et al. Bacillus subtilis regulates
intestinal peristalsis in mice with slow transit constipation
through the TGR5/TRPA1 signaling pathway[J].
Chin J Mod Appl Pharm,2022,39(7):878-884.
[21] 洪燕秋. 基于肠道微生态探讨运脾法治疗慢传输型便秘
的临床和实验研究[D]. 北京:北京中医药大学,2022.
HONG Y Q. Clinical and experimental study on the treatment
of slow transit constipation by spleen-activating
method based on intestinal microecology[D]. Beijing:
Beijing University of Chinese Medicine,2022.
(收稿日期:2024-05-29 修回日期:2024-12-01)
(编辑:张元媛)
