高原大棚越冬结球甘蓝游离小孢子培养技术
2025-01-31康少辉闫凤岐栗淑芳申领艳庞建曹雪梅








摘" " 要: 游离小孢子培养能够快速获得纯合单倍体,从而有效地缩短杂交后代的繁殖时间,是开展植物育种和基因改良的重要手段。总结了“张甘”系列游离小孢子培养技术,包括从材料播种、实验室准备、选蕾、花蕾消毒、抽提小孢子、离心、出胚培养、胚状体成苗培养、植株移栽等方面内容,以期为结球甘蓝育种者提供参考。“游离小孢子培养技术在甘蓝种质资源创制上的应用研究”成果,于2021年3月通过张家口市科学技术局组织的科技成果鉴定,为国际先进水平,取得河北省科技成果登记证书。
关键词: 结球甘蓝; 游离小孢子; 培养技术
中图分类号: S635.1 文献标志码: C 文章编号: 1673-2871(2025)01-196-05
Isolated microspore culture technique of overwintering cabbage in plateau greenhouse
KANG Shaohui, YAN Fengqi, LI Shufang, SHEN Lingyan, PANG Jianwen, CAO Xuemei
(Zhangjiakou Academy of Agricultural Science, Zhangjiakou 075000, Hebei, China)
Abstract: Isolated microspore culture could quickly obtain homozygous haploid, thus effectively reducing the reproduction time of hybrid offspring, which was an important means to carry out plant breeding and gene improvement. After years of research and exploration, the team had established a technical system for isolated microspore culture of cabbage in the alpine plateau area. In this paper, the techniques of isolated microspore culture of ‘Zhanggan’ series were summarized, including material sowing, laboratory preparation, bud selection, bud disinfection, pollen extraction, centrifugation, embryo culture, embryoid seedling culture, plant transplanting and so on, in order to provide reference for cabbage breeders. The results of the application of isolated microspore culture technology in the creation of cabbage germplasm resources were passed the appraisal of scientific and technological achievements organized by Zhangjiakou Science and Technology Bureau in March 2021, which was the international advanced level and obtained the registration certificate of scientific and technological achievements in Hebei province.
Key words: Brussels cabbage; Isolated microspore; Culture technology
结球甘蓝为一年生至二年生的十字花科芸薹属植物,具有显著的杂交优势。传统育种方式主要是自交不亲和系制种和雄性不育系制种[1-2],利用甘蓝杂交优势培育杂种1代。自交不亲和系制种的优势在于操作简便,杂种1代种子产量较高,可以同时进行正反交。但因花期自交时出现严重结实不良现象,需人工蕾期自交授粉,导致人工成本高,杂种1代种子纯度低,而且需要多年连续自交,育种年限长;雄性不育系制种是一种重要的制种方法,其优势在于可以免去人工去雄[3],从而减少生产成本,第一代杂交种子具有更高的纯度,但其不足之处在于保持系的选育和雄性不育系的培育比较困难。
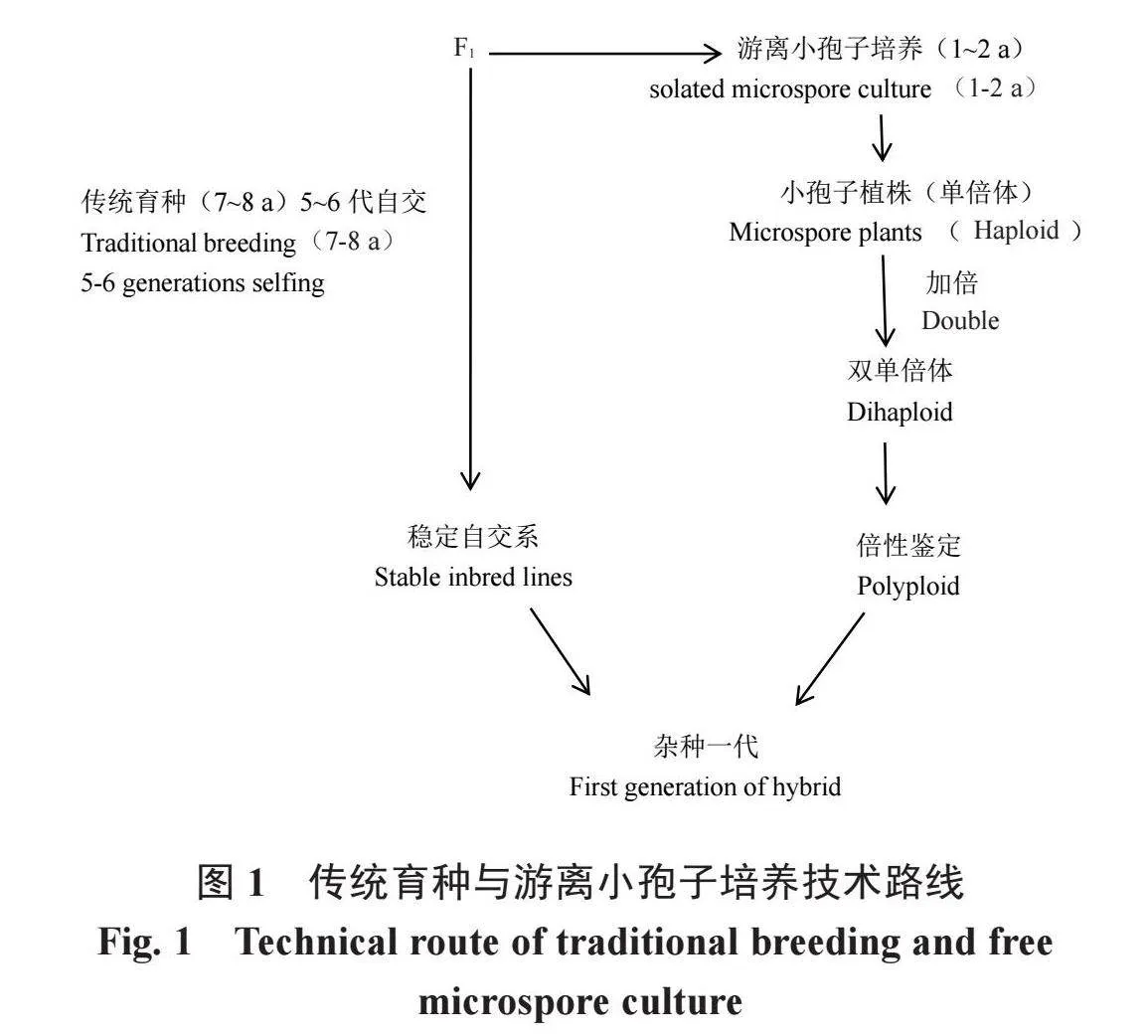
游离小孢子育种通过游离小孢子在离体条件下进行培养,通过胚状体或愈伤组织的诱导,再生出完整的单倍体植株,完全的单倍体细胞得以再生,而后经过诱导使染色体加倍[4],成为正常可育的DH系。该技术可得到纯合的二倍体,消除了显隐性基因的影响,获得遗传性状稳定的种质,缩短育种年限4~5 a(年)[5-6](图1)。该技术是一种快速获取纯系、用于作物遗传改良的一种重要方法。
1982年,Lichter[7]利用游离小孢子培养法,首次成功地得到了油菜游离小孢子植株,在此基础上,以芥菜、大白菜、白菜、甘蓝和芜菁等为材料,对其进行了游离小孢子培养,并获得了再生植株。现已在杂优亲本培育、常规育种、遗传群体构建和转基因等研究中广泛应用。甘蓝游离小孢子培养普遍存在出胚难、出胚率低等现象,探索提高甘蓝出胚率的途径也就成为本次研究的重点。由于高原地区冬季温度低,甘蓝露地越冬育种会出现冻死、冻伤的现象,成活率低,采用大棚栽培方式可以随时控温,使甘蓝能够很好地进行春化、抽薹、结籽。笔者团队从2017年研究探索,初步建立了高原大棚越冬结球甘蓝游离小孢子培养技术体系,利用该技术先后选育的张甘40、张甘60和张甘65等系列品种,居国际先进水平,在全国广泛推广应用,现将该技术总结如下。
1 材 料
1.1 播种
8月中旬在温室大棚穴盘育苗,选择72穴育苗盘,通常情况下,育苗基质一般选用草炭、蛭石、珍珠岩的配比(体积比)为8∶1∶1,每穴1粒,再用蛭石覆土[8],浇透水,苗期常规管理。
1.2 整地规划
大棚内起垄栽培,铺设滴灌带,垄沟70 cm,垄高20 cm,垄面30 cm。
1.3 定植
9月中旬,小苗长到5~6片真叶时开始定植,每垄定植1行,株距50~60 cm,标明号码牌,定植后浇定植水,后期田间常规管理,田间见干见湿,预防病虫害。
1.4 春化
1月初大棚内开始降温,白天将棉帘拉开一半,使温度保持在0~10 ℃,晚上关闭棉帘。低温春化时间为30~40 d,2月中旬白天将棉帘全部拉开,开始升温,使温度维持在20~25 ℃。
1.5 划十字
春化结束后,在球顶部用小刀划十字,深度以不伤害生长点、长度以外皮宜崩开为宜。
2 实验室准备
2.1 超净工作台灭菌
超净工作台用75%乙醇擦拭后,在紫外灯下灭菌30 min,再进行30 min通风。
2.2 灭菌
B5洗液:分装到三角瓶中,每瓶30~40 mL,用双层透气封口膜密封好,标明号码,120 ℃高压灭菌25 min,灭菌完成后,保存,避免粉尘污染。
NLN培养液:首先用0.45 μm微孔滤膜抽滤1次、0.22 μm微孔滤膜抽滤2次,在超净工作台上用0.22 μm微孔滤膜抽滤1次,分装到三角瓶中,每瓶30~40 mL,用双层透气封口膜密封好,标明号码,保存,避免粉尘污染。
超纯水:分装到带盖的500 mL玻璃瓶中,每瓶150~200 mL,盖子不要盖太紧,120 ℃高压灭菌25 min,灭菌完成后将盖子盖紧,标明号码,保存,避免粉尘污染。
3 选 蕾
因品种而异,一般3月初进入初花期,选择在09:00—10:00采蕾,晴天或阴雨天皆可(郭世星等[9]、孙继峰[10]研究报道低温有利于游离小孢子的胚胎发生)。选取主枝或生长状态较好的1级侧枝花蕾(图2),大小在4.50~5.49 mm之间[11],装入培养皿中,标明号码,放置在盛有冰袋的保温箱中。因不同的甘蓝品种花蕾的发育时期不同,可利用显微镜(25×)、坐标纸选取单核靠边期的花蕾(图3)。选蕾完成后(20蕾左右)标明号码,倒入60目铁丝网中,封口,放置于湿润的条件下低温保存(4 ℃冰箱)1~2 h,有利于出胚。
4 花蕾消毒
将所选择的花蕾置于一个三角形的玻璃瓶中,以75%乙醇进行1 min的灭菌,再用0.1%的升汞进行8~10 min的灭菌,最后用超纯水摇晃清洗3次,每次1 min。
5 抽提小孢子
将花蕾放置于玻璃管中,加入5~7 mL B5洗液,用玻璃棒研磨使小孢子散出,通过双尼龙网过滤器将小孢子滤液注入10 mL离心管内。用移液枪吸B5洗液冲洗过滤器中的小孢子,冲2~3次后,使10 mL离心管中小孢子悬浮液稀释,盖盖,用Parafilm膜封口,标明名称。
6 离 心
将小孢子悬浮液用离心机2000 r·min-1离心5 min,将离心管中的上层清液倒出,再加10 mL B5洗液,盖盖,用Parafilm膜封口。摇晃离心管将沉淀的小孢子冲散,再次将悬浮用离心机2000 r·min-1离心5 min,倒出上层清液,再加10 mL B5洗液,盖盖,用Parafilm膜封口。摇晃离心管将小孢子沉淀物(图4)冲散,再次将悬浮液用离心机2000 r·min-1离心5 min,倒出上层清液。
7 出胚培养
7.1 热激培养
将沉淀的小孢子用NLN-17[12-13]培养液稀释至淡黄色,用移液枪吸取3 mL分装到60 mm的培养皿中,在培养皿中再注入5 mL NLN-17培养液,用Parafilm膜封口,标明名称和时间。把分装好的培养皿放置在32 ℃恒温培养箱中暗培养2~3 d(48~72 h之间)。
7.2 置换培养
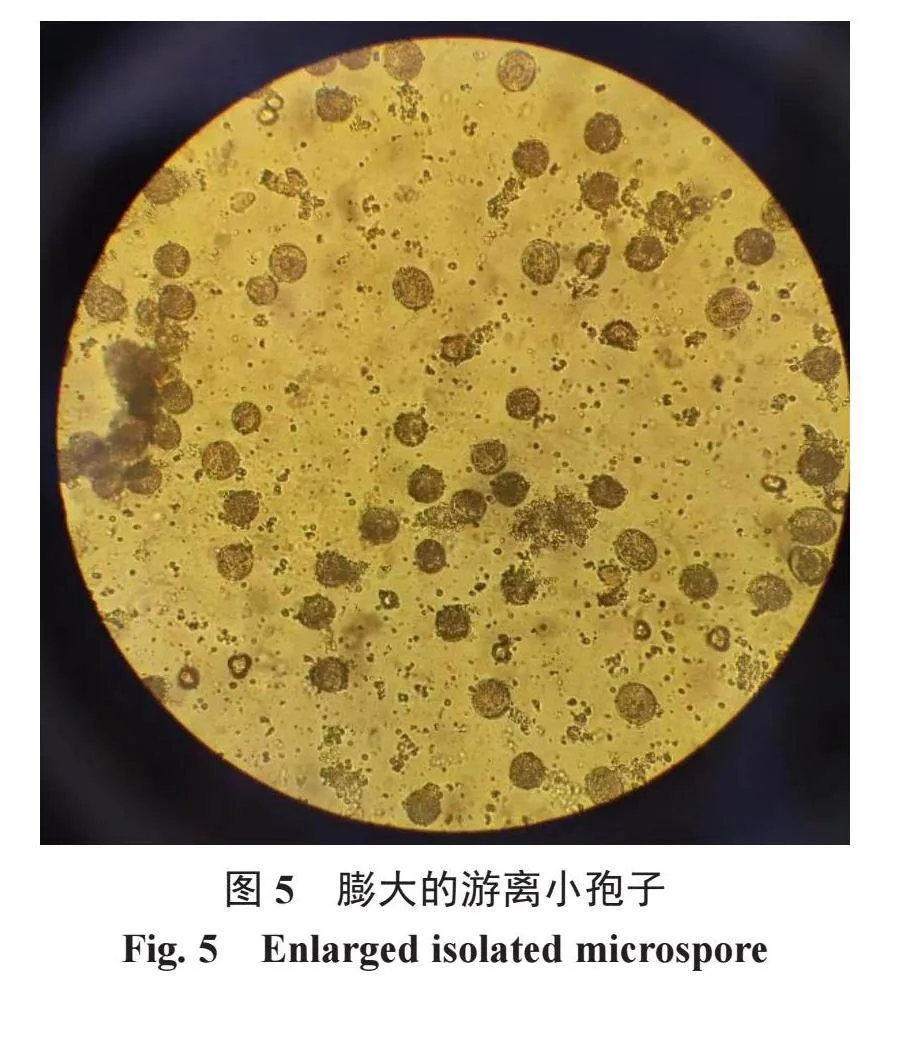
热激后检查培养皿中是否有出现污染情况,如果没有污染,就利用倒置显微镜(10×)挑选出大部分膨大的游离小孢子(图5)培养皿做置换。用移液枪把悬浮培养液吸入离心管中离心,用离心机2000 r·min-1离心5 min,倒掉NLN-17悬浮液体,留下沉淀的小孢子。用NLN-14培养液稀释沉淀的小孢子,并将其分装入90 mm培养皿中,一般每皿加入悬浮液5 mL左右,再注入5 mL NLN-14培养液,用Parafilm膜封口,标明名称、时间[14-16]。
7.3 静止培养
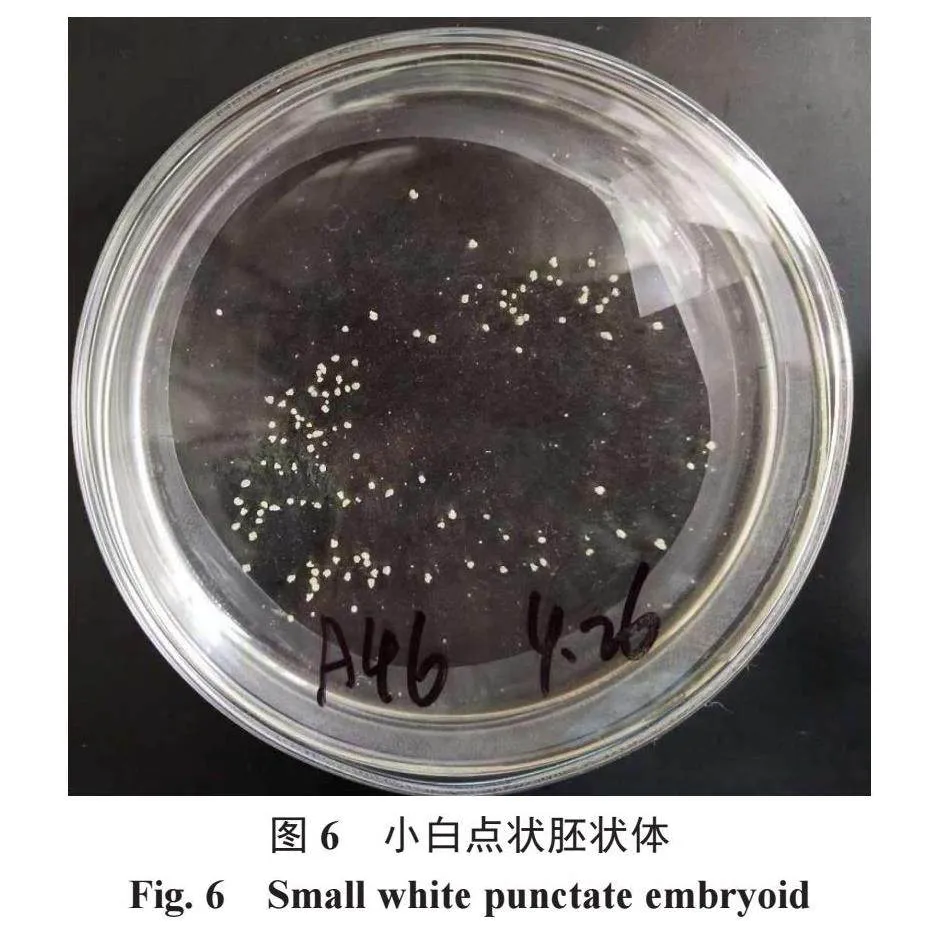
将封口的培养皿放置在25 ℃的恒温培养箱中进行暗培养,大约15 d后,观察有无明显的白色颗粒状胚的形成,如果没有则继续培养,如果有可见的小白点状胚出现,则改为振荡培养。
7.4 振荡培养
将出现有一定数量小白点状胚状体(图6)的培养皿放入60 r·min-1 25 ℃恒温摇床[17-18]上继续进行暗培养。
8 胚状体成苗培养
8.1 诱导培养
当暗培养的胚发育至子叶形胚时移入B5固体培养基(B5+Suc 30 g·L-1+Agar 10 g·L-1 +GA3 0.1 mg·L-1)上,在25 ℃ 12 h光/12 h暗2000 lx光强条件下培养,进行再生苗的诱导直至出现不定芽(图7)。
8.2 继代培养
不定芽长有2~3片小叶时,切下不定芽,转接到固体培养基(MS+ Suc 30 g·L-1+Agar 10 g·L-1+ 6-Ba 0.15 mg·L-1)中,在25 ℃ 12 h光/12 h暗 2000 lx光强条件下培养(图8)。
8.3 生根培养
当长到3~4片真叶时,转接到固体培养基(MS+ Suc 30 g·L-1+Agar10 g·L-1+NAA 0.1 mg·L-1)中,在25 ℃ 12 h光/12 h暗2000 lx光强条件下进行生根培养(图9)。
9 植株移栽
当获得的植株长有5~6片真叶时,打开封口膜炼苗(图10)2~3 d后,从试管中取出,洗净根系(一定要清洗干净,否则后期会有污染),移栽到花盆中,3~4 d后连盆带苗端到温室中(图11),3~4 d后定植到温室里,后期常规管理,培养成株。
10 倍性鉴定
由于小孢子培养出的植株是单倍体,育性差,不能正常结籽,在育种中往往不能被直接利用,必须诱导进行加倍(将含有0.2%秋水仙碱水溶液的棉球置于单倍体植物的顶端分生组织和次生组织部位,诱导分生组织细胞染色体加倍)处理,使之成为双单倍体(DH)植株。但通过诱导加倍的群体通常是单倍体、二倍体和多倍体组成的混合群体。通过倍性鉴定可快速获得可用于遗传和育种研究的大量二倍体植株。
利用流式细胞仪[19]可迅速准确地鉴定甘蓝成株材料是否为二倍体,这种检测不受植物取材部位和时间限制。
10.1 溶液配制
溶液Ⅰ:将4.2 g浓度为0.1 mol·L-1的柠檬酸和1 mL的0.5%的吐温20混合,将其定容至200 mL,在4 ℃下保存备用。
溶液Ⅱ:将28.65 g浓度为0.4 mol·L-1的磷酸氢二钠、碘化丙啶20 mg定容至200 mL,在室温下保存备用。
10.2 材料处理与检测
选取组培苗嫩叶1 cm2,放入裂解液中(200 μL溶液Ⅰ和600 μL溶液Ⅱ),用锋利的双面刀片切碎叶片,静置5 min使其裂解,经过尼龙筛网过滤,将所得滤液在离心机上1000 r·min-1离心6 min,倒掉上清液。加入碘化丙啶染色剂,混匀,4 ℃避光静置15 min后,取液体加入流式细胞仪内进行检测。以普通甘蓝二倍体植株作对照,分离峰出现在荧光强度200处即为二倍体。
参考文献
[1] 丁建刚,李成琼,宋洪元.中国结球甘蓝雄性不育研究进展[J].中国农学通报,2003,19(5): 154-155.
[2] 许蕊仙,许敏.甘蓝育种方法的探讨[J].东北农学院学报,1961(4): 91-95.
[3] 刘纪麟,熊秀珠.两个优良的玉米雄性不育系唐徐Mo17cms和双Mo17cms[J].湖北农业科学,1985(12): 1-3.
[4] 周亚星,周伟,梁爽,等.秋水仙素诱导高丹草杂种F1种子染色体加倍效应研究[J].内蒙古民族大学学报(自然科学版),2015,30(5): 402-406.
[5] 张恩慧,杨安平,许忠民,等.甘蓝游离小孢子培养技术体系的研究[J].陕西农业科学,2016,62(10): 8-10.
[6] 张胜雪,范伟强,王超楠,等.青萝卜游离小孢子培养体系优化[J].中国瓜菜,2022,35(2): 34-38.
[7] LICHTER R.Induction of haploid plants from isolated pollen of Brassica napus[J].Zeitschrift Fur Pflanzenphysiologie,1982,105(5): 427-434.
[8] 栗淑芳,苏浴源,申领艳,等.山区蔬菜基质育苗关键技术要点[J].蔬菜,2014(2): 41-42.
[9] 郭世星,牛应泽,刘玉贞.低温预处理对甘蓝型油菜小孢子胚胎发生的影响[J].中国农学通报,2005,21(9): 231-233.
[10] 孙继峰.温度对青花菜小孢子胚胎发生的影响及机理研究[D].北京: 中国农业科学院,2014.
[11] 张恩慧,马英夏,杨安平,等.甘蓝小孢子培养中花蕾长度与细胞单核期的关系[J].西北农业学报,2012,21(6): 124-128.
[12] 王莎莎.甘蓝小孢子发育观察与小孢子培养中高出胚率的诱导技术研究[D].陕西杨凌: 西北农林科技大学,2008.
[13] 冯辉,付颖,杨硕,等.基于小孢子培养的青梗菜多倍体育种技术研究[J].园艺学报,2011,38(7): 1299-1307.
[14] 李智军,曾晶,谭铭喜,等.芥蓝游离小孢子胚胎发生途径及2,4-D对成胚的影响[J].园艺学报,2021,48(8): 1605-1618.
[15] 毛忠良,张振超,姚悦梅,等.羽衣甘蓝小孢子胚胎发生观察及再生植株倍性鉴定[J].西北植物学报,2012,32(10):2016-2022.
[16] 伍健缤,陈坤豪,陈木溪,等.芸薹属蔬菜游离小孢子培养研究进展[J].农学学报,2022,12(3): 44-49.
[17] 张慧,汪承刚,宋江华,等.芸薹属蔬菜游离小孢子成胚影响因素研究进展[J].中国农学通报,2013,29(10): 92-96.
[18] 轩正英.芸薹属蔬菜游离小孢子培养技术研究进展[J].塔里木大学学报,2006,18(3): 46-50.
[19] 杨鼎,李崇娟,吕凤仙,等.流式细胞仪对甘蓝花粉倍性的测定[J].湖北农业科学,2024,63(4): 78-81.
