57例清开灵注射液不良反应报告的分析
2025-01-31邓晨辉
摘要:目的:本研究旨在分析我市医疗机构上报的清开灵注射液不良反应,为临床安全使用提供依据。方法:采用回顾性分析,收集2021年2月至2024年2月的57例不良反应报告,统计报告特征及患者资料。结果:报告中含1例严重不良反应(1.75%),13例新发现不良反应(22.81%)。女性及老年患者报告较多,不良反应与患者既往病史无显著关联。主要生产厂家为神威药业集团有限公司(92.98%),皮肤及其附件系统最常受影响,所有病例未导致严重后果,均通过静脉滴注给药。结论:临床使用前应询问患者既往不良反应史,按说明书推荐剂量和滴速给药,尤其在用药初期密切监测患者反应,以降低不良反应风险。
关键词:清开灵注射液;药品不良反应;分析
中图分类号:R969.3文献标志码:ADOI编码:10.3969/j.issn.1674-4977.2025.01.064
清开灵注射液由胆酸、猪去氧胆酸、珍珠母(粉)、水牛角(粉)、栀子、板蓝根、黄芩苷、金银花等精制而成的中药注射剂,具有清热解毒、化痰通络、醒神开窍的功效,用于热病、神昏、中风偏瘫、神志不清、急性肝炎、上呼吸道感染、肺炎、脑血栓形成、脑出血见上述症候者[1]。作为一种常用的中药注射剂,清开灵注射液的临床应用不断增多,也导致其不良反应发生日益增多,现将我市上报的清开灵注射液不良反应情况介绍如下。
1资料来源与方法
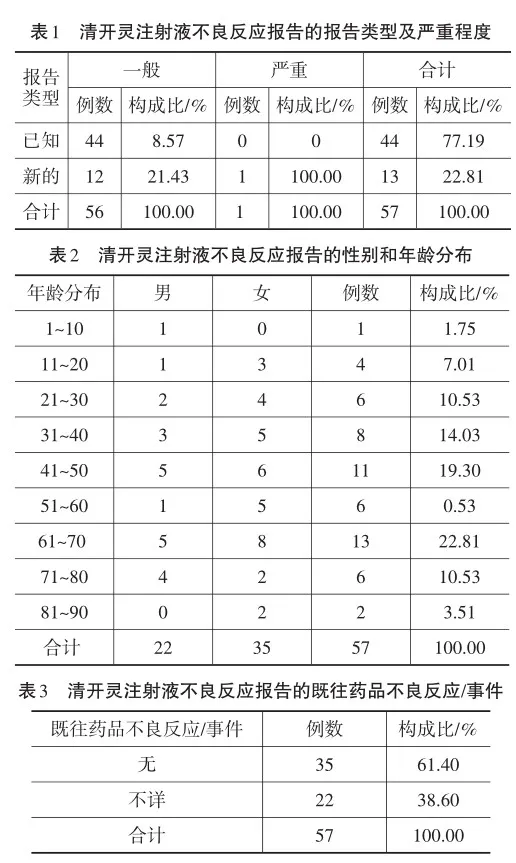
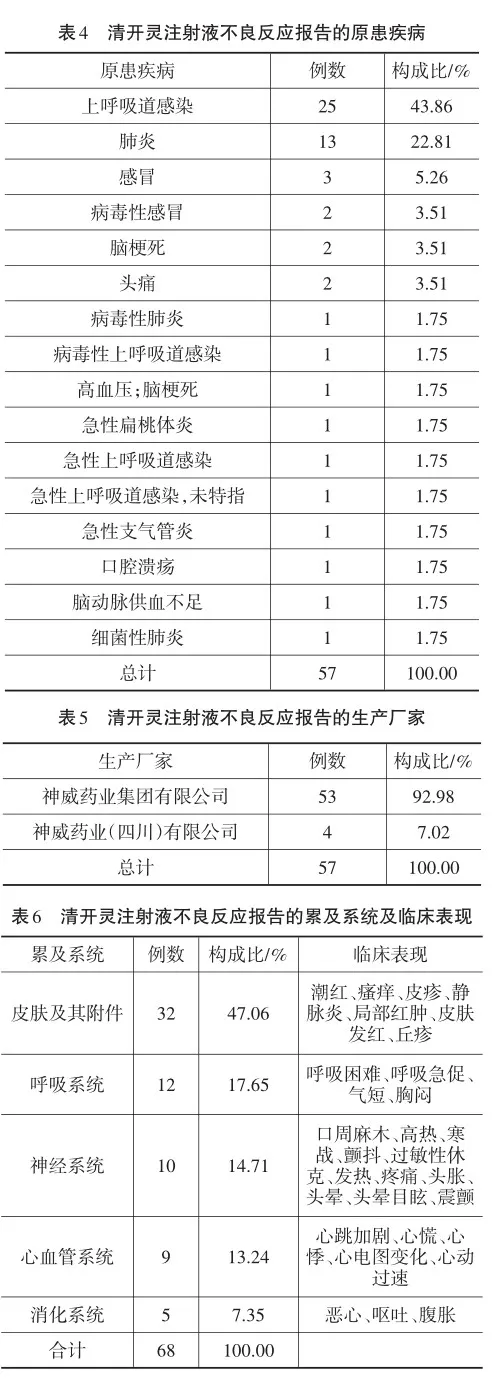
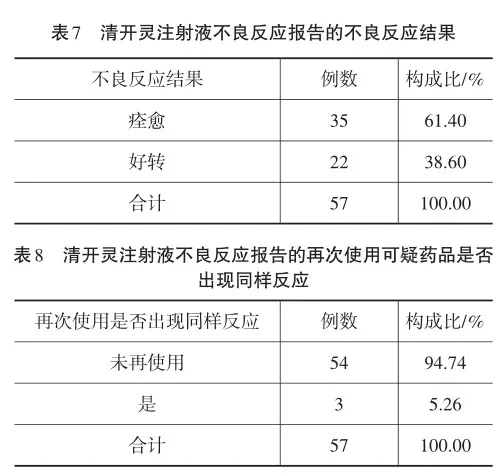
对葫芦岛市2021年2月20日至2024年2月20日期间,通过国家药品不良反应监测系统收集到的57例清开灵注射液不良反应报告进行回顾性分析。57例清开灵注射液均未超过有效期使用,其批准文号和生产批号填写完整,给药途径均为静脉滴注,报告均来自医疗机构。通过对57例清开灵注射液不良反应报告的报告类型和严重程度(见表1)、性别和年龄分布(见表2)、既往药品不良反应/事件(见表3)、原患疾病(见表4)、生产厂家(见表5)、累及系统及临床表现(不良反应名称)(见表6)、不良反应结果(见表7)、再次使用可疑药品是否出现同样反应(见表8)初步分析及构成比等进行统计。
2讨论
2.1报告类型及严重程度
57例清开灵注射液不良反应报告中,一般报告56例,严重报告1例,占报告总数的1.75%。新的报告13例,占报告总数的22.81%。研究表明,金银花、栀子、板蓝根能直接刺激肥大细胞脱颗粒发生类过敏反应[2];栀子提取液中京尼平苷和蔗糖,猪去氧胆酸注射液中残留的胆酸均为可疑致敏物质[3];水牛角、珍珠母的原药材均来源于动物,两味药材含有的异种蛋白很容易引起机体过敏;金银花中含有的绿原酸和异绿原酸,黄芩苷等也均有较高致敏作用[4]。清开灵注射液中多种致敏成分增加了其不良反应发生的概率,所以临床应用时应高度警惕,加强防范。
2.2性别和年龄分布
57例清开灵注射液不良反应报告中,女性多于男性,男女之比为1∶1.59;1~90岁之间各个年龄段均有不良反应的发生,年龄最小10岁,最大88岁,老年患者发生不良反应的例数多于青壮年患者,其中≥50岁老年患者有27例,占报告总数的47.38%。可能因为老年人各项生理机能弱于青壮年,其机体对药物的吸收、分布、代谢和排泄等功能减退,并且部分老年人患有多种基础疾病,并用药品种类较多,不良反应的发生率较高。因此,应根据患者的性别和年龄,合理化给药,尽量减少药品不良反应的发生。
2.3既往药品不良反应/事件
57例清开灵注射液不良反应报告中,患者既往药品不良反应/事件为无或者不详,可以看出不良反应的发生与既往药品不良反应/事件无明显相关性。
2.4原患疾病
57例清开灵注射液不良反应报告中,用于治疗呼吸系统疾病的共50例,占报告总数的87.72%,中医临床讲究辨证论治,清开灵注射液主要针对热证,并不适用于所有呼吸系统的疾病,若临床用药时没有辨证论治,则可增加不良反应发生率[5]。
2.5生产厂家
57例清开灵注射液不良反应报告中,涉及2个生产厂家,其中神威药业集团有限公司53例,占报告总数的92.98%,这可能与该厂家的清开灵注射液上市时间长、年生产高、临床使用量大有关。
2.6累及系统及临床表现
57例清开灵注射液不良反应报告中,累及系统以皮肤及其附件最多,占报告总数的47.06%,其次为呼吸系统和心血管系统,11例不良反应报告累及多个系统,主要原因是注射剂给药后可通过血液循环系统立即将药物送往全身[6],所以出现累及多个系统。大多数临床表现较轻微,但也存在过敏性休克、呼吸困难这样的严重不良反应,故用药前应充分了解患者既往药品不良反应/事件,用药期间密切观察,一旦出现不良反应,及时处理。
2.7不良反应结果
57例清开灵注射液不良反应报告中,不良反应结果痊愈35例,占报告总数的61.40%;好转22例,占报告总数的38.60%,均未造成严重后果。
2.8再次使用可疑药品是否出现同样反应
57例清开灵注射液不良反应报告中,54例未再次使用;3例再次使用后出现同样反应。再次使用后出现同样反应,更加证实不良反应的发生与药品的使用有关。
3结束语
清开灵注射液在临床用药过程中出现的不良反应表现较多,与其本身成分复杂、患者性别、年龄等因素有关。给药前临床医生应详细询问患者家族和既往药品不良反应/事件,根据患者年龄,严格依据说明书中的用法用量给药,并注意滴注速度,整个用药过程中尤其是前30分钟内,要密切观察患者的临床表现,注意患者的诉求,动态了解患者用药的状况,充分做好风险评估和防范,减少不良反应的发生。
参考文献
[1]国家药典委员会.中华人民共和国药典临床用药须知:中药成方制剂卷[M].北京:中国医药科技出版社,2015.
[2]陈莉婧.清开灵注射液不良反应性质及发生机制的初步研究[D].广州:南方医科大学,2011.
[3]张淇濛.清开灵注射液中致敏物质的研究[D].北京:北京化工大学,2013.
[4]王欢,王庆甫,王庆国.清开灵注射液及其中间品类过敏反应的实验研究[J].辽宁中医杂志,2015,42(10):1947-1949.
[5]李二平,周黎,韦敬土,等.122例清开灵注射剂致严重不良反应报告分析[J].中国民族民间医药,2017,26(15):136-138.
[6]万广闻,朱秀银,陈红斗,等.1477例清开灵注射剂及其口服制剂不良反应对比分析[J].中国药业,2019,28(13):83-85.
作者简介
邓晨辉,女,1987年出生,高级工程师,学士,研究方向为药品、化妆品不良反应,医疗器械不良事件及药物滥用监测。
(编辑:于淼,收稿日期:2024-07-18)
