疫霉侵染下烟草对哈茨木霉接种顺序的生理响应
2025-01-27任志超穆耀辉姚旭阳李淑娥张永峰任天宝刘国顺殷全玉



摘要:为探究疫霉侵染下烟草对哈茨木霉施用顺序的生理响应,采用盆栽试验方法,以接种清水为对照(CK),设置5个哈茨木霉处理,分别为接种疫霉孢子悬浮液(T1);接种哈茨木霉孢子悬浮液(T2);先接种疫霉孢子悬浮液,后接种哈茨木霉孢子悬浮液(T3);先接种哈茨木霉孢子悬浮液,后接种疫霉孢子悬浮液(T4);同时接种疫霉孢子悬浮液和哈茨木霉孢子悬浮液(T5),探究哈茨木霉接种顺序对疫霉侵染下烟草生物学性状、生理特性和诱导抗性的影响。结果表明,在烟株生长上,T4处理烟株的农艺性状较CK增幅最大,且地下部干、鲜重较CK分别增加103.73%、8.30%;在烟株生理特性上,哈茨木霉可缓解疫霉对烟株光合色素积累和根系活力的抑制作用,同时对二者有显著增益效果,还可增强烟株内碳氮代谢相关酶的活性。移栽后21 d,T4处理的硝酸还原酶和谷氨酰胺合成酶活性较CK分别提高13.14%和6.40%;在防治效果上,T4处理烟株黑胫病的发病率和病情指数最低,分别为39.39%和13.89%,且抗氧化酶活性最高。综上,烟株对哈茨木霉接种顺序的生理响应存在显著差异。在生产中,可提前接种哈茨木霉菌剂来促进烟草生长发育,抑制黑胫病的发病率。以上研究结果为调控烟草生长发育及黑胫病的综合防治奠定了理论基础。
关键词:哈茨木霉;疫霉;生物学性状;生理特性;诱导抗性
doi:10.13304/j.nykjdb.2023.0544
中图分类号:S572
文献标志码:A
文章编号:1008‑0864(2025)01‑0155‑10
寄生疫霉(Phytophthora parasitica)是引起黑胫病的病原菌,其寄主有烟草、番茄和茄子等多种植物[1-3]。烟草黑胫病是世界范围内最普遍和破坏性最大的烟草土传病害之一[4-6],可发生在烟草生长发育的各个时期,导致烟草根部和茎基部腐烂、叶片变黄、枯萎和坏死等症状[7‑8]。在高温、高湿环境下,病害会迅速蔓延,给烟草产量造成重大损失[9-11]。目前通常使用化学农药来防治烟草黑胫病,但长时间使用化学农药会使病原菌的抗药性增加,并造成环境污染,不利于烟草行业的可持续发展[12‑13]。
木霉菌(Trichoderma)是广泛存在于植物根部及土壤的一种真菌,极高的繁殖能力和对环境的高适应性使木霉具有强大的生存能力[14‑15]。木霉菌的次生代谢产物包含植物激素和激素类似物,可有效调节植物的生长发育,并改善其生理代谢[16]。付香等[17] 研究发现,棘孢木霉(Trichodermaasperellum)处理蓝莓幼苗可显著增加其根体积和生物量;Anhar等[18]研究发现,不同种木霉均可促进水稻幼苗的生长;廉华等[19]对黄瓜幼苗施用棘孢木霉,可提高黄瓜幼苗的叶绿素含量、根系活力、硝酸还原酶活性等生理特性。此外,木霉能够诱导植株对生物和非生物胁迫的局部或系统抗性,还能通过竞争作用、重寄生作用、抗生作用以及诱导植物抗性等机制来达到防治植物病害的效果[14,20-22]。Umadevi 等[23] 发现,哈茨木霉(Trichoderma harzianum)与黑胡椒互作可诱导黑胡椒对辣椒疫霉的系统抗性;王典等[13]发现,用哈茨木霉对烟草进行灌根处理,可显著降低烟株的黑胫病发病率。目前,虽然木霉已被应用于多种作物的病害防控研究,但关于木霉菌施用顺序对烟草生长发育、生理特性以及抗性诱导的影响缺乏系统研究。为此,本研究欲探究哈茨木霉和疫霉的接种顺序对烟草生物学性状、生理特性和抗性诱导的影响,以期为利用哈茨木霉调控烟草生长发育和黑胫病的综合防治提供理论基础。
1 材料与方法
1.1 供试材料
供试烤烟品种为‘K326’,由河南农业大学烟草育种实验室提供。
供试培养基为马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,加水至1 L;燕麦琼脂(oat agar,OA)培养基:60 g燕麦仁,20 g蔗糖,8 g琼脂,加水至1 L。
供试菌株:哈茨木霉CGMCC23294由中国农业科学院农业微生物菌种保藏中心提供,烟草疫霉[Phytophthora parasitica var. nicotianae (Breda dehean) Tuker]由河南农业大学烟草学院提供。
菌液制备:将哈茨木霉接入PDA平板,在黑暗条件(27±1) ℃倒置培养7 d后,用无菌水将孢子冲洗下来,制成1×107 CFU·mL-1的哈茨木霉孢子悬浮液备用。将烟草疫霉接入OA培养基,在黑暗条件(27±1)℃培养7 d后,用无菌水将孢子冲洗下来,并制成1×107 CFU·mL-1的疫霉孢子悬浮液备用。
1.2 试验设计
采用盆栽试验,于2023年2—5月在河南农业大学许昌校区现代烟草科教园区(34°18′N、113°48′E)人工气候室内进行。盆栽土壤采用大田耕层土壤,土样风干后过1 cm 孔径筛备用。盆规格为外径33 cm、高31.5 cm、底径22.5 cm,每盆装土1.5 kg,每盆施氮(N)1 g,氮(N)、磷(P2O5)、钾 (K2O)肥比例为1.0∶1.5∶3.0。每3 kg土施用硝酸铵2.857 g,硫酸钾5.56 g,重过磷酸钙3.26 g。
以接种清水为对照(CK),分别设置以下处理:先接种疫霉孢子悬浮液20 mL和清水20 mL,3 d后施用清水40 mL(T1);先接种哈茨木霉孢子悬浮液20 mL 和清水20 mL,3 d 后施用清水40 mL(T2);先接种疫霉孢子悬浮液20 mL和清水20 mL,3 d后接种哈茨木霉孢子悬浮液20 mL和清水20 mL(T3);先接种哈茨木霉孢子悬浮液20 mL和清水20 mL,3 d后接种疫霉孢子悬浮液20 mL和清水20 mL(T4);同时接种疫霉孢子悬浮液和哈茨木霉孢子悬浮液各20 mL,3 d后施用清水40 mL(T5)。
选取均匀饱满的烟草种子,将种子表面消毒(质量分数75% 乙醇,1 min;30% 双氧水,5 min)后,播种于装有灭菌基质的漂浮育苗盘中培育;待烟苗5 片真叶时,选取长势一致的烟株进行装盆移栽。用注射器针头在烟株茎基部划伤2个伤口,利用哈茨木霉孢子悬浮液和疫霉孢子液进行灌根处理;对照组使用等量清水灌根。各处理的栽培措施及后期管理措施均保持一致。
1.3 样品采集和测定方法
1.3.1 生物学性状
移栽后第28 天按照YC/T142—2010《烟草农艺性状调查测量方法》[24]测量各处理烟株的株高、茎围、节距和最大叶面积;取完整烟株鲜样,冲洗干净后,用吸水纸擦干表面,分别称量地上部和地下部鲜重,计算根冠比;之后将样本放于烘箱中105 ℃杀青15 min后,70 ℃烘干至恒重,称干重。
根冠比=地下部鲜重/地上部鲜重(1)
1.3.2 生理特性指标
移栽后7、14、21、28 d对烟株进行取样,采用丙酮-乙醇提取法[25]测定光合色素含量;采用TTC法[26]测定根系活力;采用苏州科铭生物技术有限公司生产的试剂盒(微量法)[27]测定根系硝酸还原酶(nitrate reductase,NR)和谷氨酰胺合成酶(glutamine synthetase,GS)活性。
1.3.3 发病率及诱导抗性指标
烟苗移栽后28 d,取各处理烟株的根部样本,采用苏州科铭生物技术有限公司生产的试剂盒(微量法)测定丙二醛(malondialdehyde,MDA)含量及超氧化物歧化酶(superoxide dismutase,SOD) 、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性[28]。根据GB/T23222—2008《烟草病虫害分级及调查方法》[29],在移栽后28 d调查各处理烟株黑胫病的发病情况(表1),并计算发病率和病情指数。
发病率=病叶(株)数/调查总数×100% (2)
病情指数=Σ(病级数×该级病株数)/(最高病级数×调查总株树)×100% (3)
防治效果=未发病株数/调查总株数×100%(4)
1.4 数据分析
采用Excel 2019整理试验数据,采用DPS 对数据进行方差分析和显著性检验,采用Origin2022软件进行绘图。
2 结果与分析
2.1 哈茨木霉对烟草生物学性状的影响
2.1.1 对烟株生长发育的影响
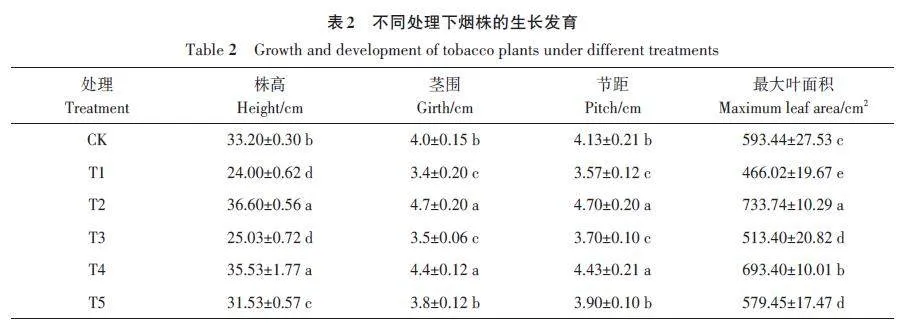
由表2和图1可知,T2和T4处理烟株的株高、茎围、节距、叶面积较CK均显著增加;而T1和T3处理烟株的株高、茎围、节距、叶面积较CK均显著降低,其中T1处理的降幅最大;T5处理烟株的株高、叶面积较CK显著降低,而茎围、节距与CK差异不显著。相较于CK,T4处理的株高、茎围、节距和叶面积分别显著增加7.02%、10.00%、7.26% 和16.84%;T3 处理分别显著降低24.61%、12.50%、10.41% 和13.49%;T5处理分别降低5.03%、5.00%、5.57%和2.37%。且T4处理烟株的生长发育较T3存在明显差异,说明哈茨木霉显著抑制了疫霉的毒害作用,且哈茨木霉和疫霉的接种顺序不同,促生效果也显著不同,表现为T4gt;T5gt;T3。
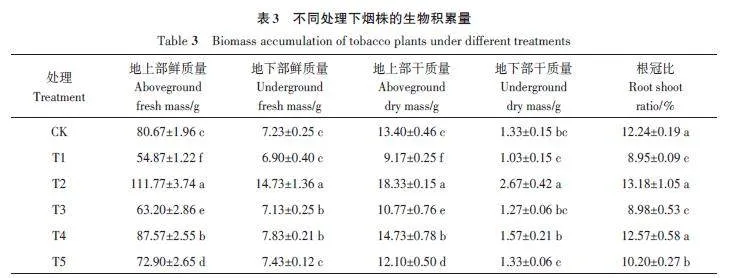
2.1.2 对烟株生物积累量的影响
由表3可知,各处理的地上部干、鲜重和地下部干、鲜重与CK均呈显著性差异。对于地上部干、鲜重,T2和T4处理较CK 分别显著增加36.79%、9.92% 和38.55%、8.55%;T1和T3处理较CK分别显著降低31.57%、19.63%和31.98%、21.66%;T5处理较CK分别显著降低9.63%、9.70%;故各处理的地上部干、鲜重表现为T2gt;T4gt;CKgt;T5gt;T3gt;T1。对于地下部干、鲜重,T2 和T4 处理较CK 显著增加100.75%、18.05% 和103.73%、8.30%;T1 和T3 处理较CK 显著降低22.56%、4.51% 和4.56%、1.38%。对于根冠比,T1、T3和T5处理显著小于CK,T2和T4处理与CK虽差异不显著,但均有不同程度的增加。由此说明,哈茨木霉可大幅促进烟株生物量的积累,且对地下部的促进作用大于地上部。
2.2 哈茨木霉对烟草生理特性的影响
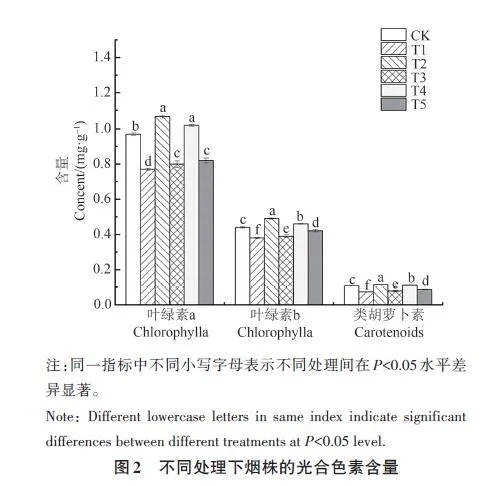
2.2.1 对烟株光合色素含量的影响
由图2 可知,各处理对烟株叶片内的光合色素含量影响显著。其中,T2和T4处理的叶绿素a、叶绿素b、类胡萝卜素含量较CK 分别显著增加10.31%、10.20%、6.48% 和5.15%、4.55%、3.70%;T1、T3 和T5 处理较CK 分别显著降低20.62%、13.64%、31.48% 和17.53%、11.36%、27.78% 和15.46%、4.55%、19.44%;不同处理表现为T2gt;T4gt;CKgt;T5gt;T3gt;T1。由此说明,哈茨木霉可缓解疫霉对烟株光合色素积累的抑制作用,且接种顺序不同效果存在显著差异,其中T4 处理最有利于光合色素的积累。
2.2.2 对烟株根系活力的影响
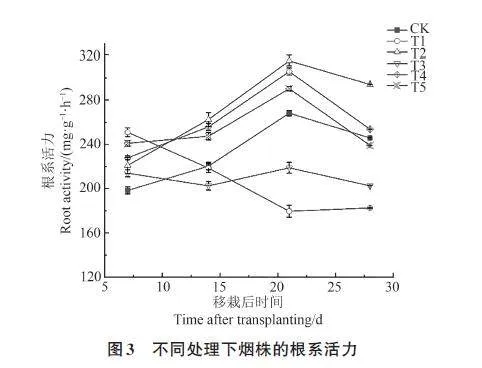
由图3可知,除T1和T3处理外,其他处理烟株的根系活力随着移栽时间的增加呈先升高后降低趋势,于移栽后21 d达到峰值,此时T2、T4和T5处理的根系活力较CK分别提高17.57%、14.02%和8.22%,而T1和T3 处理的根系活力较CK 分别降低33.02% 和18.41%。由此说明,哈茨木霉不仅可显著提升烟株的根系活力,还可降低疫霉对烟株根系活力的削弱作用;且接种顺序不同,对烟株根系活力的影响也存在差异,表现为T4gt;T5gt;T3。
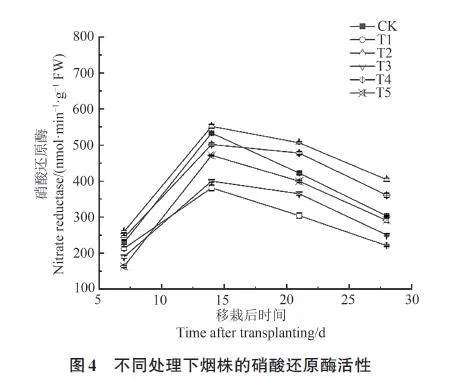
2.2.3 对烟株硝酸还原酶的影响
由图4可知,各处理烟株的硝酸还原酶活性随着移栽时间的增加呈先上升后降低趋势,于移栽后14 d达到峰值,此时T2和T4处理的硝酸还原酶活性较CK分别提高19.92% 和13.14%;T1、T3 和T5 处理的硝酸还原酶活性较CK降低27.95%、13.56%和5.34%;各处理表现为T2gt;T4gt;CKgt;T5gt;T3gt;T1。这说明哈茨木霉可显著提升烟株的硝酸还原酶活性,还可降低疫霉对烟株硝酸还原酶活性的削弱作用,且接种顺序不同,对烟株硝酸还原酶活性的影响也存在差异,表现为T4gt;T5gt;T3。
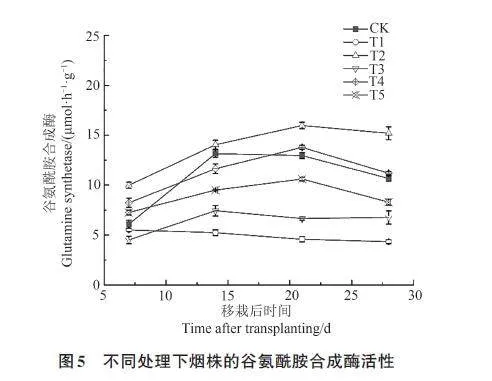
2.2.4 对烟株谷氨酰胺合成酶的影响
各处理烟株的谷氨酰胺合成酶活性随着时间的增加呈先上升后降低的趋势,在移栽后21 d达到峰值(图5)。此时, T2和T4处理的氨酰胺合成酶活性较CK分别提高23.30%和6.40%; T1、T3和T5处理的谷氨酰胺合成酶活性较CK分别降低64.66%、48.69%和18.13%。不同处理的谷氨酰胺合成酶的活性表现为T2gt;T4gt;CKgt;T5gt;T3gt;T1。由此说明,哈茨木霉可提升烟株的谷氨酰胺合成酶活性,还可降低疫霉对烟株的谷氨酰胺合成酶活性的抑制作用,且接种顺序不同,其效果也存在差异,表现为T4gt;T5gt;T3。
2.3 哈茨木霉对烟草诱导抗性的影响
2.3.1 对黑胫病防治效果的影响
由表4可知,接种哈茨木霉和疫霉的顺序不同对烟株黑胫病的防治效果也显著不同。接种哈茨木霉处理的发病率和病情指数较T1处理均显著降低,其中T4处理烟株的发病率和病情指数最低,分别为39.39%和13.89%;T3处理的发病率和病情指数最高,分别为84.85%和46.33%;接种哈茨木霉和疫霉的3个处理的发病率和病情指数均表现为T4lt;T5lt;T3。由此说明,预先接种哈茨木霉可有效降低烟株黑胫病的发病率和病情指数。
2.3.2 对烟株MDA 含量和抗氧化酶活性的影响
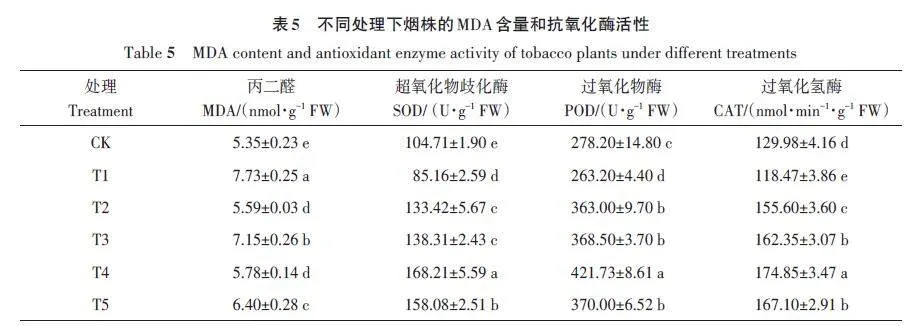
由表5可知,不同处理烟株的MDA含量存在显著差异。T3、T4、T5处理的MDA含量较CK分别显著升高33.65%、8.04%和19.63%,其中T3处理的MDA含量最高。除T1处理外,各处理烟株的抗氧化酶活性相较于CK 均有不同程度的升高,T3、T4、T5处理烟株的SOD、POD、CAT活性较CK显著提高,其中T4处理最高,较CK分别显著提高60.64%、51.59%、34.52%;T3 最低,分别为32.09%、32.46%、24.90%。由此说明,接种哈茨木霉可显著增强烟株的抗氧化酶活性,先接种哈茨木霉的处理效果更佳。
3 讨论
农艺性状和生物量是反映植物生长发育状况和抗胁迫能力的关键指标,黑胫病的发生造成烟株生物量降低甚至枯萎死亡[30]。本研究表明,单独接种疫霉导致烟株的株高、茎围、节距、叶面积和生物量显著降低;而单独接种哈茨木霉组有利于增加烟株的株高、茎围、节距、叶面积和生物量;接种两者的顺序不同对烟株的生长发育的影响也存在显著差异。其中,先接种哈茨木霉可显著降低疫霉侵染烟株的效果。这可能是哈茨木霉先于疫霉在烟株根部定殖,从而削弱了疫霉侵染烟株的能力[31]。哈茨木霉可改变烟株体内生长素、细胞分裂素、赤霉素等植物激素途径,以建立相互作用,从而改善植株的生长发育[32]。Sofo等[33]发现,樱桃砧木接种哈茨木霉T-22菌株后,植株叶片和根系的生长素含量显著上升。木霉的代谢产物中含有可促进烟株生长的类植物生长素6-PP(6-npentyl-6H-pyran-2-one)和降解乙烯前体物质的ACC 脱氨酶(1-aminocyclopropane-1-carboxylicaciddeaminase)[34]。同时,木霉与植物间的相互作用可促进植物根系的生长,形成发达的根系网络,增强对水和养分的获取,从而显著促进烟株生长及生物量的积累[35]。
生理指标是衡量烟株生长状况的重要依据,本研究表明,哈茨木霉和疫霉的接种顺序不同,二者对烟株的叶绿素含量、根系活力、硝酸还原酶和谷氨酰胺合成酶活性等生理指标的影响也不同,其中,先接种哈茨木霉对烟株各生理指标有良好的改善作用。由于接种顺序不同,疫霉对烟株侵染的能力也有所不同,随着疫霉不断侵染烟株,导致烟株的叶绿体和根系遭到不同程度的破坏,从而引起叶绿素含量和根系活力的降低[36]。研究表明,接种哈茨木霉可增加叶绿素含量,调节硝酸还原酶等碳、氮代谢相关酶的活性,提高烟株对疫霉胁迫的抗性,这与本研究结果一致[34,37]。
植物在逆境胁迫下会产生过量的活性氧,从而引发膜脂过氧化,而MDA是膜脂过氧化作用形成的最终产物,是衡量植物细胞膜脂质过氧化程度的重要指标[38‑39]。SOD通过歧化作用使逆境产生的O2-转化为对植物细胞伤害更大的H2O2 和OH-自由基,而CAT和POD则具有清除H2O2的作用[41]。膜脂过氧化产物和抗氧化酶活性均与植物的抗病性密切相关。木霉与植物的互作过程中可诱导植物SOD、POD、CAT等抗氧化酶活性提高,抑制病原菌和诱导植物抗性[41‑42]。廉华等[43]研究表明,3 种不同木霉对黄瓜枯萎病的防效均在66.81%以上,且黄瓜的POD、CAT、SOD等保护性酶活性均呈上升趋势,说明木霉侵染植株后导致防御酶活性增强,加强了对病原菌侵染的抵御能力。本研究表明,相较于只接种疫霉处理,接种哈茨木霉可降低烟株黑胫病的发病率和病情指数,不同接种顺序会使烟株的抗病能力存在差异,其中,先接种哈茨木霉烟株的POD、CAT、SOD活性最高,对烟株黑胫病的防治效果达到60.61%,说明先接种哈茨木霉烟株的响应程度更高。
哈茨木霉的接种顺序不同,烟株对疫霉胁迫下的生物学性状、生理特性和抗性诱导等生理响应存在差异,结合烟株在不同处理中的表现得出:随着哈茨木霉接种顺序的提前,烟株的生理响应也呈现增强趋势,其中最先接种哈茨木霉处理烟株的生理响应最佳。
参考文献
[1] 申贵,王源超,郑小波.不同寄主来源寄生疫霉菌株的遗传变异分析[J].生物多样性,2003,11(6):486-490.
SHEN G, WANG Y C, ZHENG X B. Genetic variation amongPhytophthora parasitica strains isolated from different hostplants [J]. Biodiversity Sci., 2003,11(6):486-490.
[2] REN X L, ZHANG N, CAO M H, et al .. Biological control oftobacco black shank and colonization of tobacco roots by aPaenibacillus polymyxa strain C5 [J]. Biol. Fert. Soils, 2012, 48(6):613-620.
[3] BAO Y G, DING N, QIN Q L, et al .. Genetic mapping of the Phgene conferring disease resistance to black shank in tobacco [J/OL].Mol. Breed., 2019, 39: 1036x [2023-06-15]. https://doi.org/10.1007/s11032-019-1036-x.
[4] HAN T, YOU C, ZHANG L, et al .. Biocontrol potential ofantagonist Bacillus subtilis Tpb55 against tobacco black shank [J].Biol. Control, 2016, 61(2):195-205.
[5] 贾孟媛,王越洋,唐培培,等.烟草黑胫病生防菌的筛选鉴定及其防效[J]. 湖南农业大学学报(自然科学版),2023,49(3):329-334.
JIA M Y, WANG Y Y, TANG P P,et al ... Screening andidentification of biocontrol bacteria for tobacco black shankdisease and evaluation of the control effect [J]. J. Hunan Agric.Univ., 2023, 49(3):329-334.
[6] 向立刚,汪汉成,罗飞,等.感染青枯病与黑胫病烟株的根际土壤、根及茎秆微生物代谢特征分析[J].烟草科技,2023,56(3):17-24.
XIANG L G, WANG H C, LUO F, et al .. Metaboliccharacteristics of microorganisms in rhizosphere soil, roots,andstalks of tobacco plants infected with bacterial wilt andblack shank [J]. Tob. Sci. Tech., 2023, 56 (3):17-24.
[7] GAI X T, LU C H, XIA Z Y, et al .. Crop rotation suppressestobacco black shank disease incited by Phytophthoranicotianae and influenced the structure of rhizosphere bacterialcommunities [J]. J. Plant Pathol., 2023, 16(2):1-10.
[8] 任锡跃,刘涛,朱发亮,等.β-氨基丁酸对烟草黑胫病的抗性诱导[J].烟草科技,2023,56(1):47-51,65.
REN X Y, LIU T, ZHU F L, et al .. Resistance induction byβ-aminobutyric acid against tobacco black shank disease [J].Tob. Sci. Tech., 2023, 56(1):47-51,65.
[9] SONG R F, TAN Y J, AHMED W, et al .. Unraveling theexpression of differentially expressed proteins and enzymaticactivity in response to Phytophthora nicotianae across differentflue-cured tobacco cultivars [J]. BMC Microbiol., 2022, 22(1):1-13.
[10] TIAN S F, CHEN Y P, ZI S H, et al .. Thiamine inducesresistance in tobacco against black shank [J]. Aust. Plant Path.,2022, 51(2):231-243.
[11] 匡志豪,王典,云菲,等.哈茨木霉施用方式对烟草生长、黑胫病防治及诱导抗性的影响[J].山东农业科学,2023, 55(2):119-126.
KUANG Z H, WANG D, YUN F, et al .. Effects of Trichodermaharzianum application methods on tobacco growth, blackshank control and induced resistance [J]. Shandong Agric. Sci.,2023, 55(2):119-126.
[12] 王全贞,夏贤仁,邓涛,等.3种生物制剂在宣威南部烟区的防病提质效果研究[J].湖南农业科学,2023,449(2):57-62.
WANG Q Z, XIA X R, DENG T, et al .. Effect of threebiological agents on disease control and quality improvementin the southern Xuanwei area [J]. Hunan Agric. Sci., 2023,449(2):57-62.
[13] 王典,匡志豪,孙晓伟,等.哈茨木霉对烟草生长/产质量及黑胫病防效的影响[J].贵州农业科学,2023,51(3):27-35.
WANG D, KUANG Z H, SUN X W, et al .. Effect ofTrichoderma harzianum on growth, yield and quality of tobaccoand control effect of black shank disease [J]. Guizhou Agric.Sci., 2023, 51(3):27-35.
[14] 李玥,罗丽芬,王烜东,等.三七根际耐皂苷木霉菌的分离鉴定及其拮抗促生活性评价[J]. 中国农业大学学报,2023,28(8):133-143.
LI Y, LUO L F, WANG X D, et al .. Isolation and identificationof ginsenosides-tolerant Trichoderma strains from rhizosphereof Panax notoginseng and evaluation of their effect onantagonistic and growth promotion activity [J]. J. China Agric.Univ., 2023, 28(8):133-143.
[15] GHISALBERTI E L. Anti-infective agents produced by thehyphomycetes genera Trichoderma and Gliocladium [J]. Curr.Med. Chem. Ant. Infective Agents, 2002, 1(4):343-374.
[16] ILLESCAS M, PEDRERO-MÉNDEZ A, PITORINIBOVOLINIM, et al .. Phytohormone production profiles inTrichoderma species and their relationship to wheat plantresponses to water stress [J/OL]. Pathogens, 2021, 10(8):991[2023-06-15]. https://doi.org/10.3390/pathogens10080991.
[17] 付香,王贺新,王碟,等.棘孢木霉的分离鉴定及其对蓝莓生长发育的影响[J].中国果树,2023(6):46-53.
FU X, WANG H X, WANG D, et al .. Isolation andidentification of Trichoderma spinosum and its effect on thegrowth and development of blueberries [J]. Chin. Fruit. Tree,2023(6):46-53.
[18] ANHAR A, PUTRI D H, ADVINDA L, et al .. Molecularcharacterization of Trichoderma strains from west sumatera,indonesia and their beneficial effects on rice seedling growth [J].J. Crop Sci. Biol., 2021, 24:441-448.
[19] 廉华,马光恕,李梅,等.棘孢木霉菌剂对黄瓜生理特性及产质量的影响[J].中国农业大学学报,2021,26(6):42-52.
LIAN H, MA G S, LI M, et al .. Effects of Trichoderma asperellumagents on physiological characteristics, yield and quality ofcucumber [J]. J. China Agric. Univ., 2021,26(6):42-52.
[20] 沈海斌,王前程,陈捷,等.三株木霉对番茄枯萎病的防治效果和机理研究[J].植物生理学报,2023,59(5):965-976.
SHEN H B, WANG Q C, CHEN J, et al .. Efficacy andmechanism of three Trichoderma strains for control of tomatoFusarium wilt [J]. Plant Physiol. J., 2023, 59(5):965-976.
[21] CELAR F A, KOS K. Compatibility of the commercialbiological control agents Trichoderma asperellum (ICC 012)and Trichoderma gamsii (ICC 080) with selected herbicides [J].J. Plant Dis. Prot., 2022, 129(1):85-92.
[22] GADERER R, LAMDAN N L, FRISCHMANN A, et al .. Sm2,a paralog of the Trichoderma cerato-platanin elicitor Sm1, isalso highly important for plant protection conferred by thefungal-root interaction of Trichoderma with maize [J/OL]. BMCMicrobiol., 2015, 15(1):2 [2023-06-15]. https://doi.org/10.1186/s12866-014-0333-0.
[23] UMADEVI P, ANANDARAJ M. Proteomic analysis of thetripartite interaction between black pepper, Trichodermaharzianum and Phytophthora capsici provides insights intoinduced systemic resistance mediated by Trichoderma spp [J].Eur. J. Plant Pathol., 2019, 154: 607-620.
[24] 申国明,陈爱国,王程栋,等. 烟草农艺性状调查测量方法:YC/T 142-2010[S].北京:中国标准出版社,2010.
[25] 许大全.叶绿素含量的测定及其应用中的几个问题[J].植物生理学通讯,2009,45(9):896-898.
XU D Q. Several problems in measurement and application ofchlorophyll content [J]. Plant Physiol. Commun., 2009, 45(9):896-898.
[26] 高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000:1-287.
[27] LI S H, YANG D Q, TIAN J, et al .. Physiological andtranscriptional response of carbohydrate and nitrogenmetabolism in tomato plant leaves to nickel ion and nitrogenlevels [J/OL]. Sci. Hortic., 2022, 292: 110620 [2023-06-15].https://doi.org/10.1016/j.scienta.2021.110620.
[28] ARFAN M, ZHANG D W, ZOU L J, et al .. Hydrogen peroxideand nitric oxide crosstalk mediates brassinosteroids inducedcold stress tolerance in Medicago truncatula [J/OL]. Int. J. Mol.Sci., 2019, 20(1): 144 [2023-06-15]. https://doi.org/10.3390/ijms20010144.
[29] 任广伟,孔凡玉,王凤龙,等.烟草病虫害分级及调查方法:GB/T 23222—2008[S].北京:中国标准出版社,2008.
[30] SHI R, HUBERT H, DEXTER-BOONE A, et al .. Identificationand validation of SNP markers associated with Wz-mediatedPhytophthora nicotianae resistance in Nicotiana tabacum L [J/OL].Mol. Breeding., 2019, 39(7): 2 [2023-06-15]. https://doi.org/10.1007/s11032-019-1015-2.
[31] 尤佳琪,吴明德,李国庆,等.木霉在植物病害生物防治中的应用及作用机制[J].中国生物防治学报,2019,35(6):966-976.
YOU J Q, WU M D, LI G Q, et al .. Application and mechanismof Trichoderma in biological control of plant disease [J]. Chin.J. Biol. Control, 2019, 35(6):966-976.
[32] MARTÍNEZ-MEDINA A, DEL MAR ALGUACIL M,PASCUAL J A, et al .. Phytohormone profiles induced byTrichoderma isolates correspond with their biocontrol and plantgrowth-promoting activity on melon plants [J]. J. Chem. Ecol.,2014, 40:804-815.
[33] SOFO A, TATARANNI G, XILOYANNIS C, et al .. Direct effectsof Trichoderma harzianum strain T-22 on micropropagatedshoots of GiSeLa6® (Prunus cerasus×Prunus canescens) rootstock[J]. Environ. Exp. Bot., 2012, 76:33-38.
[34] 殷全玉,匡志豪,王景,等.黑胫病不同抗性烤烟品种对哈茨木霉的生理响应[J].河南农业科学,2022,51(9):88-98.
YIN Q Y, KUANG Z H, WANG J, et al . Physiologicalresponses of different black shank-resistance flue-curedtobacco varieties to Trichoderma harzianum [J]. Henan Agric.Sci., 2022, 51(9):88-98.
[35] GUZMÁN-GUZMÁN P, PORRAS-TRONCOSO M D,OLMEDO-MONFIL V, et al .. Trichoderma species: versatileplant symbionts [J]. Phytopathology, 2019, 109(1):6-16.
[36] 董环宇,杨超群,郭笑维,等.不同抗性烟草品种(系)苗期接种PVY 后生理生化指标变化[J]. 延边大学农学学报,2022,44(3):29-37.
DONG H Y, YANG C Q, GUO X W, et al .. Changes ofphysiological and biochemical indexes of different resistanttobacco varieties (lines) after PVY inoculation at seedling stage[J]. J. Agron. Yanbian Univ., 2022, 44(3):29-37.
[37] JIANG Y, SUN Y F, ZHENG D F, et al .. Physiological andtranscriptome analyses for assessing the effects of exogenousuniconazole on drought tolerance in hemp (Cannabis sativa L.)[J/OL]. Sci. Rep., 2021, 11:14476 [2023-06-15]. https://doi.org/10.1038/S41598-021-93820-6.
[38] 王诗雅,郑殿峰,项洪涛,等. 初花期淹水胁迫对大豆叶片AsA-GSH循环的损伤及烯效唑的缓解效应[J].中国农业科学,2021,54(2):271-285.
WANG S Y, ZHENG D F, XIANG H T, et al .. Damage of AsAGSHcycle of soybean leaves under waterlogging stress atinitial flowing stage and the mitigation effect of uniconazole [J].Sci. Agric. Sin., 2021, 54(2):71-285.
[39] ZARGAR S M, GUPTA N, NAZIR M, et al .. Impact of droughton photosynthesis: molecular perspective [J]. Plant Gene,2017, 11:154-159.
[40] 丁凯鑫,王立春,田国奎,等.干旱胁迫下不同品种马铃薯块茎膨大期叶片对烯效唑的生理响应[J].中国生态农业学报,2023,31(7):1067-1080.
DING K X, WANG L C, TIAN G K, et al .. Physiologicalresponses of leaves of different potato varieties to uniconazoleduring tuber expansion stage under drought stress [J]. Chin. J.Eco-Agric., 2023, 31(7):1067-1080.
[41] 马光恕,张渟,李润哲,等.拟康氏木霉菌剂对黄瓜幼苗生长、抗氧化系统及枯萎病防效的影响[J]. 干旱地区农业研究,2022,40(6):72-81,107.
MA G S, ZHANG Z, LI R Z, et al .. Effects of Trichodermapseudokoningiü agents on growth, antioxidant system andcontrol effect against Fusarium wilt of cucumber seedlings [J].Agric. Res. Arid Areas, 2022, 40(6):72-81,107.
[42] ELKELISH A A, ALHAITHLOUL H A S, QARI S H, et al ..Pretreatment with Trichoderma harzianum alleviateswaterlogging-induced growth alterations in tomato seedlings bymodulating physiological, biochemical, and molecularmechanisms [J/OL]. Environ. Exp. Bot., 2020, 171: 103946[2023-06-15]. https://doi.org/10.1016/j.envexpbot.2019.103946.
[43] 廉华,马光恕,靳亚忠,等.木霉分生孢子和厚垣孢子对黄瓜叶片抗氧化系统及枯萎病防效的影响[J].干旱地区农业研究,2021,39(4):71-79.
LIAN H, MA G S, JIN Y Z, et al .. Effects of Trichodermaconidia and chlamydospore on cucumber leaf antioxidantsystem and control efficacy of Fusarium wilt in cucumber [J].Agric. Res. Arid Areas, 2021, 39(4):71-79.
基金项目:中国烟草总公司陕西省公司科技项目(2021611000270042)。
