基于深度学习的医学影像自动诊断系统设计
2025-01-21李树峰李晓磊王安山



摘 要:在医疗领域,准确及时的医学影像诊断对疾病早期发现和治疗至关重要。而传统的人工解读方法基于医生的经验和技能,在日益增长的影像数据量面前力不从心,尤其是在罕见病和复杂病症的识别上,误诊和漏诊成为亟待解决的问题。鉴于此,本文提出一种集成深度学习技术的医学影像自动诊断系统设计方案,深入剖析自动诊断系统的设计思路与实现框架。经测试试验验证,该系统在敏感性和特异性方面表现优异,在实际应用中具有一定有效性。
关键词:深度学习;医学影像;医学诊断;系统设计
中图分类号:TP 391 " " 文献标志码:A
在21世纪的信息时代,医学成像技术的发展极大丰富了临床医生的诊断工具箱,从X射线、CT扫描到MRI和超声波等,这些技术为疾病的早期检测和精准治疗提供了前所未有的可能性。然而,医学影像的解读对放射科医师的专业知识和经验有较强的依赖性,不仅限制了诊断效率,而且增加了误诊风险,尤其是在资源有限的地区,专业医师的短缺更加剧了这一问题[1]。在此背景下,基于深度学习的医学影像自动诊断系统应运而生,它能够模仿人类视觉系统,利用自动特征学习和模式识别对疾病早期迹象进行快速识别与定位。然而,要构建一个既高效、又可靠的自动诊断系统,需要克服数据标注成本高、模型泛化能力不足和解释性差等挑战。本文旨在深入探讨深度学习在医学影像自动诊断中的应用,提出一种系统设计方案,以期减轻医生的工作负担,提高诊疗效率,减少误诊率,为患者提供更及时和个性化的医疗服务。
1 基于深度学习的医学影像自动诊断系统架构设计
基于深度学习的医学影像自动诊断系统的系统架构分为3个关键层次,即用户界面层、业务逻辑层以及数据库层,每个层次都具有重要作用,共同促进系统的高效运作与智能化诊断[2]。基于深度学习的医学影像自动诊断系统架构如图1所示。
数据库层是系统的基础支撑,主要用于存储海量的医学影像、病历资料以及模型参数等关键数据,为临床决策及时提供信息支持。业务逻辑层是系统的核心,采用微服务架构,将数据处理、模型识别和自动标注等功能模块化,辅助医生做出高效诊断。用户界面层是人机交互的窗口,采用响应式设计,主要包括门诊检查模块、病理模板编辑器和病历库查看界面,保证在多种设备上均能提供一致的用户体验。在系统运行过程中,用户界面层与业务逻辑层间通过WebSocket协议建立长连接,以进行实时通信。WebSocket协议通信流程如图2所示。
医生在用户界面层输入患者信息并启动检查后,业务逻辑层立即响应,调用深度学习模型进行影像分析。分析结果由WebSocket实时传输至前端界面。医生可以根据结果进行诊断并编辑检查报告。最终生成的病理检查报告存储至数据库层,便于患者和医生后续查询。
2 软件设计
2.1 影像预处理
由于原始医学影像是三维空间的投影,其灰度值分布可能受成像条件的影响(例如曝光时间、探测器灵敏度等),因此需要进行归一化处理。具体为统计每幅图像的最小和最大灰度值,并对每个像素点进行映射,如公式(1)所示。
(1)
式中:I表示原始图像中某个像素点的灰度值;Imin和Imax分别表示原始图像中的最小灰度值和最大灰度值;In表示经过归一化处理后,对应像素点的新灰度值。
这样,无论原始图像的灰度分布如何,经过处理后,所有图像的像素值都被约束在0~1,保证所有输入数据具有统一的动态范围。
为降低扫描仪电子噪声和患者移动造成的模糊影响,采用(3×3)ppi的高斯滤波器,标准差设置为1.5,对影像进行平滑处理,提升图像的对比度和细节可见度。针对纹理丰富的医学影像区域,采用自适应直方图均衡化(CLAHE)技术,将图像划分为多个(8×8)ppi的子区域,每个子区域独立进行直方图均衡化,以放大局部灰度变化。为避免在纹理密集区产生过度增强的伪影,设置剪切阈值为40,从而限制直方图均衡化强度,保持图像的自然观感。
2.2 特征提取与增强
医学影像的特征提取主要包括高级、低级特征2种。高级特征主要涉及图像的语义内容,低级特征则更多关注图像的纹理和形状等基本属性[3]。为了提高特征提取的可靠性和效率,本文采用一种新的混合特征提取框架。该框架分为2个主要部分:一是基于卷积神经网络(CNN)的高级特征提取,二是针对纹理和形状的低级特征提取。
对于高级特征,利用TensorFlow深度学习框架,加载由50个深度卷积层组成的ResNet-50模型。为了实现这一过程,需要遵循迁移学习策略,即在保留ResNet-50的前49层卷积层的基础上,移除模型的最后一层全连接层,保证能直接从卷积层的输出中提取特征,而不是进行最终的分类。使用全局平均池化(Global Average Pooling,GAP)算法来处理第49层的输出,如公式(2)所示。
(2)
式中:v表示单个特征图的全局平均池化结果;N表示一个特征向量元素;ai表示单个特征图中的元素数量;i表示特征图中第i个元素的激活值。
计算每个特征图中所有激活值的平均值,将每个特征图转换为一个单一数值,即该特征图的“代表性”值,从而有效捕获影像中的高级语义内容,例如器官的结构特征和病变的形态细节等。
低级特征提取需要采用尺度不变特征变换(SIFT)算法和方向梯度直方图(HOG)技术,以精细捕捉医学影像的纹理和形状特征。具体来说,需要检测图像中的关键点并计算其梯度方向直方图,生成128维的描述符,每个描述符能够详细描绘关键点周围的纹理信息。为了实现这一点,需要对灰度医学图像进行高斯金字塔构建,以多尺度方式定位关键点。给定一张灰度医学图像I(x,y,σ),应用一组高斯核函数G(x,y,σ)来生成尺度空间,如公式(3)所示。
L(x,y,σ)=I(x,y)*G(x,y,σ) (3)
式中:σ表示尺度参数;*表示卷积运算。
进而在尺度空间中寻找关键点,即那些在局部区域和尺度上都是极值的位置。对每个关键点选取(16×16)ppi邻域内的梯度方向直方图,将其量化为128维的SIFT描述符,从而构成纹理细节的密集表示,为自动诊断系统提供强大的底层支撑。
2.3 异常检测
完成特征提取与融合后,采用区域生成网络(RPN)对潜在异常区域进行初步定位[4]。使一个3*3的卷积核在特征图上滑动,以锚点(anchor)机制生成9个不同比例和尺寸的候选区域(Region Proposal),每个锚点生成3个比例(1∶1、1∶2和2∶1)和3个尺寸((128×128)ppi、
(256×256)ppi和(512×512)ppi)的候选框。进而对这些候选区域进行softmax分类(前景与背景)和边界框回归(用于修正锚点坐标)。设pti为第i个锚点属于前景的概率预测,ti为实际标签(前景为1,背景为0),交叉熵损失函数Lcls的计算过程如公式(4)所示。
(4)
式中:Ncls为锚点的数量。
对于边界框回归,使用平滑L1损失使预测边界框坐标与实际边界框坐标间的差异最小化。设tix和tiy分别为第i个锚点在x、y方向上的实际边界框偏移量,和为预测的偏移量,平滑L1损失函数Lreg的计算过程如公式(5)所示。
(5)
式中:Nreg为用于回归的锚点数量;smooth "L1(ς)为一个分段函数。
smoothL1(ς)如公式(6)所示。
(6)
式中:ς为平滑L1损失函数的输入,代表预测值与真实值间的差异,即边界框回归中的坐标偏移量误差。
当ς的绝对值<1时使用平方项,以减少梯度在ς接近0时的剧烈变化。当ς的绝对值>1时使用线性项,以保持对较大错误的惩罚。RPN的总损失函数L是分类损失和回归损失的加权和,如公式(7)所示。
L=λclsLcls+λregLreg (7)
式中:λcls、λreg分别为平衡两项损失的权重参数,通常需要根据具体任务进行调整。
为了提升检测精度,本文引入非极大值抑制(NMS)算法,设置IoU(交并比)阈值为0.7,对RPN输出的候选区域进行筛选,移除那些与更高置信度区域重叠面积>0.7的候选区域,最终保留约300个最具代表性的异常区域,用于后续精确分类和定位。
2.4 诊断结果输出
为了精确诊断病灶,系统运用基于数学形态学的图像处理技术,即采用开运算与闭运算对分割结果进行优化。开运算利用3×3结构元素进行腐蚀操作,有效剔除<3ppi的小型噪点,再进行等尺寸膨胀恢复病灶边缘,保证病灶主体不受损。闭运算则相反,先使用相同的3×3结构元素对图像进行膨胀,填充病灶内<3ppi的孔洞,再执行腐蚀操作,平滑边界同时保持病灶形状的连贯性,以提升分割精度与病灶轮廓的清晰度。
与此同时,为了满足医生对诊断结果可解释性的要求,系统引入Grad-CAM(Gradient-weighted Class Activation Mapping)算法,如公式(8)所示。
(8)
式中:LcGrad-CAM表示针对类别c的Grad-CAM热力图;αkc表示特征图Ak对于类别c的权重,由该类别得分相对于特征图Ak的梯度全局平均池化得到;Ak表示第k个特征图。
计算分类层相对于特征图的梯度,得到每个位置的重要性权重,进而生成加权激活图,高亮显示模型认为重要的病灶区域。这样不仅能够促进医生对模型推理过程的理解,而且可以为临床验证诊断结果的有效性提供直观的视觉依据,保证技术辅助诊断的可靠性和接受度。
3 测试试验
3.1 试验准备
在试验准备阶段,采用来自多个医疗机构合作的公开数据集,包括CT和MRI影像,分别对应不同疾病类别。具体来说,在CT影像数据集中,中央型肺癌正样本共计450张,周围型肺癌正样本460张;在MRI影像数据集中,浸润性导管癌正样本520张,小叶癌正样本530张,阿尔茨海默病正样本500张。此外,每个疾病类别均配有相应的负样本,分别为CT影像负样本500张和MRI影像负样本600张。数据集内的影像均来源于权威医学期刊,例如NEJM、JAMA、Lancet和Radiology等,保证样本的准确性和试验的可靠性。
3.2 试验结果
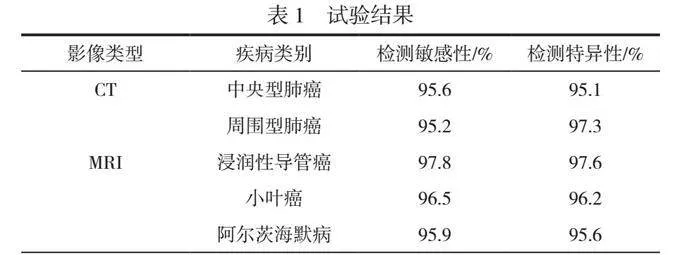
基于上述试验准备,系统输出医学影像自动诊断结果,并与专业放射科医生的人工诊断结果进行比较,以获取检测敏感性、检测特异性等评价指标。为了保证评估过程的客观性和公正性,采用盲法评估方式,即医生在不知系统诊断结果的情况下对影像进行独立诊断,然后将系统诊断结果与医生的人工诊断进行比较,进而获取试验结果,见表1。
由表1可知,本文系统在多种疾病识别中均表现优异。在CT影像领域中,针对中央型肺癌,系统不仅能够实现95.6%的高敏感性,敏锐地捕捉到微小的病灶变化,而且还维持了95.1%的特异性,有效避免了健康个体误诊;在周围型肺癌的检测中,系统的敏感性和特异性分别为95.2%和97.3%,表明该系统不仅能够准确检测病灶,而且能够更精准地区分肿瘤与良性病变。在MRI影像中,系统在乳腺癌识别中表现尤为突出。无论是浸润性导管癌还是更具挑战性的小叶癌,其检测敏感性和特异性均高于96%,表明系统几乎能发现所有病例,极少出现误报。而在阿尔茨海默病这项更隐匿的病理类型上,系统的表现同样亮眼,敏感性和特异性均高于95%。该结果表明,即便是在疾病发展的初期阶段,系统也能由MRI影像捕捉到微妙的脑结构变化,为早期干预和治疗提供宝贵的时间窗口。
4 结语
综上所述,本文设计在医学影像自动诊断中具有高灵敏度和高特异性的优势,能够精准识别微小病变,有效区分不同疾病的亚型。这种高水平的识别精度表明系统能够在复杂多变的医疗图像中准确无误地筛选出病灶,为临床诊断提供强有力的支持。未来的研究应当更注重跨学科合作,结合临床专家的知识与经验,进一步提升系统的鲁棒性和实用性。开发更智能、自适应的学习框架,以应对不断变化的医疗需求,将是下一阶段的重要任务。
参考文献
[1]唐蛰雨,李绍钦,贾中芝.基于CT图像的深度学习在主动脉夹层中的应用进展[J].南京医科大学学报(自然科学版),2024,44(8):1170-1174.
[2]林书臣,魏德健,张帅,等.深度学习在膝关节骨关节炎磁共振诊断中的研究进展[J].激光与光电子学进展,2024,61(14):61-78.
[3]李云飞,李淑婷,张帅,等.深度学习在肿瘤影像分类中的研究进展[J].中华肿瘤防治杂志,2024,31(12):719-724.
[4]莫莹君,郭瑞斌.基于声像图深度残差网络ResNet模型自动诊断肾囊肿[J].中国介入影像与治疗学,2022,19(4):221-224.
