西瓜对低氮胁迫响应的转录组分析
2024-12-31赵展王晓婷张黎凤赵津禾于玉红李军华吴占清





摘要:氮是植物必需的大量元素之一,对于西瓜生长发育至关重要。为阐明西瓜响应低氮胁迫的作用机制,对连续低氮胁迫下西瓜的表型变化进行分析,并利用Illumina Novaseq平台对3个氮素水平(CK、N1、N3)处理下第15天的西瓜叶片进行转录组测序。结果表明,低氮处理促进了西瓜地下根系伸长,但对地上植株长度和地上鲜重有明显抑制作用,处理后植株表现出地上部矮小的症状。转录组测序结果显示,在CK/N1、N1/N3、CK/N3对比中,分别鉴定出121、1 184、516个差异表达基因(differentially expressed genes,DEGs),其中共有的DEGs有12个,上调1个和下调11个,下调表达基因主要通过烟酰胺合成酶、bHLH转录因子、糖转运蛋白、叶绿素代谢等通路来响应低氮胁迫,而上调表达基因与酪氨酸代谢有关。综上,西瓜响应低氮胁迫是个复杂的过程,经转录组鉴定的与氮胁迫相关的关键基因在提高西瓜对低氮胁迫的耐受性以及提高西瓜的氮利用效率方面有重要作用。以上研究结果为深入研究西瓜低氮胁迫响应机理奠定了基础。
关键词:西瓜;响应;低氮胁迫;转录组分析doi:10.13304/j.nykjdb.2024.0156
中图分类号:S651 文献标志码:A 文章编号:10080864(2024)12003009
氮是植物体内蛋白质、核酸以及磷脂的重要组成部分,也是植物生长发育必需的大量元素之一,氮素缺乏会严重影响植物的生长发育、物质代谢和产量形成等[12]。土壤中可供植物吸收的氮素是有限的,人们经常通过施用过量氮肥来达到高产的目的。我国氮肥的平均利用率仅为33%[3]。高氮投入和低氮素利用效率(nitrogen useefficiency,NUE)不仅会增加作物生产成本,还会破坏生态环境,导致土壤酸化[4]、水体富营养化[56]、温室效应和大气污染[78]等,进而威胁人类健康。当前,减少氮肥投入、提高作物NUE是农业生产中亟需解决的问题。阐明作物对低氮耐受性的作用机制并选育耐低氮、氮高效利用的种质资源是实现“减氮增效”、降低环境污染最经济有效的途径,对于实现农业生产绿色和可持续发展也具有十分重要的意义。
植物吸收氮素最常见的形式是硝酸盐(NO− 3)和铵盐(NH+ 4),其中NO−3 是主要形式[9]。氮以NO−3 和NH+4 的形式通过其转运体被根系吸收。对大多数植物来说,根部同化吸收NO−3 后大部分被运送到地上茎部[10]。在同化过程中,NO−3 在叶片细胞质中先由硝酸还原酶(nitrate reductase,NR)还原为亚硝酸盐;然后,在叶绿体中亚硝酸盐还原酶(nitritereductase,NIR)和细胞质中谷氨酰胺合成酶(glutamine synthetase,GS)作用下被还原为NH+4[11-12]。这些合成的含氮化合物作为氨基酸、蛋白质和其他含氮代谢物的前体参与植物的生长发育[1314]。氮素供应不足时,植物会出现生长缓慢、叶片变黄、产量降低等症状[15-17],植株的光合能力也会减弱,导致生长不良[18-20]。研究证明,氮代谢过程中的关键基因对于促进植物的耐低氮程度、提高NUE具有十分重要的作用[21-23]。
RNA-Seq高通量测序技术被广泛用于多种作物的转录组分析,如油菜、小麦、水稻等,目的在于检测与缺氮有关的基因,并研究氮胁迫下可能的调控机制[24-26]。在低氮处理下, 甘蓝型油菜可以通过调控 BnaNRTs、BnaGN1s、BnaNIAs 家族基因提高NUE, 同时调控BnaMYBs、BnaWRKYs 家族和可变剪接积极适应低氮胁迫[24]。小麦响应低氮胁迫的重要途径有3条,即钙介导的植物−病原体相互作用、MAPK 信号通路和磷脂酰肌醇信号通路[25]。在水稻响应低氮胁迫过程中,根系通过调控与氮吸收利用、碳代谢和根系生长发育相关的基因来适应低氮环境[26]。
西瓜是我国重要的经济作物。研究表明,氮对西瓜生长具有十分重要的作用,它能显著促进西瓜生长发育,提高光合速率、产量、果实品质和水分利用效率[27];而氮素不足会严重影响西瓜生长,如缺氮会影响西瓜幼苗叶绿素荧光特性,进而降低生物量,不利于果实发育期果实膨大等[28]。由此可见,西瓜生长受低氮胁迫影响较大,但目前关于低氮胁迫影响西瓜生长的调控机制仍认识有限。因此,研究低氮胁迫对西瓜生长及其基因表达的影响对提高西瓜的NUE、获得高品质西瓜具有重要意义。本研究利用转录组测序技术分析西瓜生长过程对低氮胁迫的响应,鉴定与低氮胁迫相关的差异表达基因,为进一步研究西瓜生长响应低氮胁迫的分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试西瓜品种为‘满春’,由开封市农林科学研究院提供。经前期试验筛选,该材料对低氮条件适应性较好。
1.2 试验方法
挑选出大小一致、籽粒饱满的西瓜种子,用蒸馏水清洗干净后,平铺于滤纸上沥干水分后,用纱布包好放置在28 ℃恒温培养箱中催芽。待催芽结束,将种子播种于72孔穴盘中,放置在人工气候室培养(25 ℃/14 h光照,18 ℃/10 h黑暗);培养至3叶1心,挑选长势均匀的幼苗,清洗干净根部基质,注意保护根系的完整性,转移至含氮量分别为0.750 0(N1)、0.075 0 mmol·L−1 (N2)和0.007 5 mmol·L−1(N3)的营养液(改良的1/2 Hoagland配方,pH 7.0)进行低氮胁迫处理,以含氮量为7.500 0 mmol·L−1为对照(CK),连续培养22 d,每3 d更换1次营养液。各处理营养液配制如下。
1.3 西瓜幼苗表型测定
分别在胁迫第8、第15和第22天测定幼苗的地上部长度和鲜重、地下部长度和鲜重。每处理6株,3次重复。
1.4 西瓜幼苗响应低氮胁迫的转录组测序
1.4.1 样品获取 在胁迫第15天分别取CK、N1、N3处理的叶片,提取总RNA,质量检测合格后送北京果壳生物科技有限公司利用Illumina Novaseq平台进行转录组测序。每处理3株, 2次重复。
1.4.2 样品检测与文库构建 测序后获得的原始数据(raw data),经过滤后得到有效数据(cleandata),与西瓜参考基因组(http://cucurbitgenomics.org/ftp/genome/watermelon/97103/v2/)进行序列比对,得到比对数据(mapped data),用于新基因挖掘、差异表达分析、差异表达基因(differentiallyexpressed genes,DEGs)功能注释和功能富集等生物信息学分析。
1.4.3 差异基因筛选 各样本基因表达量用每千个碱基的转录每百万映射读取的片段数(fragments per kilobase of transcript per million"mapped reads,FPKM)算法[1]进行归一化处理。
利用差异倍数(fold change,FC)和错误发现率(1 discovery rate,FDR)筛选DEGs,将FC≥2.00 且FDRlt;0.05 作为筛选标准。对DEGs 进行GO(gene ontology)功能注释和富集分析,利用KEGG(Kyoto encyclopedia of genes and genomes)数据库进行通路注释分析,应用STRING软件对DEGs进行蛋白质互作分析。
1.5 数据分析
利用Excel 2010 软件进行数据处理和绘图,采用SPSS 22.0 软件进行数据分析,利用Duncan’s 多重比较法进行差异显著性比较。
2 结果与分析
2.1 低氮胁迫条件下对西瓜生长表型的影响
在连续低氮胁迫处理下,幼苗生长发育受阻,表现出植株矮小等症状(图1)。在第8天,幼苗地上部鲜重、地下部鲜重和地下部长度在4个处理间均无显著差异,但N3 处理的地上部长度显著低于CK和N2处理;随着处理时间的延长,CK处理的地上部长度、地上部鲜重、地下部长度和地下部鲜重均呈逐渐增加趋势,N1和N2处理也有类似趋势;在第15和第22天,幼苗的地上部长度和地上部鲜重随着氮胁迫的加强显著降低,其中N2和N3处理的地下部长度均大于CK。此外,在第8、第15和第22天时,N1处理的地下部鲜重均高于CK,其中在第15和第22天显著高于CK。由此表明,低氮胁迫初期,西瓜幼苗在不同氮素水平处理下的表型变化较小;随着低氮胁迫时间的延长,胁迫程度越强,对幼苗表型的影响越大,低氮胁迫促进根系的伸长,但对于地上部生长有明显抑制作用。
2.2 西瓜响应低氮胁迫的转录组分析
2.2.1 转录组测序数据分析 对CK、N1和N3处理第15 天的叶片进行转录组测序,结果(表1)表明,检测到的有效数据分别为44 680 604、42 755 765和44 968 308,获得比对基因组的数据分别为43 215 897、41 534 388和43 682 840,比对效率分别为96.73%、97.14% 和97.16%,Q30碱基百分比分别是91.05、91.43和91.57,GC含量分别为44.94%、45.52%和45.98%。
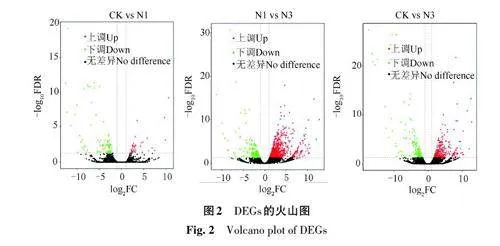
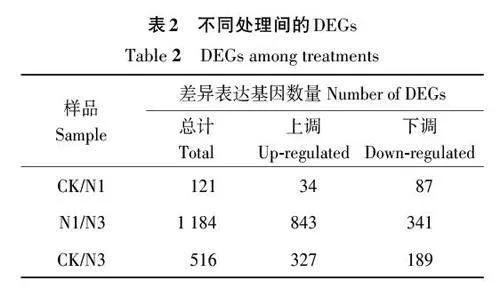
2.2.2 DEGs分析 由表2和图2可知,CK 与N1相比,共发现121 个DEGs,其中上调34 个,下调87个;N1与N3相比,DEGs共1 184个,其中上调843 个,下调341 个;CK 与N3 相比,DEGs 共516个,其中上调327个,下调189个。
2.2.3 DEGs的GO富集分析 对CK与N1、N1与N3、CK 与N3 间的DEGs 分别进行GO 富集分析(图3)发现,均包括生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecularfunction),GO 注释数量分别是110、1 134、484个。富集显著的生物学过程均包括花粉识别、金属离子转运和蛋白质代谢相关过程;富集显著的分子功能均包括电子载体活性、转移酶活性、转移除氨基酰基以外的酰基、氧化还原酶活性、蛋白质丝氨酸/苏氨酸激酶活性、水解酶活性;由于CK/N1富集显著的细胞组分只有细胞核,因此在3组对比中暂未发现均显著的细胞组分。以上结果表明,低氮胁迫对西瓜特定生长发育阶段的花粉发育、金属离子转运以及与之有关的分子功能影响较大。
2.2.4 DEGs 的KEGG 通路富集分析 对CK 与N1、N1与N3、CK与N3间的DEGs分别进行KEGG通路富集分析(图4)发现,富集最为显著的20个代谢通路均包括苯丙烷类物质生物合成、类黄酮生物合成、酪氨酸代谢、异喹啉生物碱的生物合成,其中苯丙烷类物质生物合成在3组对比中的DEGs数量分别为7、26、22个,这些基因有上调表达,也有下调表达;类黄酮生物合成在3 组对比中的DEGs数量分别为1、8、7个,这些基因在CK与N1对比中,均为下调表达,在N1与N3、CK与N3对比中,有上调表达,也有下调表达;酪氨酸代谢在3组对比中的DEGs数量分别是2、9、7个,且均为上调表达;异喹啉生物碱的生物合成在3组对比中的DEGs数量分别为1、7、5个,均为上调表达。综上表明,低氮胁迫下DEGs可能主要通过这些代谢通路上调或者下调影响西瓜的生长发育。
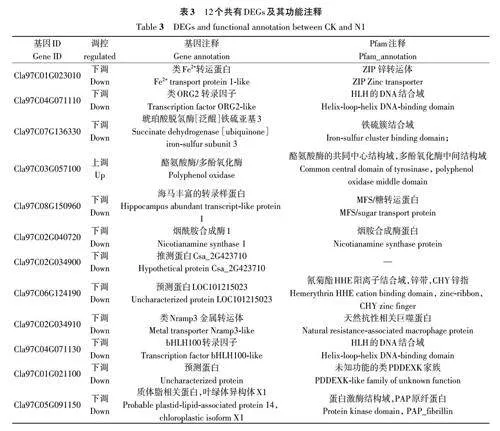
2.2.5 关键DEGs分析 为进一步分析西瓜幼苗响应低氮胁迫的关键基因,以 FDR≤0.01 且FC≥2.00 为标准,从CK 与N1、N1 与N3、CK 与N3 的DEGs中查找共有基因,结果(表3)发现,3组对比的DEGs 中共有12 个共有的DEGs,其中有11 个下调表达,这11个基因有4个(Cla97C01G023010、Cla97C07G136330、Cla97C02G040720、Cla97C02G0-34910)编码铁、锌、铁-硫等转运蛋白、金属转运体以及与金属离子转运相关的烟酰胺合成酶基因,有2 个(Cla97C04G071110、 Cla97C04G071130)编码bHLH 转录因子,有1个(Cla97C08G150960)编码糖转运蛋白,还有1个(Cla97C05G091150)与叶绿素代谢有关,有3 个(Cla97C06G124190、Cla97C01G021100、Cla97C02G034900)未注释到功能,为推测蛋白;Cla97C03G057100在3组对比中均为上调表达,该基因编码多酚氧化酶,与酪氨酸代谢有关。以上结果表明,这12 个共同的DEGs可能在西瓜响应低氮胁迫过程中发挥重要作用,主要通过烟酰胺合成酶、bHLH 转录因子、糖转运蛋白、叶绿素代谢相关蛋白、酪氨酸代谢相关蛋白的下调或上调来响应低氮胁迫。
3 讨论
氮是植物生长发育过程的重要营养元素。研究表明,氮供应不足,植物表现出明显的应答反应,如水稻、玉米、烟草及地毯草等在缺氮条件下生长受到严重抑制,表现生长慢、叶片黄、产量低、干物质量少等症状,植株会通过根系伸长来吸收深层土壤中的硝态氮,以便获得更高的NUE[15-17]。本研究表明,连续的低氮胁迫使西瓜幼苗根系伸长,但地上部生长受到显著抑制,由此表明,提高植株NUE对促进植物生长发育具有重要意义。
本研究利用转录组测序技术对低氮胁迫15 d的西瓜幼苗叶片进行分析发现,CK 与N1、N1与N3、CK 与N3 对比的DEGs 分别有121、1 184、516个,与大麦[10]、小麦[25]、水稻[26]、马铃薯[29]等作物中DEGs数量差异较大,说明不同物种对低氮胁迫的响应程度不同。GO富集分析显示,CK与N1的DEGs主要参与金属离子转运、信号转导、花粉识别等过程;N1与N3的DEGs主要参与金属离子转运、信号转导、花粉识别、蛋白质代谢等过程;CK 与N3 的DEGs 主要参与糖酵解、氮代谢等过程,与前人研究结果[10,25,29]类似;但在3组对比中,均有DEGs参与蛋白质代谢、花粉识别和金属离子转运,行使电子载体活性、转移酶活性、氧化还原酶活性、蛋白质丝氨酸/苏氨酸激酶活性、水解酶活性等功能,说明西瓜幼苗响应低氮胁迫除了主要通过参与光合作用、氮代谢、蛋白质代谢等关键基因外,参与花粉识别和金属离子转运的基因也起重要作用。KEGG富集通路分析显示,CK与N1、N1与N3、CK与N3对比中均包含多种代谢通路,如光合生物钟的碳固定、光合作用,天线蛋白、乙醛酸盐和二羧酸盐代谢、碳代谢、氨基酸的生物合成、氮代谢等,与大麦中的结果[10]类似;在3组对比中,均包括的代谢通路有苯丙烷类物质生物合成、类黄酮生物合成、酪氨酸代谢和异喹啉生物碱的生物合成,说明低氮胁迫下西瓜DEGs可能通过多种代谢通路起作用。
为了响应土壤中有效氮水平的变化,植物进化出了复杂的适应策略。前人对植物响应低氮胁迫的分子调控机制进行了较多研究,证明植物响应低氮胁迫的关键调控基因与植物对低氮胁迫的耐受性和获得较高NUE密切相关。Zhang等[21]利用全基因组分析方法在大豆中发现了1个特异的GATA 基因(GmGATA44),该基因具有抗低氮胁迫的功能。He等[30]在小麦中过表达TaNAC2-5A 可促进根系生长,提高硝酸盐流入速率,从而提高根系获取氮的能力。Tang 等[23]在水稻中过表达玉米 C4-PEPC 基因,可提高低氮胁迫下的光呼吸通路,从而增强转基因株系对低氮胁迫的耐受性、提高产量。Wang 等[31]在玉米中过表达玉米内源2-烯醛还原酶ZmAER 基因,显著提高了转基因植物对低氮胁迫的耐受性。本研究基于转录组测序技术,对CK与N1、N1与N3、CK与N3进行对比,发现共同的关键DEGs 12个,其中11个下调表达,1个上调表达。在下调表达基因中有 4 个(Cla97C01-G023010、Cla97C07G136330、Cla97C02G040720、Cla97C02G034910)是编码铁、锌、铁-硫等转运蛋白以及与金属离子转运相关的烟酰胺合成酶(nicotianamine synthase, NAS),其他下调基因主要是通过bHLH转录因子、糖转运蛋白、叶绿素代谢等通路来响应低氮胁迫;上调表达基因则与酪氨酸代谢有关。这些基因可能在增强西瓜对低氮胁迫的耐受性以及提高西瓜NUE方面有重要作用,为进一步深入研究西瓜低氮胁迫响应机制奠定了基础。
参考文献
[1] DU Q G, YANG J, SYED MUHAMMAD SADIQ S, et al ..Comparative transcriptome analysis of different nitrogen responses in low-nitrogen sensitive and tolerant maize genotypes [J]. J. Integr. Agric., 2021,20(8):2043-2055.
[2] SHIN S Y, JEONG J S, LIM J Y, et al .. Transcriptomic analyses of rice (Oryza sativa) genes and non-coding RNAs under nitrogen starvation using multiple omics technologies [J].BMC Genom., 2018,19(1):1-20.
[3] PENG S B, BURESH R J, HUANG J L, et al .. Improving nitrogen fertilization in rice by sitespecific N management. a review [J]. Agron. Sustain. Dev., 2010,30(3):649-656.
[4] YANG F, ZHANG Z L, BARBERÁN A, et al .. Nitrogeninduced acidification plays a vital role driving ecosystem functions: insights from a 6-year nitrogen enrichment experiment in a Tibetan alpine meadow [J/OL]. Soil Biol.Biochem., 2021, 153: 108107 [2024-02-20]. https://doi.org/10.1016/j.soilbio.2020.108107.
[5] GAUDINIER A, RODRIGUEZ-MEDINA J, ZHANG L F, et al..Transcriptional regulation of nitrogen-associated metabolism and growth [J]. Nature, 2018,563:259-264.
[6] SHI X L, CUI F, HAN X Y, et al .. Comparative genomic and transcriptomic analyses uncover the molecular basis of high nitrogen-use efficiency in the wheat cultivar Kenong 9204 [J].Mol. Plant, 2022,15(9):1440-1456.
[7] ZHOU Z H, WANG C K, ZHENG M H, et al .. Patterns and mechanisms of responses by soil microbial communities to nitrogen addition [J]. Soil Biol. Biochem., 2017,115:433-441.
[8] LUO L, RAN L, RASOOL Q Z, et al .. Integrated modeling of U.S. agricultural soil emissions of reactive nitrogen and associated impacts on air pollution, health, and climate [J].Environ. Sci. Technol., 2022,56(13):9265-9276.
[9] LIU Q, CHEN X B, WU K, et al .. Nitrogen signaling and use efficiency in plants: what’s new? [J]. Curr. Opin. Plant Biol.,2015,27:192-198.
[10] WANG G, WANG J, YAO L, et al .. Transcriptome and metabolome reveal the molecular mechanism of barley genotypes underlying the response to low nitrogen and resupply [J/OL]. Int. J. Mol. Sci., 2023,24(5):4706 [2024-02-20]. https://doi.org/10.3390/ijms24054706.
[11] SCHEURWATER I, KOREN M, LAMBERS H, et al .. The contribution of roots and shoots to whole plant nitrate reduction in fastand slowgrowing grass species [J]. J.Exp.Bot., 2002, 53(374):1635-1642.
[12] MIFLIN B J. Distribution of nitrate and nitrite reductase in barley [J]. Nature, 1967,214:1133-1134.
[13] NAWAZ M A, WANG L M, JIAO Y Y, et al .. Pumpkin rootstock improves nitrogen use efficiency of watermelon scion by enhancing nutrient uptake,cytokinin content,and expression of nitrate reductase genes [J]. Plant Growth Regul., 2017,82(2):233-246.
[14] LUO J, LI H, LIU T X, et al .. Nitrogen metabolism of two contrasting poplar species during acclimation to limiting nitrogen availability [J]. J. Exp. Bot., 2013,64(14):4207-4224.
[15] SAENGWILAI P, TIAN X L, LYNCH J P. Low crown root number enhances nitrogen acquisition from low-nitrogen soils in maize [J]. Plant Physiol., 2014,166(2):581-589.
[16] WEI S S, WANG X Y, SHI D Y, et al .. The mechanisms of low nitrogen induced weakened photosynthesis in summer maize (Zea mays L.) under field conditions [J]. Plant Physiol.Biochem., 2016,105:118-128.
[17] HE L, TENG L, TANG X,et al .. Agro-morphological and metabolomics analysis of low nitrogen stress response in Axonopus compressus [J/OL]. Aob Plants, 2021,13(4):plab022[2024-02-20] . https://doi.org/10.1093/aobpla/plab022.
[18] 董玥,陈雪平,赵建军,等.低氮胁迫不同氮效率基因型茄子光合特性差异[J].华北农学报,2009,24(1):181-184.
DONG Y, CHEN X P, ZHAO J J, et al .. Differences of photosynthetic characteristics in the nitrogen efficiency genotypes of eggplant under low nitrogen stress [J]. Acta Agric.Boreali-Sin., 2009,24(1):181-184.
[19] 李强,罗延宏,余东海,等.低氮胁迫对耐低氮玉米品种苗期光合及叶绿素荧光特性的影响[J]. 植物营养与肥料学报,2015,21(5):1132-1141.
LI Q, LUO Y H, YU D H, et al .. Effects of low nitrogen stress on photosynthetic characteristics and chlorophyll fluorescence parameters of maize cultivars tolerant to low nitrogen stress at the seedling stage [J]. J. Plant Nutr. Fert., 2015,21(5):1132-1141.
[20] LI L, GAO W, PENG Q,et al .. Two soybean bHLH factors regulate response to iron deficiency [J]. J. Integr. Plant Biol.,2018,60(7):608-622.
[21] ZHANG C, HOU Y, HAO Q, et al .. Genome-wide survey of the soybean GATA transcription factor gene family and expression analysis under low nitrogen stress [J/OL]. PLoS One, 2015,10(4):e0125174 [2024-02-20]. https://doi.org/10.1371/journal.pone.0125174.
[22] QU B Y, HE X, WANG J, et al .. A wheat CCAAT box-binding transcription factor increases the grain yield of wheat with less fertilizer input [J]. Plant Physiol., 2015,167(2):411-423.
[23] TANG Y T, LI X, LU W, et al .. Enhanced photorespiration in transgenic rice over-expressing maize C4 phosphoenolpyruvate carboxylase gene contributes to alleviating low nitrogen stress [J].Plant Physiol. Biochem., 2018,130:577-588.
[24] 肖燕,姚珺玥,刘冬,等.甘蓝型油菜响应低氮胁迫的表达谱分析[J].作物学报,2020,46(10):1526-1538.
XIAO Y, YAO J Y, LIU D, et al .. Expression profile analysis of low nitrogen stress in Brassica napus [J]. Acta Agron. Sin.,2020,46(10):1526-1538.
[25] YAN H, SHI H, HU C, et al .. Transcriptome differences in response mechanisms to low-nitrogen stress in two wheat varieties [J/OL]. Int. J. Mol. Sci., 2021,22(22):12278 [2024-02-20]. https://doi.org/10.3390/ijms222212278.
[26] WANG W, XIN W, CHEN N,et al .. Transcriptome and coexpression network analysis reveals the molecular mechanism of rice root systems in response to low-nitrogen conditions [J/OL].Int. J. Mol. Sci., 2023,24(6):5290 [2024-02-20]. https://doi.org/10.3390/ijms24065290.
[27] ALKHADER A M F, QARYOUTI M M, OKASHA T M. Effect of nitrogen on yield, quality, and irrigation water use efficiency of drip fertigated grafted watermelon (Citrullus lanatus) grown on a calcareous soil [J]. J. Plant Nutr., 2019,42(2):1-12.
[28] 杜少平,马忠明,唐超男,等. 基于SPAD的西瓜氮素营养诊断与推荐施肥技术研究 [J]. 中国土壤与肥料, 2023 (12):200-209.
DU S P, MA Z M, TANG C N, et al.. Study on nitrogen nutrition diagnosis and fertilizer recommendation of watermelon based on SPAD value [J]. Soil Fert. Sci. China, 2023 (12):200-209.
[29] 张婷婷,孟丽丽,刘晓蕊,等.马铃薯氮代谢对低氮胁迫的响应及转录组分析[J].西北农林科技大学学报(自然科学版),2022,50(8):15-26.
ZHANG T T,MENG L L,LIU X R,et al.. Response of nitrogen metabolism of potato to low nitrogen stress and transcriptome analysis [J]. J. Northwest A&F Univ. (Nat. Sci.), 2022,50(8):15-26.
[30] HE X, QU B Y, LI W J,et al .. The nitrate-inducible NAC transcription factor TaNAC2-5A controls nitrate response and increases wheat yield [J]. Plant Physiol., 2015, 169(3): 1991-2005.
[31] WANG Y, ZHAO Y, WANG S,et al .. Up-regulated 2-alkenal reductase expression improves low-nitrogen tolerance in maize by alleviating oxidative stress [J]. Plant Cell Environ., 2021,44(2):559-573.
