基于网络药理学探讨寒湿阻肺证防疫药茶方对新型冠状病毒肺炎的作用机制
2024-12-31夏欣田郑文江王士超


【摘要】目的 基于网络药理学探讨寒湿阻肺证防疫药茶方对新型冠状病毒肺炎(COVID-19)的作用机制,为临床诊疗提供参考。方法 利用中药系统药理学数据库与分析平台(TCMSP)、PubChem数据库筛选寒湿阻肺证防疫药茶方的潜在活性成分[生物利用度(OB)≥30%,类药性(DL)≥0.18];利用Swiss数据库预测防疫药茶方作用靶点;利用Cytoscape软件构建“药物活性化合物-潜在作用靶点”网络;String数据库、Cytoscape软件构建蛋白质相互作用(PPI)网络;利用R包和ClusterProfiler数据包对共同靶点进行GO富集分析;利用Cytoscape软件对共同靶点进行京都基因与基因组百科全书(KEGG)富集分析。结果 10个药物活性成分“degree”值gt;30,分别为柳穿鱼黄素(pectolinarigenin)、芫花素(genkwanin)、5-羟基-7,4'-二甲氧基黄酮(5-hydroxy-7,4'-dimethoxyflavanon)、香叶木素(diosmetin)、汉黄芩素(wogonin)、槲皮素(quercetin)、山柰酚(kaempferol)、黄酮醇(pachypodol)、木犀草素(luteolin)、草质素(herbacetin)。可能成为潜在治疗靶点的蛋白包括激肽原1(KNG1)、表皮生长因子(EGF)R、半胱氨酸-天冬氨酸蛋白酶(CASP3)、髓过氧化物酶(MPO)。防疫药茶方可能通过多个生物学过程发挥治疗作用。结论 本研究运用网络药理学方法,对寒湿阻肺证防疫药茶方的活性成分及作用靶点进行检索、筛选及富集分析,推测其治疗的活性成分可能为genkwanin、quercetin、diosmetin、kaempferol、wogonin、luteolin,潜在治疗靶点可能为KNG1、EGFR、CASP3、MPO,通过调控花生四烯酸代谢、血小板活化、磷脂酶D等信号通路,抑制炎症反应、调节机体免疫功能等,这可能是寒湿阻肺证防疫药茶方治疗COVID-19的重要机制。
【关键词】网络药理学;防疫药茶方;新型冠状病毒肺炎
【中图分类号】R563.1 【文献标识码】A 【文章编号】2096-2665.2024.23.0112.06
DOI:10.3969/j.issn.2096-2665.2024.23.034
近年来,中医药在新突发传染病的防治中取得显著的临床效果[1]。早期临床针对新型冠状病毒肺炎(corona virus disease 2019, COVID-19)的治疗没有特效药物[2-4]。诊疗方案中各证型对应的中医辨证处方,在临床中得以广泛应用。目前尚未有临床研究深入探讨寒湿阻肺证防疫药茶方治疗COVID-19的药理机制。有研究表明,中西医结合治疗方案在COVID-19死亡率等方面具有明显优势,其可改善普通型COVID-19患者的临床症状[5]。中药复方可通过多靶标、多成分对机体发挥调控作用,网络药理学是目前研究中药复方发挥药物作用机制的有效方法[6]。本研究基于网络药理学方法探索寒湿阻肺证防疫药茶方治疗COVID-19的有效成分及作用机制,通过数据库搜索收集寒湿阻肺证防疫药茶方包含的化合物及其对应靶点,构建和分析靶点网络,明确相关靶点及子模块,对重要靶点和子模块进行功能富集,探索其与COVID-19的关联因素,为中医药治疗COVID-19挖掘更加科学的理论依据。
1 资料与方法
1.1 寒湿阻肺证防疫药茶方的潜在活性成分 利用中药系统药理学数据库与分析平台(TCMSP)数据库(http://lsp.nwu.edu.cn/tcmsp.php)检索寒湿阻肺证防疫药茶方的中药化学成分;利用PubChem数据库获取上述检索结果中化学成分的分子结构,保存为Canonical SMILES格式,筛选寒湿阻肺证防疫药茶方的潜在活性成分,条件为生物利用度(OB)≥30%、类药性(DL)≥0.18。参考药物代谢动力学(ADME)评估寒湿阻肺证防疫药茶方的中药成分对机体的影响[7]。
1.2 预测寒湿阻肺证防疫药茶方作用靶点 将上述的Canonical SMILES格式文件导入Swiss数据库(http:// www.swisstargetprediction.ch/),将研究物种设定为“人类”,获取相关化合物的作用靶点,保存为csv格式,通过整合、去重得到寒湿阻肺证防疫药茶方的潜在作用靶点。
1.3 构建“活性化合物-潜在作用靶点”网络 有研究报道, 新型冠状病毒通过刺突蛋白与人肾素和血管紧张素转化酶2(ACE2)相互作用,从而导致COVID-19的发生[8]。因此,本研究根据结肠上皮细胞单细胞测序结果,提取与ACE2共表达的基因,对原始文件的基因名进行标准化转换,匹配与人类相关靶点。与上述寒湿阻肺证防疫药茶方潜在作用靶点相映射,获得寒湿阻肺证防疫药茶方治疗COVID-19的潜在靶点。将上述得到的活性化合物和潜在作用靶点导入Cytoscape软件,构建“活性化合物-潜在作用靶点”网络。
1.4 构建蛋白质相互作用(PPI)网络 将上述的潜在作用靶点导入String数据库(http://stringdb.org/),物种设定为“人类”,对靶点进行蛋白间相互作用(PPI)分析,将所得结果导入Cytoscape软件中的插件Cytohubba进行网络拓扑分析,使用Cytoscape软件进行可视化处理。
1.5 靶点的生物功能及通路富集分析 利用R包和ClusterProfiler数据包对得到的共同靶点进行GO富集分析;利用Cytoscape软件中的ClueGO和CluePedia插件对得到的共同靶点进行京都基因与基因组百科全书(KEGG)富集分析,保留结果P≤0.05的数据,获取GO柱状图及KEGG信号通路柱状图,使用Cytoscape软件绘制靶点-信号通路网络图,挖掘靶点和信号通路在寒湿阻肺证防疫药茶方与COVID-19间的关联因素,探讨寒湿阻肺证防疫药茶方治疗的作用机制。
2 结果
2.1 寒湿阻肺证防疫药茶方的潜在活性成分结果 TCMSP数据库筛选到70个寒湿阻肺证防疫药茶方的潜在活性成分。
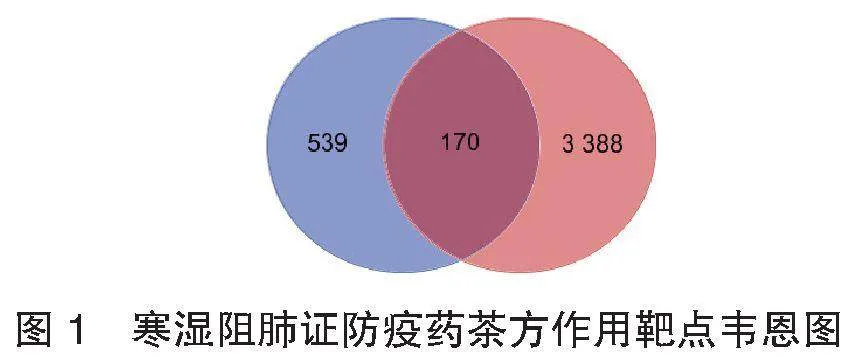
2.2 寒湿阻肺证防疫药茶方作用靶点预测结果 利用Swiss 数据库对上述70个寒湿阻肺证防疫药茶方的活性成分的潜在靶点进行预测。其中50个化合物可测得靶点,共计539个潜在作用靶点。根据结肠上皮细胞单细胞测序结果,识别到5 556个与ACE2共表达的基因,对原始文件的基因名进行标准化转换,匹配人类相关靶点的基因共计3 388个。绘制成分靶点(539个)与疾病靶点(3 388个)韦恩图,得到170个重合靶点,见图1。上述结果提示寒湿阻肺证防疫药茶方机体可通过多成分发挥调控作用。
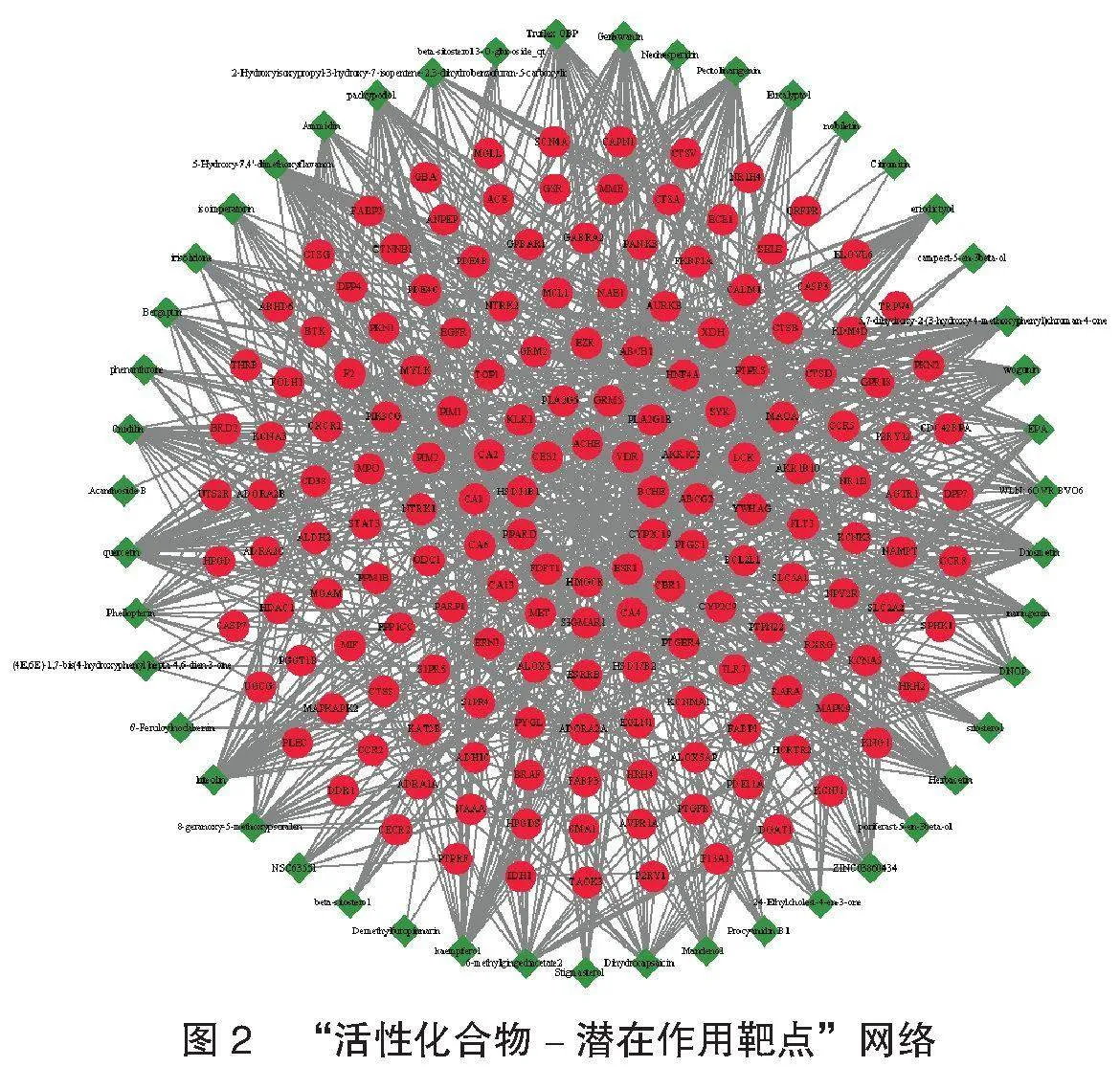
2.3 “活性化合物-潜在作用靶点”网络的构建与分析 “活性化合物-潜在作用靶点”网络,见图2。共10个药物活性成分“degree”值gt;30,分别为柳穿鱼黄素(pectolinarigenin)、芫花素(genkwanin)、 5-羟基-7,4'-二甲氧基黄酮(5-hydroxy-7,4'-dimethoxyflavanon)、香叶木素(diosmetin)、汉黄芩素(wogonin)、槲皮素(quercetin)、山柰酚(kaempferol)、黄酮醇(pachypodol)、木犀草素(luteolin)、草质素(herbacetin)。
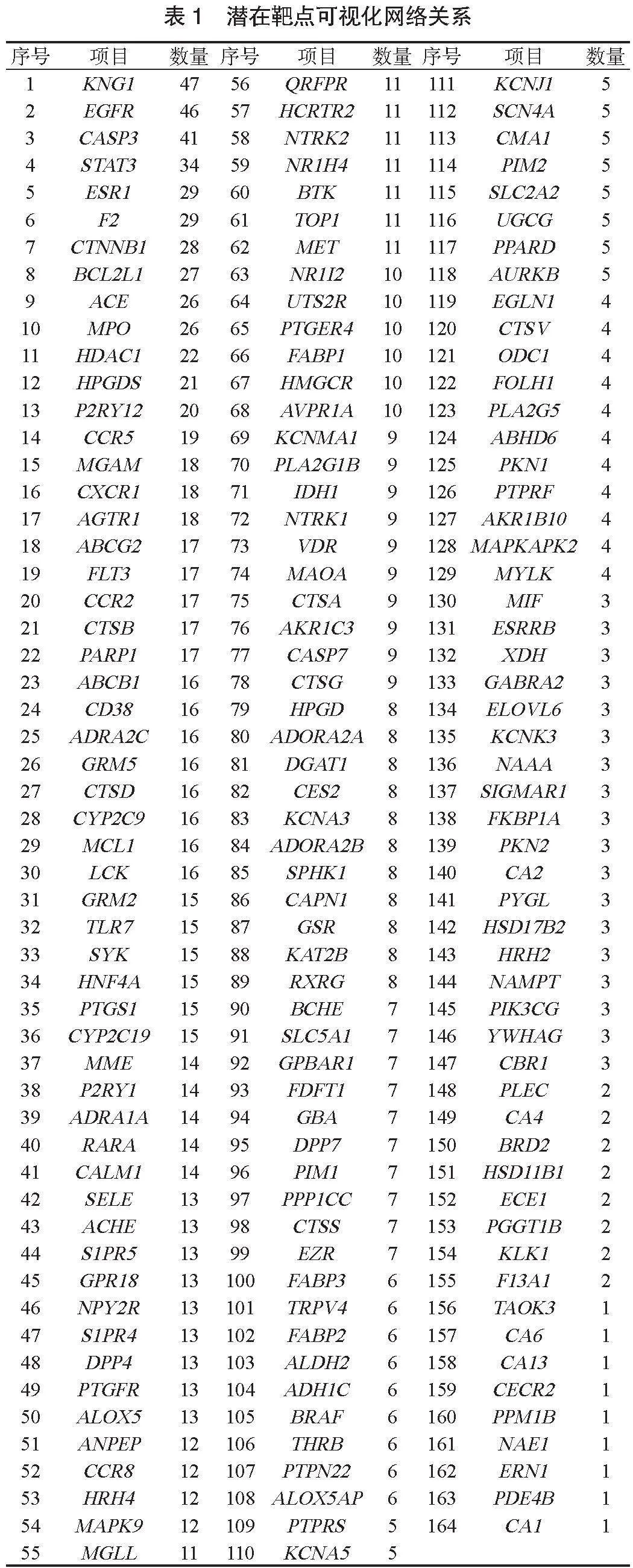
2.3 PPI网络构建与分析 潜在靶点PPI网络,见图3。潜在靶点可视化网络关系,见表1。 170个潜在治疗靶点中,可能成为潜在治疗靶点的蛋白包括激肽原1(KNG1)、表皮生长因子(EGF)R、半胱氨酸-天冬氨酸蛋白酶(CASP3)、髓过氧化物酶(MPO)。
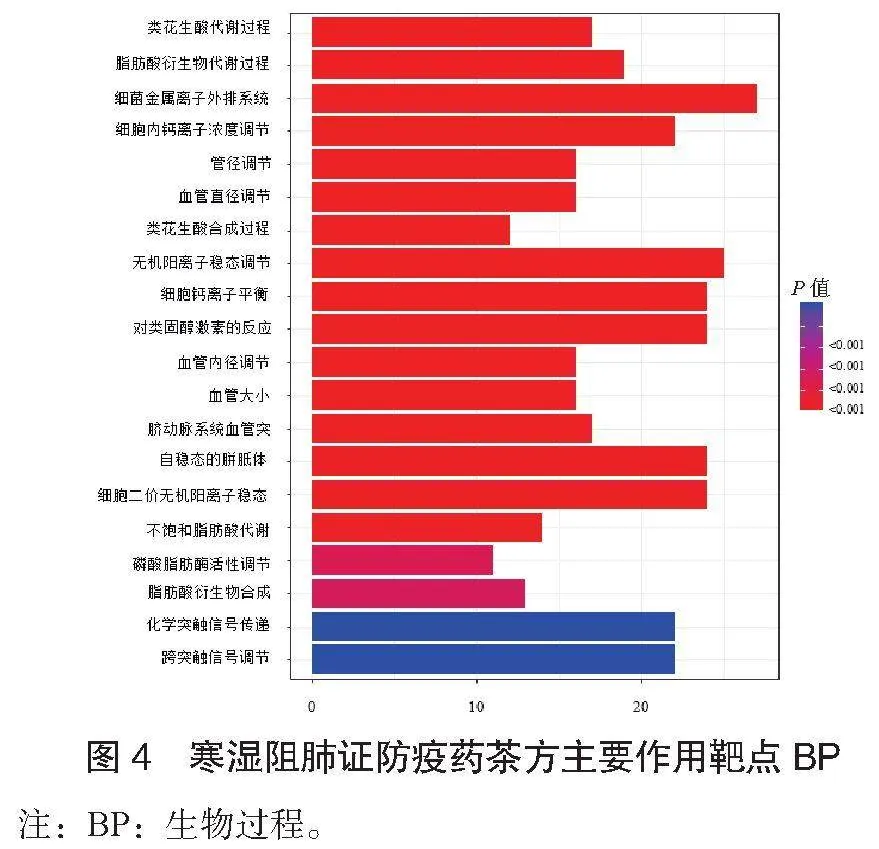
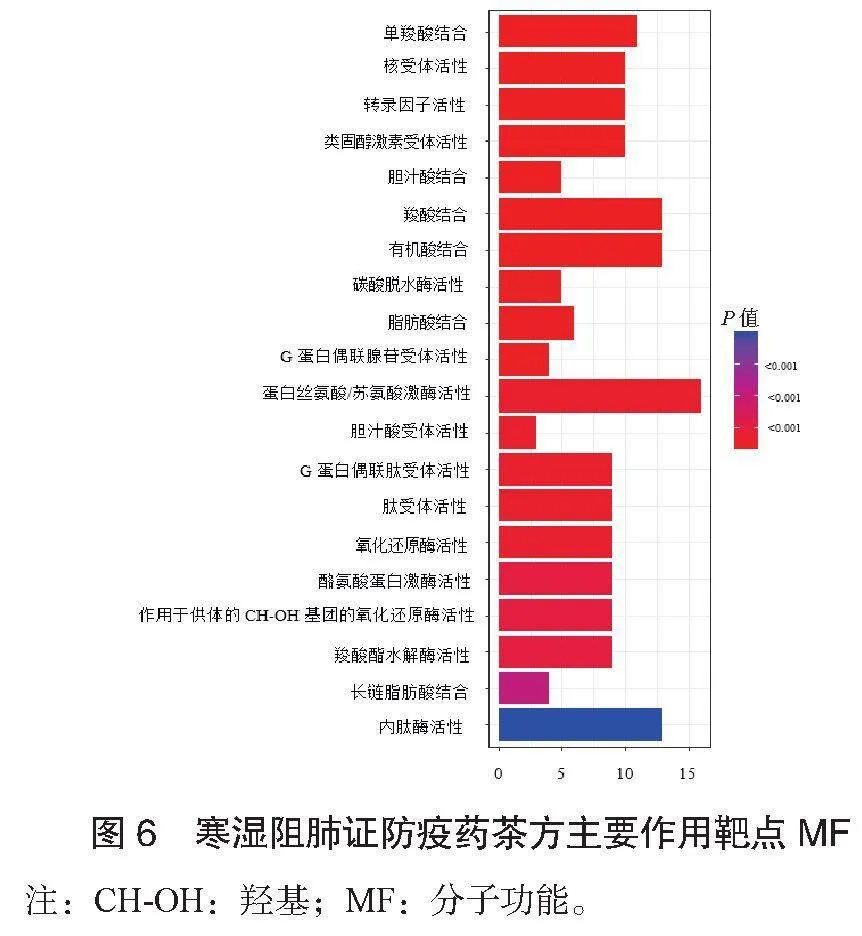
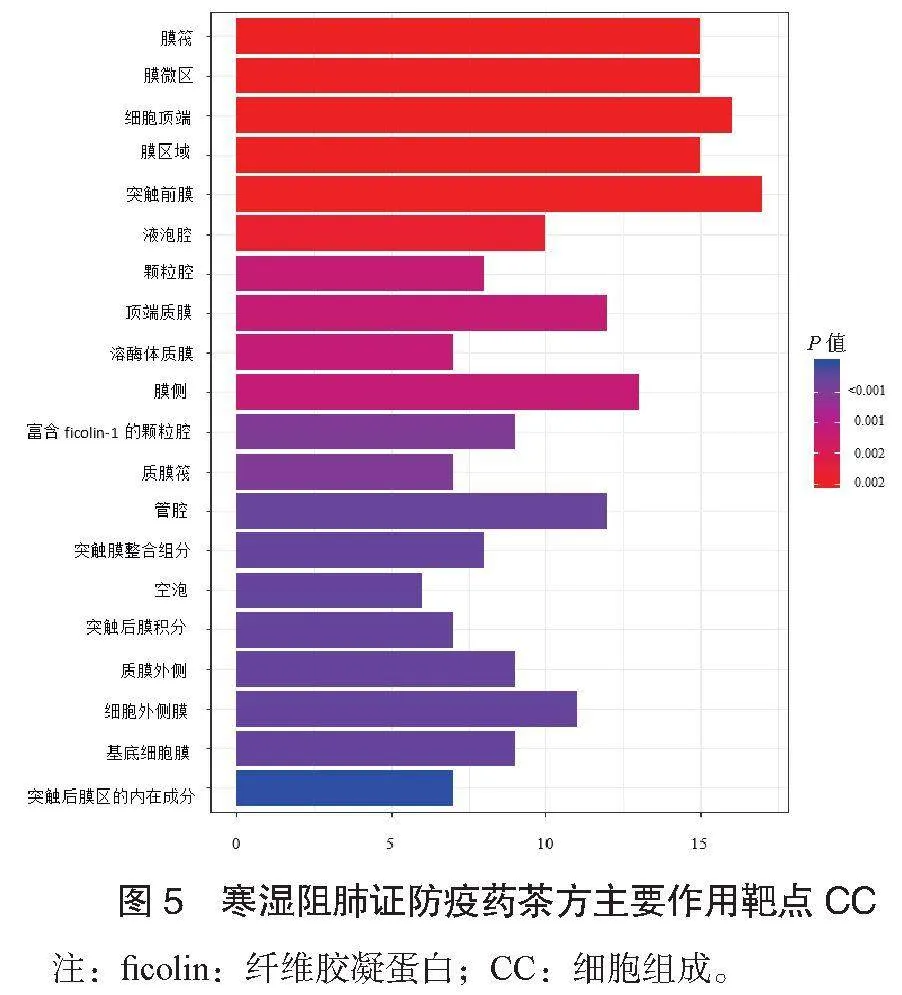
2.4 GO富集分析结果 对共同靶点进行GO富集分析,选择结果P≤0.05的数据,对前20个条目结果进行可视化分析。寒湿阻肺证防疫药茶方主要作用靶点生物过程(BP),见图4;寒湿阻肺证防疫药茶方主要作用靶点细胞组成(CC),见图5;寒湿阻肺证防疫药茶方主要作用靶点分子功能(MF),见图6。提示寒湿阻肺证防疫药茶方可能通过多个生物学过程发挥治疗作用。
2.6 KEGG富集结果分析 对共同靶点进行KEGG富集分析,选择结果P≤0.05的数据,进行可视化分析,获取寒湿阻肺证防疫药茶方主要作用靶点KEGG富集,见图7。上述结果提示寒湿阻肺证防疫药茶方的活性成分靶点存在于多个通路中,且通路间可协同发挥治疗作用。
3 讨论
目前,临床研究证实,在改善COVID-19患者临床症状、缩短平均住院天数方面,中西医结合治疗具有显著优势,早期进行中医干预可减少普通型向重型及危重型的转化[9]。诊疗方案中各证型对应的中医辨证处方在临床中均得到广泛应用。目前,尚无临床研究深入探讨寒湿阻肺证防疫药茶方治疗COVID-19的药理机制。本研究选用TCMSP数据库对寒湿阻肺证防疫药茶方的相关活性成分进行筛选,采用Swiss数据库对寒湿阻肺证防疫药茶方的潜在作用进行预测,利用Cytoscape软件对寒湿阻肺证防疫药茶方的“药物活性化合物-潜在作用靶点”进行网络构建,对得到的共同靶点进行基因本GO和KEGG富集分析,构建靶点-信号通路网络图,进而挖掘寒湿阻肺证防疫药茶方的活性化学成分、潜在作用靶点及信号调节通路。
通过寒湿阻肺证防疫药茶方-活性化合物-潜在作用靶点网络分析推测pectolinarigenin、genkwanin、5-hydroxy-7,4'-dimethoxyflavanon、 diosmetin、wogonin、quercetin、kaempferol、pachypodol、luteolin、 herbacetin这10个成分是寒湿阻肺证防疫药茶方治疗COVID-19的主要活性成分,表明黄酮类化学成分在寒湿阻肺证防疫药茶方治疗COVID-19的作用机制中具有重要意义。有研究表明,针对甲型流行性病毒诱导的急性肺损伤,汉黄芩素通过抑制补体系统的过度活化,起到一定的保护作用[10];槲皮素通过抑制核因子(NF)-κB信号通路,减少NF-κB转录因子、血管细胞黏附分子1(VCAM-1)的产生,减轻机体炎症反应,可缓解急性肺损伤[11],同时,其主要通过拮抗钙离子通道,阻止病毒受体复合物进入细胞,从而中断生活周期,起到抗病毒作用[12]。木犀草素具有缓解咳嗽、咳痰的效果,同时具有抗病毒、抗菌、抗炎、抗肿瘤、抗过敏等药理学活性[13]。山柰酚通过降低MAKP、NF-κB等通路的活性,抑制白细胞介素(IL)-10、肿瘤细胞坏死因子(TNF)-α、IL-6、IL-1β、VCAM-1等炎症因子表达水平,起到抑制炎症的作用[14]。同时,山柰酚可清除体内氧自由基,改善组织缺氧损伤,发挥抗氧化活性[15]。香叶木素可通过活化核因子E2相关因子2通路和抑制核苷酸结合寡聚化结构域样受体蛋白(NLRP3)炎症反应,减轻急性肺损伤[16]。芫花素通过调节脂多糖激活的巨噬细胞中的微小RNA(miRNA)101、MKP-1、MAPK途径抑制促炎介质的产生,发挥抗炎作用[17]。潜在治疗靶点方面,研究表明,COVID-19通过结合人ACE2感染患者[18]。
本研究结果显示,潜在治疗靶点KNG1、EGFR、CASP3、MPO均参与肺部炎症反应。雷公藤红素可通过KNG1信号转导途径减轻慢性阻塞性肺疾病的炎症反应[19]。EGFR反式激活可诱导气道上皮细胞产生黏液及促进炎性细胞因子分泌,且有研究表明,EGFR与哮喘大鼠气道炎症有关[20-21]。CASP3是细胞凋亡的标志物,过敏性气道炎症小鼠模型的研究中,槲皮素通过调节上皮来源的细胞因子和上皮细胞凋亡的过程,缓解慢性组织病理学改变,除肺组织中的基底膜厚度,其对炎症也有一定抑制作用[22]。失血性休克复苏后的大鼠,MPO活性增强,分解胞外纤维与基质,从而引起肺实质和急性肺损伤中的炎症反应,而吸入2%氢气可降低MPO活性并减少炎症细胞向肺组织的浸润,从而最大程度地减少肺部损伤程度[23]。以上均为寒湿阻肺证防疫药茶方药物活性成分及靶点在治疗COVID-19方面的潜在作用机制,但仍有部分关联性极高的靶点在既往的研究未被证实具有抗病毒、抗炎作用。例如,潜在治疗靶点ESR1,目前普遍认为雌激素的生物效应主要通过ESR1调节,ESR1与雌激素相结合可发挥抗肿瘤作用,而暂未有抗炎、肺保护方面的研究报道[24]。
GO富集分析结果提示,寒湿阻肺证防疫药茶方可能通过多个生物学过程发挥治疗作用。寒湿阻肺证防疫药茶方的潜在治疗靶点主要分布于细胞膜、神经元轴突、溶酶体腔等部位,参与细胞内金属离子稳态、细胞钙离子稳态、激素反应、脂肪酸衍生物代谢活性、不饱和脂肪酸代谢、化学突触传递的调节等生物过程,涉及离子通道调控、免疫调节等环节。相关研究表明,羟基可能通过改变细胞钙离子的稳态发挥其细胞毒性作用,使肺泡巨噬细胞产生过量活性氧自由基,从而导致氧化性肺损伤[25]。炎症通过跨细胞膜和细胞层的液体转移等而引起疾病,急性肺损伤也已经检测到离子通道的变化[26]。中性内肽酶在急性肺损伤的发病机理中起保护作用[27]。
KEGG富集分析结果提示,寒湿阻肺证防疫药茶方的活性成分靶点存在于多个通路中,且通路间可协同发挥治疗作用。与治疗具有关联性的通路中,最为核心的炎症反应通路是花生四烯酸代谢通路。既往研究发现,该通路可介导炎症因子产生,与炎症的发生发展及消退均有密切联系[28]。磷脂酶D广泛分布于哺乳动物细胞中,且受多种细胞外信号的调节,其主要底物是磷脂酰胆碱,可水解为磷脂酸和胆碱。磷脂酶D催化的磷脂酰胆碱水解被认为是细胞中信号转导的重要机制,同时有证据表明磷脂酶D与炎症具有密切联系,如炎症的增加及白细胞的趋化性与磷脂酶D1、磷脂酶D2紧密相关[29]。血小板的活化也是寒湿阻肺证防疫药茶方主要涉及的通路之一,血小板在维持凝血稳态方面起着核心作用,血小板在炎症和免疫反应中具有关键作用[30-31]。调节机体免疫功能、抑制机体炎症反应可能是寒湿阻肺证防疫药茶方治疗COVID-19的重要机制。
综上所述,本研究运用网络药理学方法,对寒湿阻肺证防疫药茶方的活性成分及作用靶点进行检索、筛选及富集分析,推测其治疗的活性成分可能为genkwanin、quercetin、diosmetin、kaempferol、wogonin、luteolin,潜在治疗靶点可能为KNG1、EGFR、CASP3、MPO,通过调控花生四烯酸代谢、血小板活化、磷脂酶D等信号通路,抑制炎症反应、调节机体免疫功能等,这可能是寒湿阻肺证防疫药茶方治疗COVID-19的重要机制。
参考文献
ZHANG M M, LIU X M, HE L. Effect of integrated traditional Chinese and western medicine on SARS: A review of clinical evidence[J]. World J Gastroenterol, 2004, 10(23): 3500-3505.
CHAN J F, YUAN A F, KOK K H, et al.A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: A study of a family cluster[J]. Lancet, 395(10223): 514-523.
PHAN L T, NGUYEN T V, LUONG Q C, et al. Importation and human-to-human transmission of a novel coronavirus in vietnam[J].N Engl J Med, 2020, 382(9): 872-874.
WANG D W, HU B, HU C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA, 2020, 323(11): 1061-1069.
LI N, ZHOU L, ZHOU M, et al. Combination of western medicine and Chinese traditional patent medicine in treating a family case of COVID-19[J]. Front Med, 2020, 14(2): 210-214.
HOPKINS A L. Network pharmacology: The next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4(11), 682-690.
ZHAO J, WU Q L, ZENG H W, et al. Computational systems pharmacology reveals an antiplatelet and neuroprotective mechanism of Deng-Zhan-Xi-Xin injection in the treatment of ischemic stroke[J].Pharmacol Res, 2019, 147: 104365.
LIU J L, PEI T L, MU J X, et al. Systems pharmacology uncovers the multiple mechanisms of Xijiao Dihuang decoction for the treatment of viral hemorrhagic fever[J]. Evid Based Complement Alternat Med, 2016: 9025036.
WANG N, ZHENG Y F, GU J Y, et al. Network-pharmacology-based validation of TAMS/CXCL-1 as key mediator of XIAOPI formula preventing breast cancer development and metastasis[J]. Sci Rep, 2017, 7(1): 14513.
CHAN K W, WONG V T, TANG S C W. COVID-19: An update on the epidemiological, clinical, preventive and therapeutic evidence and guidelines of integrative Chinese-Western medicine for the management of 2019 novel coronavirus disease[J]. Am J Chin Med, 2020, 48(3): 737-762.
ZHI H J, JIN X, ZHU H Y, et al. Exploring the effective materials of flavonoids-enriched extract from scutellaria baicalensis roots based on the metabolic activation in influenza a virus induced acute lung injury[J]. J Pharm Biomed Anal, 2020, 177: 112876.
WANG L, CHEN J M, WANG B, et al. Protective effects of intratracheally administered quercetin on lipopolysaccharide-induced acute lung injury[J]. Exp Biol Med (Maywood), 2014, 239(12): 1653-1662.
WU S N, CHIANG H T, SHEN A Y, et al. Differential effects of quercetin, a natural polyphenolic flavonoid, on L-type calcium current in pituitary tumor (GH3) cells and neuronal NG108-15 cells[J]. J Cell Physiol, 2003, 195(2): 298-308.
BIRT D F, HENDRICH S, WANG W. Dietary agents in cancer prevention: Flavonoids and Isoflavonoids[J]. Pharmacol Ther, 2001, 90(2-3): 157-177.
IMRAN M, RAUF A, SHAH Z A, et al. Chemo-preventive and therapeutic effect of the dietary flavonoid kaempferol: A comprehensive review[J]. 2019, 33(2): 263-275.
DONG X X, FU J, YIN X B, et al. Emodin: A review of its pharmacology, toxicity and pharmacokinetics[J]. Phytother Res, 2016, 30(8): 1207-1218.
LIU Q M, CI X X, WEN Z M, et al. Diosmetin alleviates lipopolysaccharide-induced acute lung injury through activating the Nrf2 pathway and inhibiting the NLRP3 inflammasome[J]. Biomol Ther (Seoul), 2018, 26(2): 157-166.
GAO Y, LIU F, FANG L, et al. Genkwanin inhibits proinflammatory mediators mainly through the regulation of miR-101/MKP-1/MAPK pathway in LPS-activated macrophages[J]. PLoS One, 2014, 9(5): e96741.
孙美丽,杨建民,孙玉萍,等. RAS抑制剂是治疗新型冠状病毒肺炎的可能选择之一[J].中华结核和呼吸杂志, 2020, 43(3): 219-222.
SHI K, CHEN X, XIE B, et al. Celastrol alleviates chronic obstructive pulmonary disease by inhibiting cellular inflammation induced by cigarette smoke via the Ednrb/KNG1 signaling pathway[J]. Front Pharmacol, 2018, 9: 1276.
SHINO S, KUMIKO T-Y, TAKAO O, et al. The epidermal growth factor receptor inhibitor AG1478 inhibits eosinophilic inflammation in upper airways[J]. Clin Immunol, 2018, 188: 1-6.
龙怀聪,王曾礼,肖邦榕,等.表皮生长因子受体对支气管哮喘大鼠气道炎症的影响[J].中华结核和呼吸杂志, 2009, 32(7): 517-521.
SOZMEN S C, KARAMAN M, MICILI S C, et al. Effects of quercetin treatment on epithelium-derived cytokines and epithelial cell apoptosis in allergic airway inflammation mice model[J]. Iran J Allergy Asthma Immunol, 2016, 15(6): 487-497.
MOON D H, KANG D Y, HAAM S J, et al. Hydrogen gas inhalation ameliorates lung injury after hemorrhagic shock and resuscitation[J]. J Thorac Dis, 2019, 11(4): 1519-1527.
LEI J T, GOU X X, SEKER S, et al. ESR1 alterations and metastasis in estrogen receptor positive breast cancer[J]. J Cancer Metastasis Treat, 2019, 5: 38.
ROJANASAKUL Y, WANG L, HOFFMAN A H, et al. Mechanisms of hydroxyl free radical-induced cellular injury and calcium overloading in alveolar macrophages[J]. Am J Respir Cell Mol Biol, 1993, 8(4): 377-383.
EISENHUT M, WALLACE H. Ion channels in inflammation[J]. Pflugers Arch, 2011, 461(4): 401-421.
HASHIMOTO S, AMAYA F, KENTARO O H, et al. Expression of neutral endopeptidase activity during clinical and experimental acute lung injury[J]. 2010,11(1): 164.
SALA A, PROSCHAK E, STEINHILBER, et al. Two-pronged approach to anti-inflammatory therapy through the modulation of the arachidonic acid cascade[J]. Biochem Pharmacol, 2018, 158: 161-173.
JULIAN G C. New concepts in phospholipase D signaling in inflammation and cancer[J]. Scientific World Journal, 2010, 10: 1356-1369.
STOPPELAAR S F D, VEER C V, TOM V D P. The role of platelets in sepsis[J]. Thromb Haemost, 2014, 112(4): 666-677.
