度普利尤单抗联合他克莫司软膏治疗特应性皮炎的效果
2024-12-31唐真真

【摘要】目的 探究度普利尤单抗联合他克莫司软膏治疗特应性皮炎(AD)的效果,为临床治疗提供参考。方法 研究对象选取兰陵县人民医院2020年5月至2023年5月期间收治的82例AD患者,按随机数字表法分为对照组和观察组,各41例。对照组患者采用他克莫司软膏治疗,观察组患者采用度普利尤单抗联合他克莫司软膏治疗。比较两组患者临床疗效、皮肤症状评分、特应性皮炎积分(SCORAD)评分、经皮失水量及不良反应发生情况。结果 观察组患者临床疗效优于对照组,治疗总有效率高于对照组(均Plt;0.05)。治疗后,两组患者瘙痒、疼痛、红斑、皮肤萎缩的皮肤症状评分及SCORAD评分均降低,且观察组均低于对照组;两组患者经皮失水量均减少,且观察组少于对照组(均Plt;0.05)。结论 治疗特应性皮炎患者,度普利尤单抗联合他克莫司软膏效果更好,能有效减轻临床症状,促进皮肤修复,安全性更高,值得临床应用。
【关键词】度普利尤单抗;他克莫司软膏;特应性皮炎;皮肤修复
【中图分类号】R756 【文献标识码】A 【文章编号】2096-2665.2024.23.0043.03
DOI:10.3969/j.issn.2096-2665.2024.23.013
特应性皮炎(atopic dermatitis, AD)是临床常见的慢性皮肤病,以皮肤干燥、剧烈瘙痒及皮疹为主要症状,该病受遗传、环境、不良情绪、免疫功能障碍、皮肤屏障功能受损等多种因素影响,易反复发作,严重影响患者的身心健康和日常生活[1-2]。目前,临床常采用免疫抑制剂、抗生素等治疗该疾病。作为钙磷酸酶调节剂,他克莫司是一种非皮质醇类免疫抑制剂,能与细胞性蛋白质结合形成复合物,从而起到阻止T细胞钙离子通道依赖和抑制T细胞增殖的作用,其还可与细胞性蛋白质FKBP-12结合,达到抑制机体炎症反应、减轻皮肤症状的作用[3-4]。度普利尤单抗是针对炎性因子受体的单克隆抗体,其药理作用在于阻断炎性因子介导的淋巴细胞增殖活化,抑制炎症反应,减少炎症对皮肤组织的不良刺激,从而有效缓解皮肤干燥和瘙痒等症状[5]。基于此,本研究探究度普利尤单抗联合他克莫司软膏治疗AD的效果,现报道如下。
1 资料与方法
1.1 一般资料 研究对象选取兰陵县人民医院2020年5月至2023年5月期间收治的82例AD患者,按随机数字表法分为对照组和观察组,各41例。对照组患者中男性19例,女性22例;年龄20~55岁,平均年龄(33.18±3.42)岁。观察组患者中男性20例,女性21例;年龄21~55岁,平均年龄(33.75±3.27)岁。两组患者一般资料比较,差异无统计学意义(Pgt;0.05),组间具有可比性。本研究经兰陵县人民医院医学伦理委员会批准,患者及家属均对本研究知情并签署知情同意书。纳入标准:⑴符合特应性皮炎的诊断标准[6],且经临床检查确诊;⑵入组前未接受过抗生素、免疫抑制剂等相关治疗;⑶精神状态稳定,能正常沟通交流。排除标准:⑴妊娠期或哺乳期妇女;⑵合并其他皮肤损伤疾病者;⑶合并严重心脏病者;⑷对本研究所用药物过敏者。
1.2 治疗方法 对照组患者采用他克莫司软膏(Astellas Pharma Tech Co., Ltd. Toyama Technology Center,国药准字J20140148,规格:10 g∶10 mg)治疗,清洁患处皮肤表面后,轻薄涂于患处, 2次/d。观察组患者在对照组基础上联合度普利尤单抗(Sanofi Winthrop Industrie,批准文号S20200017,规格:300 mg/支)治疗,皮下注射,初始剂量为600 mg(300 mg连续注射2次),后每2周注射1次, 300 mg/次。两组患者均连续治疗1个月。
1.3 观察指标 ⑴临床疗效。包括治愈(疗效指数[7]gt;90%,瘙痒、疼痛、红斑、皮肤萎缩等皮损症状消失)、显效(疗效指数gt;60%~90%,皮损症状明显改善)、有效(疗效指数gt;20%~60%,皮损症状有所好转)、无效(疗效指数≤20%,皮损症状无改善甚至加重)。治疗总有效率=[(治愈+显效+有效)例数]/总例数×100%。⑵皮肤症状评分。于治疗前及治疗后,对两组患者皮肤各项症状进行评估,包含瘙痒、疼痛、红斑、皮肤萎缩,各项评分总分0~3分,分值越高提示患者皮肤症状越严重[8]。⑶特应性皮炎积分(SCORAD)[9]评分。于治疗前及治疗后,采用SCORAD评估患者病情严重程度, SCORAD与躯干及四肢处皮损面积、皮损严重程度及主观症状有关,满分103分,其中0~24分为轻度, 25~50分为中度, 51~103分为重度,分值越高提示患者病情越严重。⑷经皮失水量。于治疗前及治疗后,采用经皮水分流失测量仪(CK公司,型号: TM300)检测两组患者皮损处皮肤经皮失水量,评估其皮肤屏障功能改善状况。测量环境:干湿度40%~60%,温度22~25 ℃,无风,避光,每次测量应选取相同部位,连续测量3次取平均值。⑸不良反应发生情况。观察并记录两组患者治疗期间出现的不良反应,包括刺痛、烧灼感、红斑、毛囊炎。不良反应总发生率=不良反应总发生例数/总例数×100%。
1.4 统计学分析 数据处理采用SPSS 22.0统计软件。用[例(%)]表示计数资料,用χ2检验,用秩和检验比较等级资料;用(x)表示计量资料,用t检验。以Plt;0.05为差异有统计学意义。
2 结果
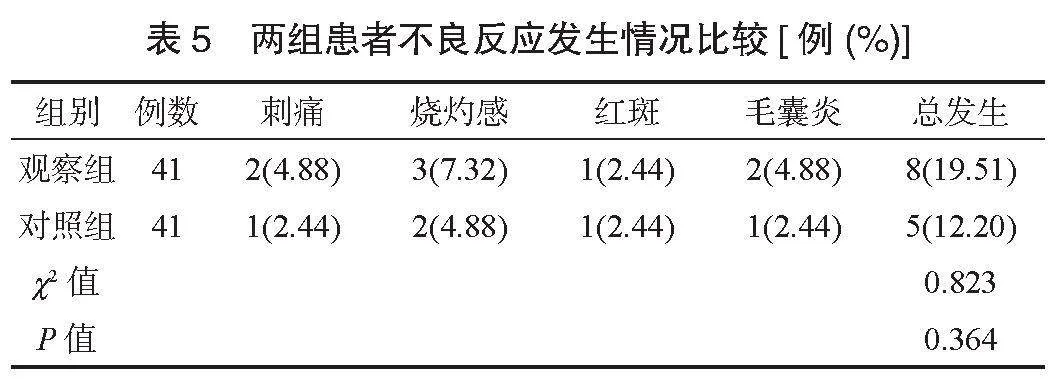
2.1 两组患者临床疗效比较 观察组患者临床疗效优于对照组,治疗总有效率高于对照组,差异均有统计学意义(均Plt;0.05),见表1。
2.2 两组患者皮肤症状评分比较 治疗后,两组患者瘙痒、疼痛、红斑、皮肤萎缩的皮肤症状评分均降低,且观察组均低于对照组,差异均有统计学意义(均Plt;0.05),见表2。
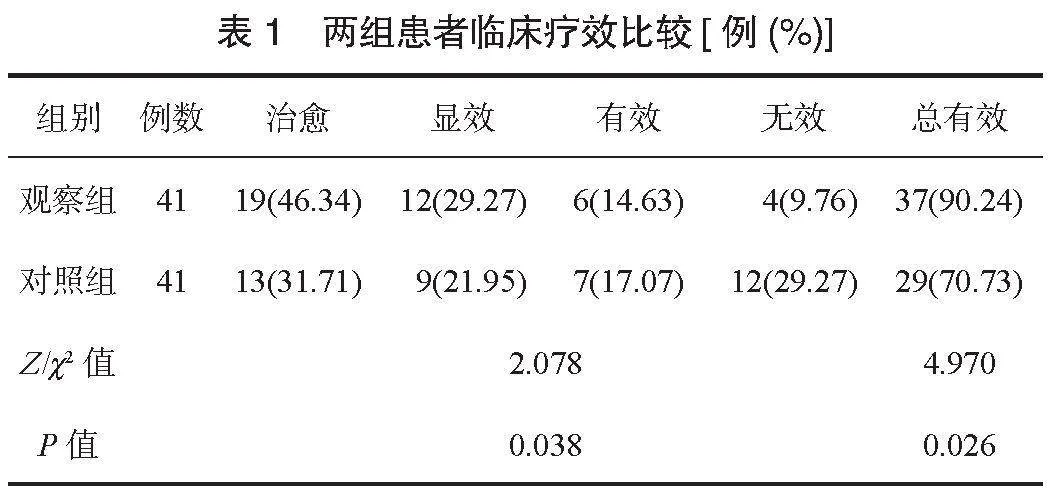
2.3 两组患者SCORAD评分比较 治疗后,两组患者SCORAD评分均降低,且观察组低于对照组,差异均有统计学意义(均Plt;0.05),见表3。
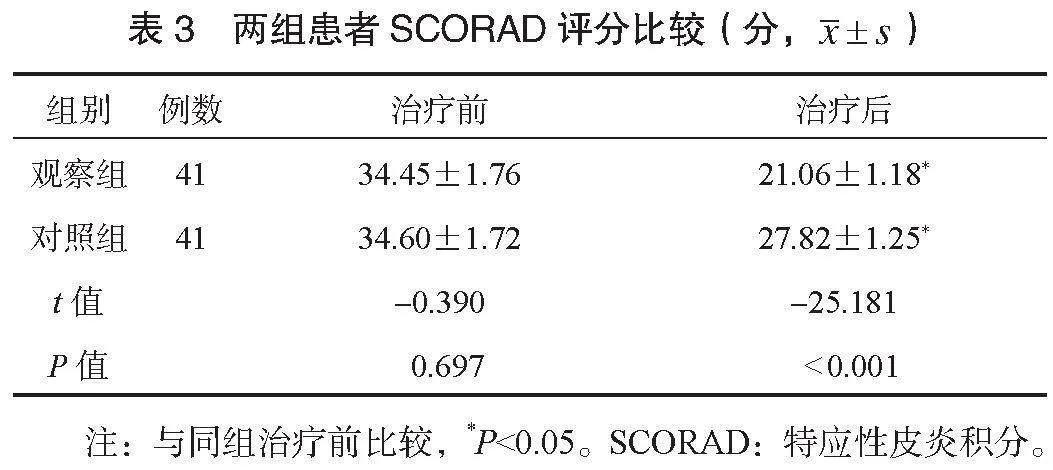
2.4 两组患者经皮失水量比较 治疗后,两组患者经皮失水量均减少,且观察组少于对照组,差异均有统计学意义(均Plt;0.05),见表4。
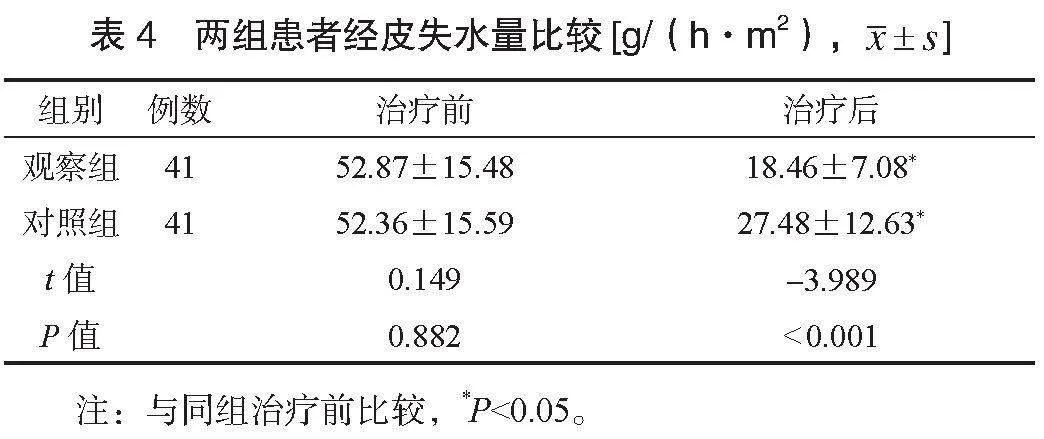
2.5 两组患者不良反应发生情况比较 两组患者不良反应总发生率比较,差异无统计学意义(Pgt;0.05),见表5。
3 讨论
特应性皮炎患者主要临床症状包括皮肤水肿、湿疹样病变、苔藓样病变等,由于皮肤屏障功能受损,易受到外界病菌或过敏原感染,进行引发炎症反应,导致病情加重[10]。该病治疗周期长,易反复发作,剧烈的瘙痒等症状给患者的日常生活带来不便,严重影响患者身心健康。临床通过药物治疗可缓解患者皮损症状,但长期用药会导致角质形成细胞减少,破坏角质层的屏障功能,临床应用受限。因此,探究治疗效果更佳且安全性更高的治疗方案对特应性皮炎患者十分重要。
本这项研究结果表明,观察组患者较对照组的临床效果更好,治疗总有效率也较对照组更高。治疗后,两组患者瘙痒、疼痛、红斑、皮肤萎缩的皮肤症状评分及SCORAD评分均降低,且观察组均低于对照组;两组患者经皮失水量均减少,且观察组少于对照组。这提示度普利尤单抗联合他克莫司软膏治疗特应性皮炎患者效果较好,可减轻皮损症状及炎症反应,促进皮肤修复。分析其原因为,2型炎症及其相关炎症因子在特应性皮炎中起关键作用,2型辅助型T细胞(Th2)及2型细胞因子是2型炎症反应的核心因素,Th2细胞刺激B细胞增殖、分化,诱导过敏反应出现;干扰素-γ(IFN-γ)可活化巨噬细胞,进而抑制病毒增殖、降低病毒感染;IL-17可促进上皮细胞、成纤维细胞等分泌炎性因子,增强机体炎症反应,特应性皮炎患者由于免疫球蛋白(Ig)E抗体合成异常,IgE分泌水平过高,抑制IFN-γ生成,降低机体免疫力,进而损伤皮肤组织、提高炎性因子水平[11]。他克莫司通过特异性地与细胞性蛋白质(FKBP12)结合,抑制钙调磷酸酶活性,减少T细胞活化因子的分泌,可有效抑制T细胞活化和增殖,从而减少IL-17、IL-13等炎性因子产生,降低炎性因子水平失衡对机体的刺激。此外,他克莫司还可减少炎性介质释放,具有较好的抗炎、抗过敏作用,可缩减红斑、皮疹面积,减少皮肤病损症状对日常生活的影响,降低疾病复发率[12]。特应性皮炎患者因皮肤屏障破坏,诱发炎症反应,外周血嗜酸性粒细胞升高,导致皮损症状加重,故改善皮肤屏障功能是治疗特应性皮炎的基础。度普利尤单抗修护生物膜作为炎症因子靶向生物制剂,可结合白细胞介素IL-4、IL-13受体,抑制炎性细胞因子进一步活化T淋巴细胞、B淋巴细胞,阻断炎症信号的传递,缓解皮肤屏障损伤,降低皮肤干燥程度,消除鳞屑、结皮对皮肤的刺激,减轻瘙痒程度,避免病菌、过敏原对皮肤的损害,减轻全身红斑、丘疹症状[13]。此外,度普利尤单抗通过使IL-4、IL-13及其受体的信号传导通路失活,可限制嗜酸性粒细胞等免疫炎症细胞的增殖活性,阻止聚丝蛋白分化下调,促进抗菌肽合成,恢复病损处皮肤的屏障保护功能,从而缓解因皮肤组织损伤导致的瘙痒等症状,提高皮肤耐受性,减轻皮损程度[14-15]。
研究结果也显示,两组患者不良反应总发生率之间不存在统计意义。分析原因为,度普利尤单抗对皮肤的刺激较轻,他克莫司不会在体内蓄积,因此产生不良反应的风险较低。二者联用可降低患者体内炎性因子水平,缓解患者皮肤瘙痒症状,还可调节机体免疫系统,避免疾病复发。
综上所述,治疗特应性皮炎患者,度普利尤单抗联合他克莫司软膏效果更好,能有效减轻临床症状,促进皮肤修复,安全性更高,值得临床应用。
参考文献
马梦茜,王清滢,李亚琴,等.特应性皮炎共病研究进展[J].中国中西医结合皮肤性病学杂志, 2023, 22(3): 291-295.
Ramírez-Marín H A, Silverberg J I. Differences between pediatric and adult atopic dermatitis[J]. Pediatr Dermatol, 2022, 39(3): 345-353.
刘茜茜,王位.针刺联合吡美莫司乳膏治疗特应性皮炎的疗效观察[J].上海针灸杂志, 2021, 40(11): 1382-1386.
于瑞星,蔡涛,郑跃,等.他克莫司软膏联合安肤舒缓精粹水治疗特应性皮炎多中心、双盲、随机对照临床疗效评估[J].中国皮肤性病学杂志, 2023, 37(6): 668-672.
Muzumdar S, Skudalski L, Sharp K. Dupilumab facial redness/dupilumab facial dermatitis: A guide for clinicians[J]. Am J Clin Dermatol, 2022, 23(1): 61-67.
中华医学会皮肤性病学分会免疫学组,特应性皮炎协作研究中心.中国特应性皮炎诊疗指南(2014版)[J].中华皮肤科杂志, 2014, 47(7): 511-514.
中华医学会皮肤性病学分会免疫学组.中国特应性皮炎诊断和治疗指南[J].中华皮肤科杂志, 2008, 41(11): 772-773.
中华中医药学会皮肤科专业委员会.特应性皮炎中医诊疗方案专家共识[J].中国中西医结合皮肤性病学杂志, 2013, 12(1): 60-61.
Barbarot S, Aubert H, Stalder J F. The patient-oriented scoring of atopic dermatitis and SCORAD in young children: New data on interpretability and clinical usefulness[J]. J Eur Acad Dermatol Venereol, 2024, 38(1): 175-181.
Chovatiya R, Paller A S. JAK inhibitors in the treatment of atopic dermatitis[J]. J Allergy Clin Immunol, 2021, 148(4): 927-940.
余昊,张伟.特应性皮炎患者血清总IgE、过敏原特异性IgE、嗜酸性粒细胞检测的临床意义[J].中国医药科学, 2018, 8(1): 136-138, 148.
Degraeve A L, Moudio S, Haufroid V. Predictors of tacrolimus pharmacokinetic variability: Current evidences and future perspectives[J]. Expert Opin Drug Metab Toxicol, 2020, 16(9): 769-782.
顾建青,高翔,孙劲旅,等.度普利尤单抗治疗中重度特应性皮炎初步临床观察[J].中华临床免疫和变态反应杂志, 2021, 15(4): 370-375.
Narla S, Silverberg J I, Simpson E L. Management of inadequate response and adverse effects to dupilumab in atopic dermatitis[J]. J Am Acad Dermatol, 2022, 86(3): 628-636.
唐帮丽,郑旭海,黄忠奎,等.度普利尤单抗辅助治疗中重度特应性皮炎的疗效及对外周血Th1/Th2细胞的调控作用[J].中国美容医学, 2022, 31(12): 77-80.
