基于16S rDNA序列的秋茄内生细菌多样性分析
2024-12-31陈维峰林文波郭萍萍张春王思凡刘芳袁宗胜

摘要:分析闽江河口湿地秋茄根、枝和叶中可培养内生细菌的多样性,为秋茄内生细菌群落结构、分布、稳定性以及功能内生细菌的研究提供支撑。从秋茄Kandelia candel不同组织中分离可培养内生细菌,基于16S rDNA基因序列比对和系统发育分析内生细菌多样性。结果表明,从秋茄3个组织中分离出36株可培养内生细菌,分属于11属22种(其中2株未被正式命名),其中芽孢杆菌属Bacillus和弧菌属Vibrio为优势菌属,分别占总株数的21.2%和19.4%。不同组织中内生细菌的分布和多样性存在差异,根中内生细菌数量最多(27株,占总株数的75%),枝次之(6株,占总株数的16.7%),叶最少(3株,占总株数的8.3%)。秋茄内生细菌具有丰富的物种多样性,不同组织之间呈现出差异性,根中内生细菌多样性为最丰富。
关键词:秋茄;内生细菌;分离;多样性
中图分类号:S345.661文献标志码:A文章编号:0253−2301(2024)10−0001−08
DOI:10.13651/j.cnki.fjnykj.2024.10.001
陈维峰,林文波,郭萍萍,等.基于16S rDNA序列的秋茄内生细菌多样性分析[J].福建农业科技,2024,55(10):01−08.
优秀学者论坛
袁宗胜,1976年生,农学博士,生物学博士后,闽江学院地理与海洋学院副教授,高级工程师,硕士生导师。主要从事微生物资源开发利用与生态环境保护研究,系统开展海岸带特殊生境微生物组与植物互作的基础研究,强化基础研究与生产实践结合,重点开展功能微生物资源在农林产业和生态环境治理上的应用研究。先后主持省市科技计划项目10余项,发表论文50余篇,出版专著1部,主持制修订地方标准5项,以第一发明人获授权国家发明专利20件。兼任福建省竹产业标准化技术委员会委员,福建省土壤与肥料标准化技术委员会委员,福州市林学会常务理事。
Diversity Analysis of Endophytic Bacteria in Kandelia candel Based on 16S rDNA Sequence
CHEN Wei-feng1,2,LIN Wen-bo3,GUO Ping-ping3,ZHANG Chun4,WANG Si-fan5,LIU Fang2,YUAN Zong-sheng1*
(1.College of Geography and Oceanography,Minjiang University,Fuzhou,Fujian 350108,China;2.College of LifeSciences,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China;3.Fujian Minjiang Estuary WetlandNational Nature Reserve Management Office,Fuzhou,Fujian 350200,China;4.Zhangzhou Forestry Science andTechnology Promotion Station,Zhangzhou,Fujian 363000,China;5.College of Future Technology,Fujian Agricultureand Forestry University,Fuzhou,Fujian 350002,China)
Abstract:The diversity of culturable endophytic bacteria in the roots,branches and leaves of Kandelia candel in the wetland of Minjiang River estuary was analyzed,in order to provide support for the study of endophytic bacteria community structure,distribution,stability and functional endophytic bacteria in Kandelia candel.In this study,the culturable endophytic bacteria were isolated from different tissues of Kandelia candel,and the diversity of endophytic bacterial was analyzed based on 16S rDNA gene sequence alignment and phylogeny.The results showed that 36 strains of culturable endophytic bacteria were isolated from three tissues of Kandelia candel,belonging to 11 genera and 22 species(2 strains among which were not officially named).Bacillus and Vibrio were the dominant genera,accounting for 21.2%and 19.4%of the total strains,respectively.There were differences in the distribution and diversity of endophytic bacteria in different tissues,among which the number of endophytic bacteria was the highest in roots(27 strains,accounting for 75%of the total number of strains),followed by branches(6 strains,accounting for 16.7%of the total number of strains),and the least in leaves(3 strains,accounting for 8.3%of the total number of strains).The endophytic bacteria in Kandelia candel had rich species diversity in the wetland of Minjiang River estuary,and there were differences among different tissues.The diversity of endophytic bacteria in the roots was the most abundant.
Key words:Kandelia candel;Endophytic bacteria;Isolation;Diversity
河口湿地是位于河流与海洋交汇处的特殊生态系统,具有丰富的生物多样性和重要的生态服务功能,在沉积物的积累、水质净化、生物多样性保护以及为人类提供资源方面发挥着重要作用[1−3]。河口湿地的植被类型多样,例如在闽江河口湿地植被类型包括秋茄、芦苇、短叶茳芏等[4−5],这些植物不仅适应了高盐度、潮汐波动和泥沙沉积的环境,形成了特殊的河口湿地植被群落为当地的野生动物提供栖息地,还有助于固土护岸,防止侵蚀。河口湿地的生态环境受到多种因素的影响,包括潮汐、沉积物类型、盐度、水文条件和人类活动等[6−7]。
秋茄Kandelia candel隶属于红树科Rhizo-phoraceae秋茄树属Kandelia,在中国主要分布在海南、广东、广西、台湾、福建、浙江等地。秋茄喜光,耐盐碱,多生长在河口湿地,是改造海涂、海滩组成红树林的主要树种之一。秋茄根际土壤环境复杂多变,涨潮落潮反复交替,其内生细菌群落更为丰富多样。内生菌在宿主植物的生长阶段中扮演了重要角色,它们与宿主植物之间形成了互惠互利的关系,对于植物的生长发育、抗逆性以及次生代谢产物的合成等方面都有着积极的影响[8−10]。此外,内生菌在环境修复领域具有广泛的应用前景,尤其是在重金属和有机污染物的修复方面展现出巨大的潜力[11−13]。例如,Yang等[14]从镉的超富集植物龙葵中分离了内生菌DE5,并且其研究表明接种了DE5的青葙根部生物量和Cd的富集能力得到显著提升。
研究表明秋茄内生细菌具有耐盐特性,可以在高盐环境中生存并促进秋茄的生长,这些耐盐内生细菌包括越南芽孢杆菌Bacillus vietnamensis、阿氏芽孢杆菌Bacillus aryabhattai等,它们在改良和利用盐碱地方面具有潜在的应用价值[15]。秋茄内生细菌还表现出对对大肠杆菌、金黄色葡萄球菌、蜡状芽孢杆菌和铜绿假单胞菌等具有抑制作用[16−18],表明秋茄内生细菌可能作为新的抗菌源被开发,其在提高植物耐盐性、促进植物生长以及作为天然抗菌剂方面具有重要的应用潜力。因此,本研究通过分离、培养秋茄不同组织中可培养内生细菌,探究秋茄内生细菌群落结构与分布,为后续功能菌株的挖掘与开发利用奠定基础。
1材料与方法
1.de89f1ae96997183366a8d031a2d17b41试验区概况
试验区位于福建省福州市长乐区闽江河口湿地,是中国东南沿海典型的滨海湿地生态系统,闽江河口湿地年平均温度为19.3℃,年平均降水量为1 382.3 mL,该地区的水文特征为规则的半日潮,主要水源包括潮汐、闽江和其他内陆河流。
1.2植物样品的采集
选取长势良好的健康秋茄植株,取20 cm左右深度的呼吸根,剔除土壤等杂质后作为根样本;选取生长健康、无病斑的秋茄枝、叶样本。采集后立即放入无菌样品袋中,4℃保鲜,并于48h内分离内生细菌。
1.3分离培养基
NA培养基:蛋白胨5 g,Nacl 5 g,琼脂18 g,牛肉膏3 g,水1 000 mL,pH7.0~7.2。
1.4可培养内生细菌的分离与纯化
用无菌水冲洗秋茄根、枝、叶组织样本,于净工作台中将无菌滤纸吸干后样本按照不同组织分别称量1 g,75%C2H5OH浸5 min,5%NaClO溶液浸3 min,无菌水漂洗3~5次,处理后将样本用无菌滤纸吸干,置于NA平板表面3~5 min,取最后一次漂洗用的无菌水涂布于NA平板上,置于30℃恒温培养箱培养。平板上无菌落长出则证明样品表面消毒彻底,若有菌落生长,表明该分离结果无效。将样本用无菌剪刀剪碎至无菌研钵中,加适量无菌水无菌石英砂充分研磨至匀浆,将原液稀释至10−2、10−3、10−4、10−5梯度,取100μL稀释液涂布于NA平板上,各样品重复3次。
1.5内生细菌的16S rDNA鉴定
将分离到的内生细菌菌株转接至NA培养基培养24 h后,使用细菌基因组提取试剂盒提取DNA,在对其进行16S rDNA基因序列扩增。
(1)反应体系:25μL反应液中包含10×PCR Buffer 2.5μL,基因组DNA 0.5μL,10 mmol dNTP 0.5μL,20μmol引物Pf 0.5μL,20μmol引物Pr 0.5μL,Taq酶(5 U·uL–1)0.5μL,ddH2O补足25μL,离子水为空白对照。
(2)PCR扩增条件:94℃预变性4 min,变性30 s,55℃退火45 s,72℃延伸90 s,循环35次;72℃延伸8 min。
用1%(W/V)的琼脂糖凝胶电泳检测PCR扩增产物,合格后送生工生物工程(上海)股份有限公司测序。把获得的测序列,登录数据库http://www.ncbi.nlm.nih.gov/Blast/比对及同源性分析,并构建系统发育树。
2结果与分析
2.1秋茄内生细菌的分离与16S rDNA鉴定
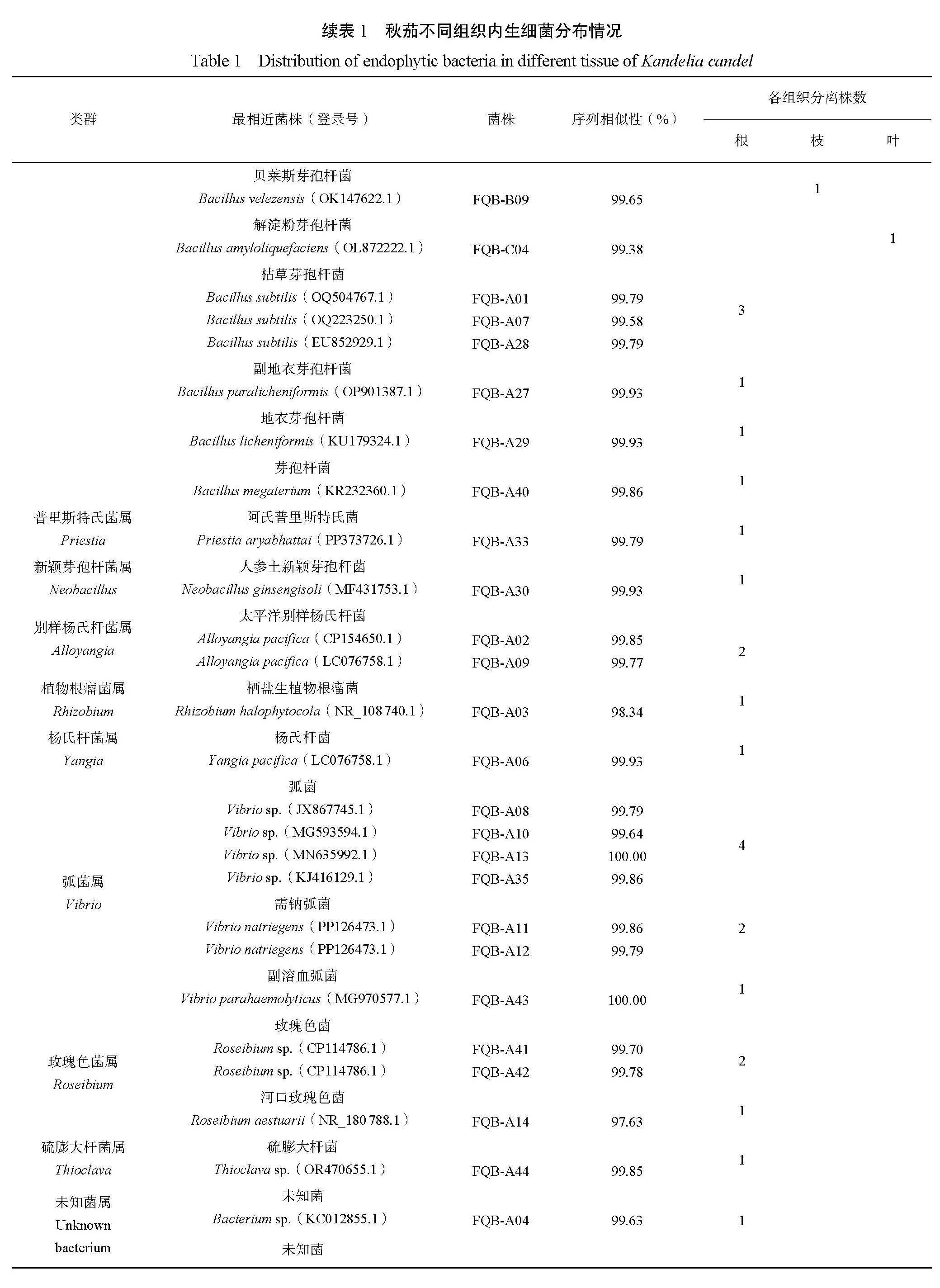
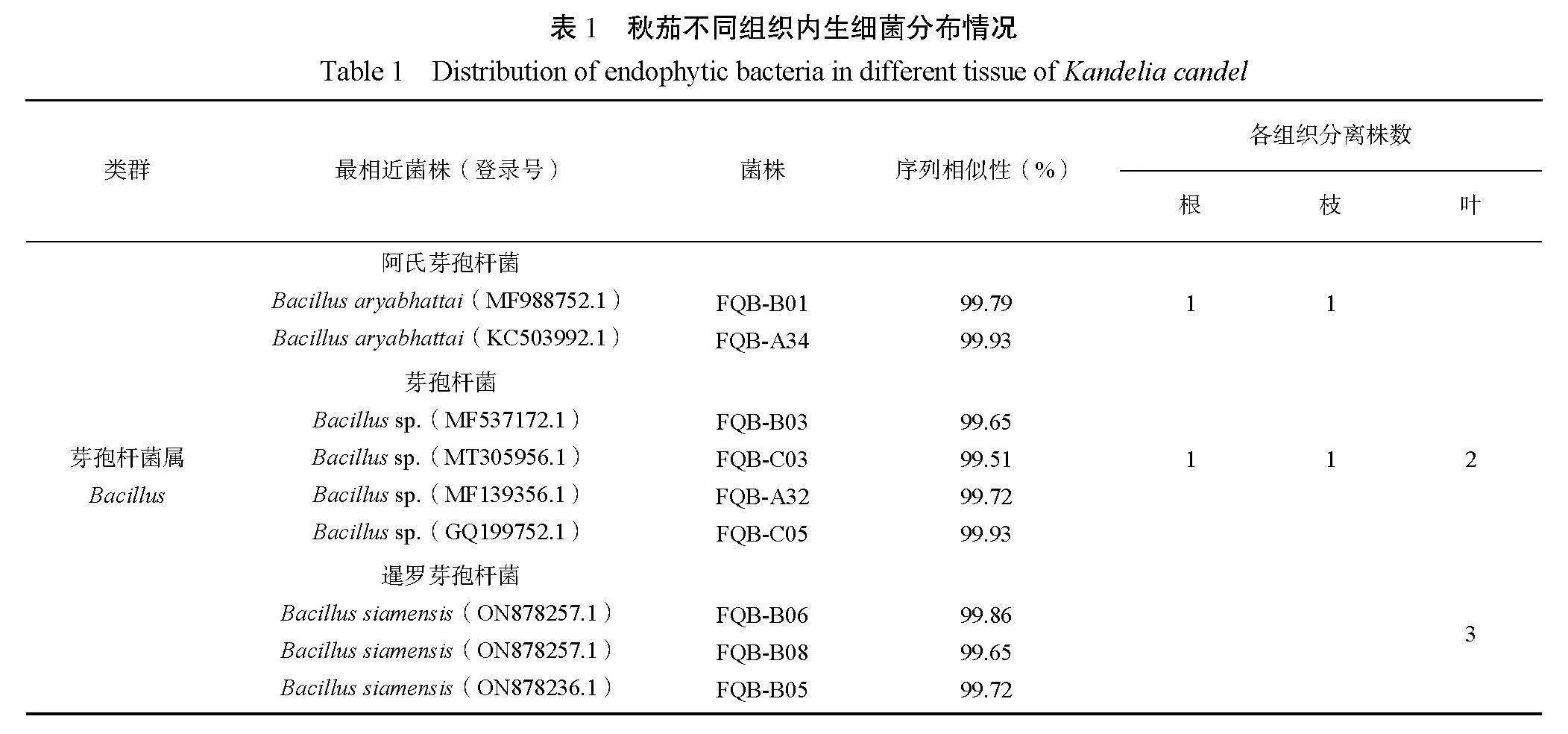
由表1可知,从秋茄根、枝和叶中共分离获得36株内生细菌,其中根部内生细菌最多,为27株;其次为枝(6株);最少为叶(3株)。对所分离的36株红树内生菌株进行16S rDNA序列分析后,为了鉴别出对应的细菌种类,将所得到的DNA序列通过http://www.ncbi.nlm.nih.gov/Blast/网站中的Blast功能进行相似性比对,通过比对可知,仅有2株菌种相似性低于99%,其余34株菌种16S rDNA序列相似性都在99%以上。
根据BLAST比对结果(表1),将36株红树内生细菌初步归属为11属22种(其中2株未被正式命名)。基于16S rRNA基因,分离的34株内生菌株分属厚壁菌门Firmicutes、变形菌门Pseudomonadota这2个菌门。属于厚壁菌门Firmicutes的内生细菌有19株,占分离总株数的52.8%,包括阿氏芽孢杆菌Bacillus aryabhattai、芽孢杆菌Bacillus sp.、暹罗芽孢杆菌Bacillus siamensis、贝莱斯芽孢杆菌Bacillus velezensis、解淀粉芽孢杆菌Bacillus amyloliquefaciens、枯草芽孢杆菌Bacillus subtilis、副地衣芽孢杆菌Bacillus paralicheniformis、地衣芽孢杆菌Bacillus licheni-formis、阿氏普里斯特氏菌属Priestia aryabhattai。其中芽孢杆菌属Bacillus为厚壁菌门Firmicutes中的优势属,有17株,占分离总株数的47.2%。属于变形菌门Pseudomonadota的内生菌株有15株,占分离总株数的41.7%,包括副溶血弧菌Vibrio parahaemolyticus、太平洋别样杨氏杆菌Alloyangia pacifica、杨氏杆菌Yangia pacifica、需钠弧菌Vibrio natriegens、玫瑰色菌Roseibium sp.、栖盐生植物根瘤菌Rhizobium halophytocola、弧菌Vibrio sp.。其中弧菌属Vibrio为变形菌门Pseudomonadota中的优势属,共分离到7株,占分离总菌株数的19.4%。栖盐生植物根瘤菌Rhizobium halophy-tocola、杨氏杆菌Yangia pacifica、硫膨大杆菌Thioclava sp.内生细菌分别有1株,各占分离总菌株数的2.7%。玫瑰色菌Roseibium sp.内生细菌有3株,占分离总菌株数的8.3%。太平洋别样杨氏菌Alloyangia pacifica内生细菌有2株,占分离总菌株数的5.6%。
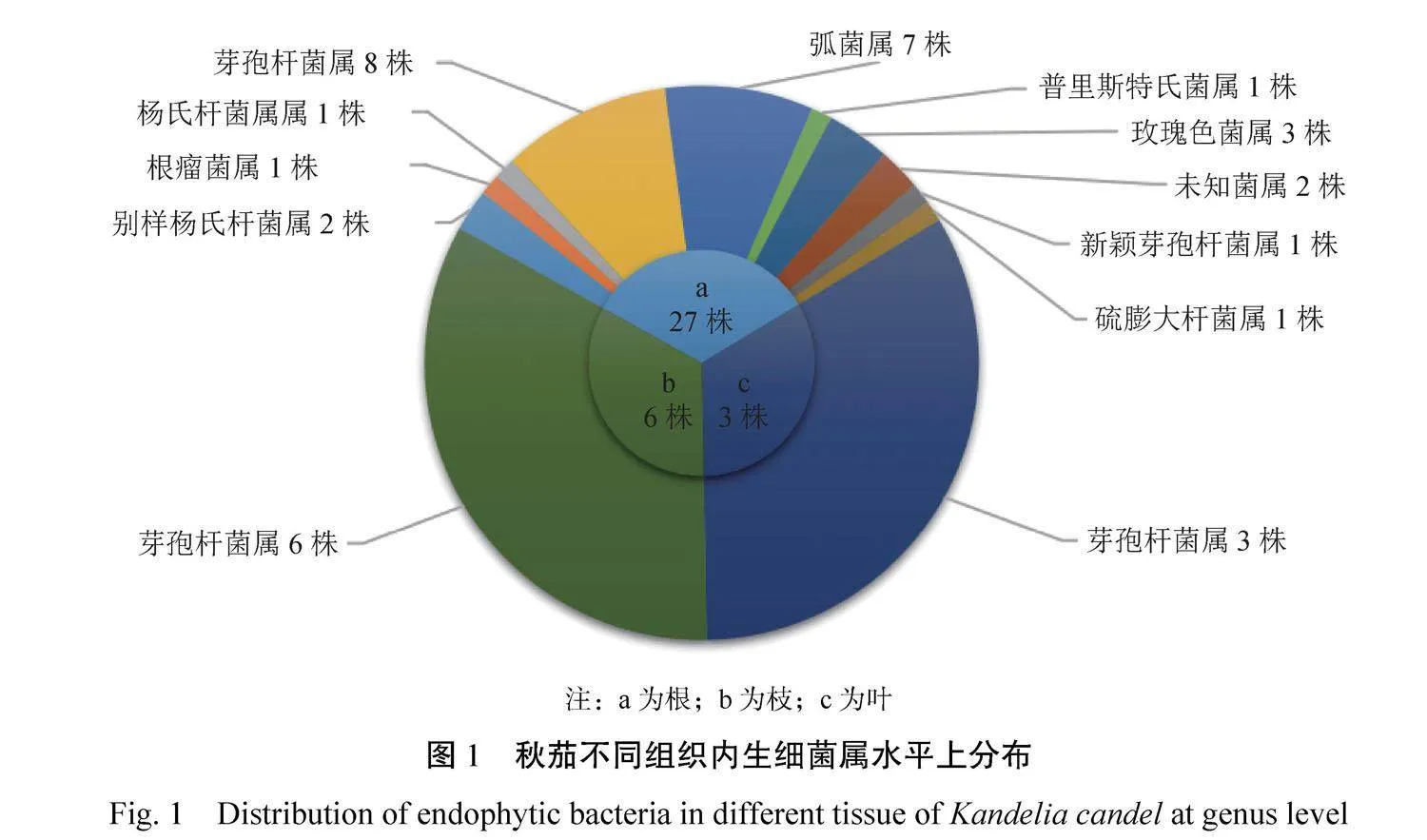
2.2秋茄不同组织内生细菌分布
从不同组织内生细菌分布(图1)可知,秋茄根、枝、叶分别分离到27株、6株、3株,共36株内生细菌,根分离25株包括11属18种(含2株未知菌属),枝分离6株包括1属1种,叶分离3株包括1属1种。其中别样杨氏杆菌属Alloyangia、根瘤菌属Rhizobium、杨氏杆菌属Yangia、普里斯特氏菌属Priestia、弧菌属Vibrio、玫瑰菌属Roseibium、新颖芽孢杆菌属Neobacillus、硫膨大杆菌属Thioclava仅在根部分离获得,而枝和叶仅有芽孢杆菌属Bacillus。从菌属种类分布情况可以发现根部物种多样性最丰富,其次是枝、叶。在秋茄根部分离的可培养内生细菌的数量中芽孢杆菌属Bacillus和弧菌属Vibrio占比最大,分别占根分离总数的29.6%和25.9%,而秋茄枝和叶分离的菌属比较单一,均为芽孢杆菌属Bacillus。
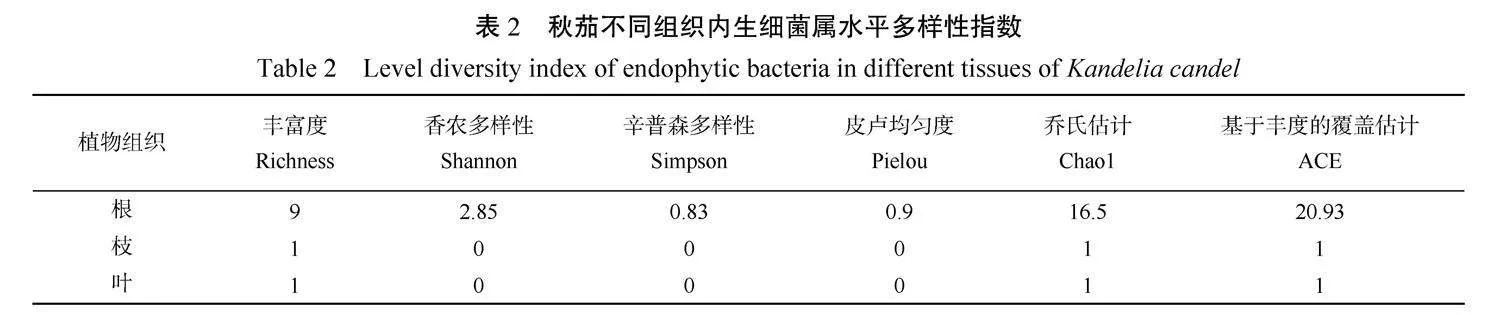
从秋茄不同组织内生细菌属水平多样性指数(表2)可知,根组织中的丰富度最高,有9种不同的内生细菌,而枝和叶的丰富度较低,分别只有1种。根组织的香农多样性指数最高,为2.85,表明根中的内生细菌群落具有较高的多样性和均匀度。相比之下,枝和叶的香农多样性指数为0,说明这些组织中的内生细菌群落多样性非常低。根组织的辛普森多样性指数为0.83,而枝和叶的指数为0,表明根中的内生细菌群落多样性较高。根组织的皮卢均匀度为0.9,接近1,表明根中的内生细菌群落中各物种分布相对均匀。枝和叶的皮卢均匀度为0,表明这些组织中的内生细菌群落中物种分布极不均匀。根组织的Chao1和ACE指数分别为16.5和20.93,远高于枝和叶的1,这表明根组织中可能存在更多的未被培养的内生细菌物种。
2.3秋茄内生细菌的16S rDNA序列系统发育分析
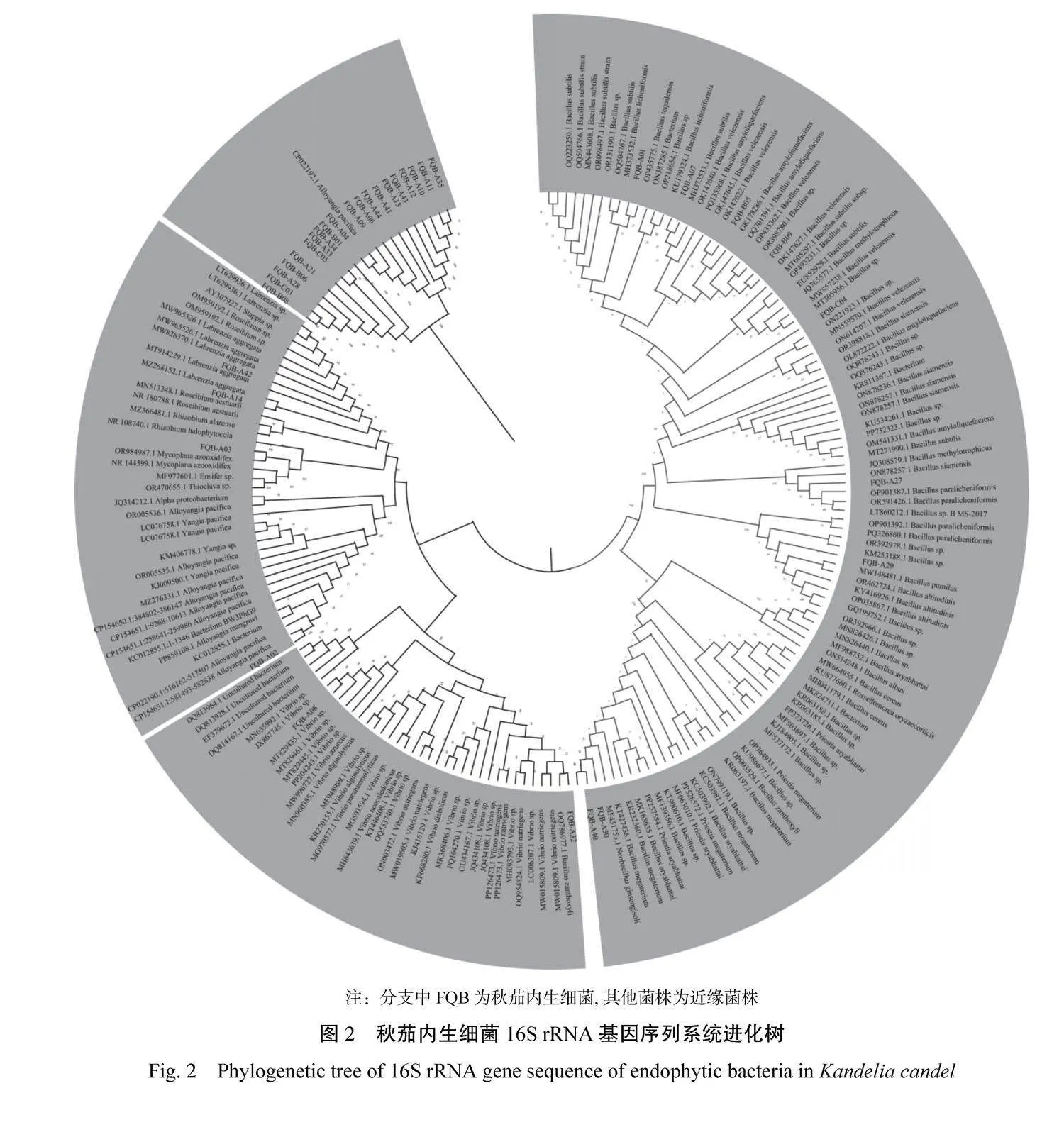
将秋茄内生细菌的16S rDNA序列构建成系统发育树(图2),可知构建出的系统发育树主要分为4个支系,其中一支系中包含了秋茄20株内生细菌,涵盖了根、枝、叶组织的内生细菌,以芽孢杆菌属Bacillus、弧菌属Vibrio为主,其余的小部分菌株都在其他分支系中散落分布。图2中的Bootstrap值显示,许多分离出的内生细菌菌株具有密切的亲缘关系,它们归属于相同的种属。
3讨论与结论
3.1秋茄内生细菌的群落组成
本研究从闽江河口湿地秋茄根、枝和叶组织分离到36株可培养内生细菌,分属于11属22种(含2株未知菌属),其中芽孢杆菌属Bacillus和弧菌属Vibrio的数量最多,比较少见的有栖盐生植物根瘤菌Rhizobium halophytocola、玫瑰色菌Roseibium sp.、阿氏普里斯特氏菌Priestia aryab-hattai、太平洋别样杨氏菌Alloyangia pacifica、暹罗芽孢杆菌Bacillus siamensis、贝莱斯芽孢杆菌Bacillus velezensis、需钠弧菌Vibrio natriegens、人参土新颖芽孢杆菌Neobacillusginsengisoli、硫膨大杆菌Thioclava sp.,表明秋茄内生细菌资源丰富且特殊。
栖盐生植物根瘤菌Rhizobium halophytocola、玫瑰色菌Roseibium sp.、阿氏普里斯特氏菌Priestia aryabhattai是近海与极地海洋植物中特有的内生细菌,其中栖盐生植物根瘤菌Rhizobium halophytocola能够在高盐环境中生存,并且与植物形成共生关系,帮助植物在盐渍土中吸收水分和养分[19]。而喜盐类细菌如暹罗芽孢杆菌Bacillus siamensis的耐盐性和益生能力而备受关注,Brahim等[20]对暹罗芽孢杆菌BW菌株耐盐性研究结果表明,BW菌株能够在3M NaCl中生长,表现出耐盐性,并且通过生物诱导种子处理,能够显著减轻水稻幼苗的盐胁迫。玫瑰色菌属Roseibium具有多样化的生理代谢功能如好氧不产氧光合作用、一氧化碳氧化、硫化物降解等[21]。在余小兰等[22]的研究中证明了阿氏普里斯特氏菌Priestia aryabhattai能够提高黑叶白菜产量的同时,能通过降低硝酸盐含量,提高游离氨基酸、维生素C和可溶性糖等途径改善其品质。而硫膨大杆菌Thioclava sp.、太平洋别样杨氏菌Alloyangia pacifica相关研究鲜有报道,其具体的生理功能作用有待进一步发掘。秋茄生长环境复杂,探究特殊环境的植物内生细菌有助于我们更好地理解这些细菌的生物学特性,对于预防和控制相关疾病生物防治以及生物改良有重要意义。
3.2秋茄不同组织内生细菌分布和多样性
由秋茄不同组织内生细菌属水平上分布图可以发现,秋茄根部可培养内生细菌多样性显著高于秋茄的枝和叶,这与大多数的植物内生细菌生态位分布表现一致[23−26]。随着秋茄生态位置的改变,其不同组织内生细菌也发生改变,推测可能是由于不同组织的生长环境不同引起的变化,秋茄根际环境长期处于涨潮落潮反复交替的泥质海滩,根际环境相对于枝和叶则更为复杂,微生物多样性较为丰富。而枝叶可能在涨潮的时间段内会被浸泡在海水中,这种周期性的水淹为微生物提供了独特的生存环境,从而影响了微生物多样性,特别是从秋茄枝分离出的且也是枝特有的暹罗芽孢杆菌Bacillus siamensis可以证明这一点。秋茄叶片的微生物多样性比较单一,只有芽孢杆菌属Bacillus一种,这可能是由于叶片的环境比较简单受海水以及潮水的影响较小。
秋茄内生细菌的多样性可能与其生长环境的盐度、温度和季节变化密切相关。这些内生细菌通过产生不同的代谢产物来适应环境压力,对于秋茄的生长和健康发挥着重要作用。通过研究这些特殊环境植物的内生细菌,有助于更好的挖掘其潜在的应用价值。
参考文献:
[1]胡佳欣,陈瑜,袁伟皓.太湖入湖河口表层沉积物细菌群落结构和功能演变规律研究[J].环境科学学报,2023,43(10):371−381.
[2]李荫玺,胡耀辉,王云华,等.云南星云湖大街河口湖滨湿地修复及净化效果[J].湖泊科学,2007(3):283−288.
[3]周亮进,涂燕玉,宋永昌.闽江河口湿地生物多样性及其保护[J].生态科学,2006(4):330−334.
[4]郭舜,黄启堂.闽江河口湿地植物多样性与土壤养分和微生物因子关联分析[J].水土保持研究,2021,28(3):30−37.
[5]邱思婷,米慧珊,高会,等.闽江河口湿地不同植被带土壤全硅的含量及分布特征[J].生态学报,2020,40(22):8306−8314.
[6]陈菲莉,颜利,郭洲华.1989年与2008年泉州湾河口湿地生态环境脆弱性变化的评价研究[J].应用海洋学学报,2013,32(4):577−583.
[7]杨逢志.闽江河口湿地自然保护区生态旅游保护与开发研究[J].中国城市林业,2014,12(3):53−56.
[8]AFZAL I,SHINWARI Z K,SIKANDAR S,et al.Plant beneficial endophytic bacteria:Mechanisms,diversity,host range andgenetic determinants[J].Microbiological Research,2019,221:36−49.
[9]PLANT SCIENCE DEPARTMENT F O A A,PLANT SCIENCE DEPARTMENT F O A A.Cannabis Microbiome and the Role of Endophytes in Modulating the Production of Secondary Metabolites:An Overview[J].Microorganisms,2020,8(3):355.
[10]FAHU P,AILI T,CAMILO A,et al.Plant organ-and growth stage-diversity of endophytic bacteria with potential as biofertilisers isolated from wheat(Triticum aestivum L.)[J].BMC plant biology,2022,22(1):276.
[11]张玮川,李剑,王志宇,等.内生菌-植物联合修复污染土壤研究进展[J].农业资源与环境学报,2021,38(3):355−364.
[12]刘劲松,张健君,杨淑芳,等.内生菌参与植物/微生物联合修复重金属污染土壤的研究进展[J].中国植保导刊,2014,34(2):27−30.
[13]COLLEGE OF LIFE SCIENCES N N U N,GLOBAL CENTRE FOR ENVIRONMENTAL REMEDIATION GCER T U O N,GLOBAL CENTRE FOR ENVIRONMENTAL REMEDIATION GCER T U O N,et al.Endophyte-assisted phytoremediation:mechanisms and current application strategies for soil mixed pollutants.[J].Critical reviews in biotechnology,2020,40(1):31−45.
[14]YANG Z,TANG J,FENG H,et al.Research progress on remediation of heavy metal contaminated soil by electrokinetic-permeable reactive barrier[J].Chemical Engineering Journal,2024,490:151548.
[15]陈惠静,赖安萍,范铭丰,等.秋茄和木榄耐盐内生细菌筛选及鉴定[J].西昌学院学报(自然科学版),2022,36(2):8−12.
[16]MAULANI B I G,RASMI D A C,ZULKIFLI L.Isolation and characterization of endophytic bacteria from mangrove Rhizophoramucronata Lam.and antibacterial activity test against some pathogenic bacteria[J].Journal of Physics:Conference Series,2019,1402(3):33038.
[17]李菲,高程海,余炼,等.秋茄内生细菌多样性及抑制甘蔗黑穗霉菌活性研究[J].中国抗生素杂志,2017,42(0):318−327.
[18]邓祖军,曹理想,周世宁.红树林内生真菌的分离及代谢产物生物活性的初步研究[J].中山大学学报(自然科学版),2010,49(2):100−104.
[19]姚延轩,接伟光,杜燕,等.根瘤菌的分类、鉴定及应用技术研究现状[J].中国农学通报,2020,36(15):100−105.
[20]OUBAHA B,RATHORE R S,BAGRI J,et al.Bacillus siamensis strain BW enhances rice growth and salinity tolerance through redox equilibrium and hormone modulation[J].Current Plant Biology,2024,37:100321.
[21]陈正浩,张永雨,杨素萍.海洋玫瑰杆菌类群研究进展[J].生态学报,2015,35(5):1620−1629.
[22]余小兰,李勤奋,李光义,等.巨大普里斯特氏菌对不同黑叶白菜品种产量与品质的影响[J].南方农业学报,2023,54(5):1446−1454.
[23]何玲敏,叶建仁.植物内生细菌及其生防作用研究进展[J].南京林业大学学报(自然科学版),2014,38(6):153−159.
[24]吕佩,王新绘,刘晓颖,等.药用植物刺山柑不同部位细菌群落结构及其多样性[J].微生物学报,2023,63(10):3939−3954.
[25]程欢,张东华,张俊忠,等.苹果砧木T337不同组织内生菌群落及其功能预测[J].江苏农业科学,2022,50(14):144−154.
[26]李秋桦,夏体渊,任禛,等.基于高通量测序技术解析三七不同部位内生细菌多样性[J].西南农业学报,2021,34(10):2182−2190.
(责任编辑:柯文辉)
