推拿干预疼痛情绪的脑电作用机制及其研究进展
2024-12-09陈蕾曾理智慧潘杰灵张玉乔唐丽亚李武李江山


〔摘要〕 推拿对于疼痛类疾病有着十分确切的疗效,其镇痛作用良好。通过回顾脑电图在痛情绪的相关研究以及痛情绪的中枢神经机制,对痛情绪患者的脑电波进行分析,发现疼痛引发脑电波活动的不对称,这是造成情绪障碍的主要原因。进一步研究脑电图技术在推拿的应用发现,推拿能增加δ波的活动,减少α波和β波的活动,产生愉悦效应。脑电图技术揭示了与疼痛相关的负面情绪在脑电活动上的独特变化,这些变化不仅能反映出慢性疼痛患者与情绪状态相关的生理特征,还可成为推拿治疗的潜在干预点。借助脑电图能为痛情绪的治疗提供科学依据,优化治疗方案,提升临床疗效,同时还能拓展推拿效应的客观指标,推动推拿学科的发展。
〔关键词〕 推拿;痛情绪;脑电图;疼痛;焦虑;抑郁
〔中图分类号〕R244.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.10.028
Mechanism of action of tuina intervention on electroencephalographic activity related to pain emotions and its research progress
CHEN Lei, ZENG Li, ZHI Hui, PAN Jieling, ZHANG Yuqiao, TANG Liya, LI Wu*, LI Jiangshan*
School of Acupuncture-moxibustion, Tuina, and Rehabilitation, Hunan University of Chinese Medicine,
Changsha, Hunan 410208, China
〔Abstract〕 Tuina exhibits definite therapeutic efficacy on pain diseases, demonstrating notable analgesic effects. By reviewing the research related to electroencephalogram (EEG) in pain emotions and the central nervous mechanism of pain emotions, an analysis was conducted on the brain waves of patients experiencing pain emotions. It was found that pain triggers asymmetry of the brain wave activity, which is a major cause of emotional disorders. Further research into the application of EEG technology in tuina therapy has revealed that tuina can increase δ-wave activity and decrease α-wave and β-wave activity, producing a pleasurable effect. EEG technology has uncovered unique changes in brain electrical activity associated with pain-related negative emotions. These changes not only reflect the physiological characteristics related to emotional states in chronic pain patients, but also serve as potential intervention points for tuina therapy. Utilizing EEG can provide a scientific basis for the treatment of pain emotions, optimize treatment plans, and enhance clinical efficacy. Simultaneously, it can expand the objective indicators of the effects of tuina and promote the development of tuina discipline.
〔Keywords〕 tuina; pain emotions; electroencephalography; pain; anxiety; depression
慢性疼痛是指伤害性刺激持续3个月以上,组织损伤未愈合或愈合后疼痛感觉依旧存在的一种主观感受,常伴有焦虑、抑郁等痛情绪[1]。疼痛与负性情绪相互作用,使得病痛迁延难愈,临床疗效不佳,患者因此承受了巨大的诊疗负担。推拿作用于体表和深层肌肉组织,通过其中的机械感受器将刺激信号转换成电信号,并传输至脊髓和大脑[2]。研究表明,推拿可有效缓解疼痛和情绪[3-4],但对于痛情绪的相关研究十分稀少,并且缺乏对临床疗效评估的客观依据。疼痛不仅触发了痛觉,还会伴随着焦虑抑郁情绪的出现,这些情绪会引起大脑电生理活动的变化。脑电图(electroencephalogram, EEG)能够捕捉到这些变化,并能动态评估由疼痛引起的不同程度的负面情绪。与疼痛相关的负面情绪所引起的EEG变化,不仅可以作为慢性疼痛患者伴随负面情绪产生的电生理标志,还可以作为推拿治疗的潜在靶点。因此,本研究将结合EEG与推拿的相关研究,探讨EEG在推拿治疗慢性疼痛伴痛情绪中的应用,旨在为推拿提供一种无创性的研究方法,推动推拿学科的发展。
1 脑电图可反应脑部整体电信号的变化
疼痛产生的痛情绪和疼痛缓解引发的愉悦效应都是人的精神和意识的重要组成部分,归于中医学“神”的范畴,脑神与痛情绪的产生也息息相关。王冰于《重广补注黄帝内经素问·至真要大论篇第七十四》指出“心寂则痛微,心躁则痛甚,百端之起,皆自心生”,提示推拿治疗疼痛伴痛情绪的关键是调神。而神与脑的关系密不可分,据《素问·脉要精微论篇》曰“头者,精明之府”,说明脑主神明、司情志,主管情志活动等脑神的功能变化。因此,焦虑、抑郁等情志类疾病与脑神关系密切。且临床治疗焦虑的高频腧穴及操作部位也集中在头面部[5],这提示脑神的调控发挥主导作用。人脑本质上是大规模的神经认知网络,由相互连接的神经元簇组成。EEG技术是于头皮放置电极记录脑皮质椎体神经细胞的生物电活动,同时用EEG描记仪将这种脑电波放大,再以曲线图形式展现的技术[6]。脑电波能进行电位的累加,即两个或多个以上的神经细胞的冲动到达一个细胞时所产生的突触后电位的总和[7]。EEG通过提供脑部皮层神经元的电波信号,反映中枢信息的传递,以展示大脑功能的变化[8]。推拿手法分为作用于体表皮肤的轻揉刺激和作用于深层肌肉组织的按压刺激。这些手法通过刺激不同的感受器,进而激活无髓鞘的C纤维和有髓鞘的Aβ、Aδ纤维,将信号传递到中枢神经系统,影响脑电波的传递。推拿调节痛情绪的中枢机制是通过激发特定脑区及神经网络起效的,如推拿按压委中穴能激活脑内的愉悦回路(如杏仁核和海马等脑区)以调控情绪[9-10]。同时,推拿刺激还可影响脑区内的神经递质表达,对下行抑制通路起调控作用,下调疼痛信号的产生,从而改善痛厌恶情绪[11]。因此,EEG能更清晰地阐明推拿调控情绪中枢的神经信号的传递变化。
2 慢性疼痛与痛情绪的脑电图变化和神经机制
2.1 疼痛与痛情绪相关的重要脑区和中枢机制
慢性疼痛能引起大脑结构以及功能的改变[12]。疼痛刺激在脊髓和延髓形成两条通路进行传递:一条经外侧丘脑传导到皮质体感区的外侧痛系统,主要传递伤害性信息;另一条经内侧丘脑传至前扣带和岛叶的皮质内侧痛系统,涉及情绪和认知[13-14]。长期的疼痛刺激会导致相关脑区的神经递质传递紊乱,引起功能失调和形态改变。丘脑在痛情绪的产生和调节中起核心作用,能初步区分和加工来自脊髓和延髓的疼痛信号[15]。丘脑和皮质之间的神经连接对于痛觉的产生至关重要。丘脑束旁核(parafascicular nucleus of thalamus, PF)中的谷氨酸(glutamate, Glu)神经元投射到前扣带回皮质(anterior cingulate cortex, ACC),激活γ-氨基丁酸(γ-aminobutyricacid, GABA)神经元,形成PFGlu→ACCGABA→Glu的神经环路,这一环路参与了慢性应激并抑郁样模型小鼠中的痛觉过敏现象[16]。边缘系统与情绪密切相关,其中的ACC是高级神经活动的物质基础,对认知和情绪有调控作用。ACC能接受不同皮质区域的疼痛信息传入[17],并与杏仁核和岛叶构建以它为核心的疼痛感觉或痛情绪的环路[18]。而杏仁核与ACC能相互影响,参与痛情绪的输入与慢性疼痛的产生和维持[19-20]。研究发现,对中央杏仁核(central amygdala, CeA)进行双侧电解损伤可以减轻由脊神经结扎引起的疼痛过敏以及厌恶和抑郁症状,同时还观察到神经性疼痛大鼠的CeA区域神经元树突棘数量发生减少[21]。ACC还能将另一部分疼痛信号投射到记忆相关脑区,与海马及丘脑前核共建痛认知的基础即Papez's环[22]。同时,长久的伤害性刺激会导致海马神经元凋亡、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)释放减少,海马的突触可塑性也会发生改变,引起认知和情绪的障碍[23]。随着脑区研究的不断深入,神经网络信号相互串联,疼痛刺激影响到的中枢范围非常广泛,包括丘脑、前额叶皮质、ACC、杏仁核、海马等[24-25]。近年来,对边缘系统的研究愈发重视,科学技术的发展也驱使着研究从单一脑区内受体或递质进阶到整个脑区可见的形态观察与脑电信号的捕捉。
2.2 疼痛和痛情绪相关的脑电信号变化
2.2.1 由疼痛引发的脑电波形改变 疼痛信息从外周感受器通过脊髓和延髓背角到达丘脑,增强了与丘脑相连的脑区向丘脑传递的神经活动,这导致丘脑中的非特异性神经核脑电波异常[26]。丘脑作为脑电节律性活动的起搏点,发出第1个活动脑电波[27]。疼痛刺激试验表明,冷加压刺激所产生的疼痛能先引起枕叶的α波活动减少,通过突触传递到丘脑皮质,丘脑不断接收伤害信息而持续性兴奋,使得α波活动持续下降。当人出现紧张不安的情绪时,前额叶和枕部的α波活动会发生变化[28]。同时,前额叶以及中央区脑电波去同步化导致了β波活动的增加,而枕部和右侧颞叶的θ波活动也呈上升趋势。相关研究也证实,θ波和β波功率的增加可作为慢性疼痛患者诊断的生物标志物[29]。后续有许多学者对不同类型的疼痛刺激进行了研究,包括热痛刺激和物理化学药物引起的疼痛,发现无论何种疼痛刺激都会引起α波活动减少,δ波和β波活动增加,导致左脑和右脑脑电波活动不平衡[30-31]。由此说明,疼痛能引起脑区电信号传递紊乱,脑电α波、β波、θ波活动状态的改变能有效反映疼痛表达,从而出现不对称的EEG,这是疼痛引起情绪障碍的关键表现。
2.2.2 由情绪障碍引起的脑电波形改变 疼痛是一种多维度的感知,包括了身体上的不适和情绪上的波动。焦虑和抑郁是个体在疼痛过程中常见的情绪状态,是疼痛经历对个体情绪健康影响的直接体现。当个体处于焦虑状态时,会出现心率加快、肌肉紧张、神经兴奋和易激怒等症状,这与临床上观察到的焦虑患者的高兴奋性特征相一致[32]。在慢性疼痛的背景下,焦虑水平的提升与大脑皮质的激活程度及其神经电活动呈正相关[33]。大脑的高激活状态被证实与焦虑情绪相关,EEG上表现出α波频率密集、波幅变低,以及β波、θ波的活动增多[34-36]。针对性地调节脑电活动,如抑制β波或增强α波,可以改善焦虑情绪。抑郁则会导致患者出现睡眠障碍、情绪低落,以及注意力、记忆力和处理事情速度明显下降。抑郁情绪会让患者出现过度警戒和注意力缺陷,EEG可见α波、β波功率和θ波节律的增加[37],而δ波降低表示睡眠障碍的产生[38]。抑郁症的严重程度与EEG中α波和β波的波幅高度相关[39]。此外,左右额叶脑电不对称活动是抑郁症患者的典型特征[40],额叶的δ波活动可以预测患者的心理痛苦程度[41],而θ波活动的同步性则被证明能够预测治疗方法对抑郁情绪的疗效[42]。在抑郁情绪的神经机制中,ACC神经元参与了抑郁情绪的产生,当ACC的椎体神经元被反复刺激,可导致大鼠出现抑郁症状,脑内的兴奋性突触后电位(excitatory postsynaptic potential,EPSP)振幅及频率也会增加[43]。
2.2.3 疼痛造成的情绪障碍可由脑电同步反应 疼痛和焦虑抑郁有一个复杂的循环关系。生理上,疼痛能激活大脑的情绪处理中心,触发焦虑抑郁情绪。心理上,慢性疼痛导致个体感到无助和绝望,会加剧焦虑和抑郁。而焦虑抑郁情绪又能反过来增加疼痛感觉,形成痛敏,加剧疼痛体验。在这一过程中,丘脑扮演着关键角色,它能将不同的疼痛感觉结合投射到大脑皮质,最后信号扩散至杏仁核、前扣带回等脑区,使得锥体细胞发出的冲动减少,抑制性突触后电位(inhibitory postsynaptic potential, IPSP)表达下降,脑电波波幅降低以及慢活动增加,发生去同步化现象,从而引起痛情绪,EEG表现为α波活动减弱或消失以及β波活动增加[44]。慢性应激包含慢性疼痛,研究表明,慢性应激条件下的基底外侧杏仁核(basolateral amygdala, BLA)锥体神经元树突棘数量增多,导致Glu介导的EPSP投射增强,GABA介导的IPSP投射减弱,BLA区神经活性过度活跃,小鼠就会出现焦虑样行为,EEG表现为δ波活动显著上调[45]。疼痛引发的焦虑情绪与ACC也有着密切的联系。实验证明,ACC内神经元的突触前的长时程介导了慢性疼痛伴焦虑的产生,突触后的长时程则在痛觉敏化中起重要作用[18]。心理高痛苦的抑郁症个体不善于客观地正视自己经历的痛苦,倾向于反思痛苦的前因后果即反刍思维。这种反刍思维在慢性疼痛患者中也常见[46],与他们大脑内侧前额叶皮质(medial prefrontal cortex, mPFC)的激活有关。疼痛患者出现反刍思维是慢性疼痛形成情绪障碍的认知基础,也会加剧患者的情绪困扰。
疼痛患者情绪改变会引起脑电状态发生同步的动态变化,脑电信号作为抗痛情绪的疗效预测指标客观可行[47]。由以上研究可以得出,疼痛使患者脑内α波活动下降,δ波和β波活动增加,当疼痛引发患者焦虑时,会使得α波频率改变,δ波活动显著增多,疼痛刺激不断影响情绪相关脑区,导致负面情绪加重而出现抑郁症状,会使得额叶EEG不对称性活动加剧,此时脑电波的α波会进一步增多,δ波则降低。
3 推拿治疗痛情绪的脑电作用机制及其应用
3.1 推拿对痛情绪的脑电作用机制
脑电记录的是大脑皮质上持续的节律性电位变化,这是由神经细胞排列方向一致且放电同步所产生的[48]。神经电信号的传播依赖于椎体神经元的突触传递,当神经冲动兴奋了突触前膜,会触发神经递质的释放。随后这些递质作用于突触后膜,使后膜上的离子通道开放,膜电位发生变化就会形成突触后电位(postsynaptic potential, PSP)。中枢的兴奋性递质如Glu与后膜对应的受体结合,使带电的Na+离子内流通透性增加,后膜出现部分去极化为EPSP。抑制性递质如GABA与相应受体结合,使Cl-流向细胞内,发生超极化为IPSP。因此,产生EPSP或IPSP取决于递质的性质[49],而PSP可发生电位累加,如不同类型的递质同时作用于一个突触,产生的EPSP多于IPSP则会产生兴奋效果。突触内抑制性或兴奋性递质传递的失衡是痛情绪的关键病因。ZHUO[50]研究发现,痛觉的传递与Glu离子型受体增加有关,此类受体还参与了慢性疼痛的维持,拮抗Glu的离子型受体还能起到快速抗抑郁的效果[51-52]。抑制性的递质作用于它的不同受体,能有效缓解焦虑抑郁等负性情绪,也是负性情绪发生的关键递质[53]。临床研究表明,慢性疼痛能引起ACC皮质中Glu/GABA比值的变化,而这个数值的大小与抑郁焦虑程度成正比关系,且ACC中抑制性递质的浓度越低,导致疼痛的程度越大[54]。由此可以说明,疼痛会增加EPSP以及下调IPSP的表达,从而引发脑电波的变化。而减少兴奋性突触的冲动,增加GABA的水平或使其受体表达增加,则能缓解焦虑抑郁等情绪。触觉信息始于皮肤表面的各种感受器,如压力感受器和触觉小体(如Meissner小体和Pacinian小体)等,它们将机械刺激转化为电信号。这些信号通过脊髓后的薄束和楔束传输至脊髓,经过初步处理后,上传至脑干和丘脑。丘脑对触觉信号进行进一步的加工和筛选,最终到达大脑皮质,特别是躯体感觉皮质S1区,进行触觉特征分析。随后,触觉信号传递至S2区和其他联合皮质进行高级处理,涉及感知整合以及与记忆、情绪等的认知交互。触觉信号的传入激活了大脑多个区域,引起EEG记录的脑电波变化,如α波或β波的变化。触觉信号与大脑的边缘系统和奖赏系统的多个关键区域相互作用,这些区域包括ACC、杏仁核、海马体,以及奖赏系统中的腹侧被盖区(ventral tegmental area, VTA)和伏隔核(nucleus accumbens, NAc),从而影响了情绪反应和记忆形成。长期的触觉刺激还可以引起神经可塑性的变化,改变神经回路的效率和突触的连接强度。推拿是正性的触觉刺激,可以通过这些神经途径减轻焦虑和压力,同时调节神经递质(如GABA和Glu)的释放,这些神经递质参与睡眠及觉醒的启动和维持,从而影响脑电活动。如推拿能上调疼痛模型大鼠中脑灰质、VTA和NAc等奖赏系统相关的核团内GABA及其受体的表达[55-56]。此外,推拿还能降低N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)这类兴奋性神经递质的表达,从而抑制初级神经元去极化,升高GABA等抑制性神经递质的表达,减轻中枢去抑制效应[57]。由此可知,推拿能通过影响脑内的神经环路与突触内的递质及其受体的表达,影响神经元的PSP形成,导致脑电波形的改变,增加δ波的活动,同时减少α波和β波活动,平衡左右两侧脑电波的不对称性。
3.2 脑电图在推拿治疗中的应用
近几年,基于EEG的推拿研究逐渐变多,但关于推拿对痛情绪影响的文献资料仍相对有限。因此,将综合推拿与EEG相关的文献从几个不同层面阐释推拿对于负面情绪的缓解作用。有研究表明,触觉刺激能引发脑电波形改变,轻柔的刺激令人愉快,这与推拿治疗中采用轻揉手法所产生的效应类似[58]。许多临床或动物研究都能观察到推拿操作后脑电波形的变化,应用EEG在反映推拿的治疗效果的同时,还可以对不同推拿手法的疗效进行比较。基于EEG的推拿临床研究,有助于深入理解推拿对疼痛及其伴随情绪障碍的影响机制。
3.2.1 基于脑电观察触觉刺激 当外力结合温度、湿度、疼痛、压力、振动等方面作用在人体皮肤上的神经细胞,则会产生相应的触觉刺激。推拿产生的触觉刺激可通过不同纤维传入脊髓,经脊髓丘脑束传导至丘脑,激活ACC和大脑皮质等脑区[59]。文献表明,不论何种触觉刺激在额叶和中央头皮部位都会出现α波、β波的抑制,EEG发生去同步化,δ波、θ波频段的短暂振幅增加[60-61]。VON等[48]研究发现,情感触摸相较于非情感触摸和无触摸,更能降低θ波的活动,引起多个脑区θ波的衰减。还有研究结合超声发现,节律性抚摸后的大鼠处于积极、抗焦虑的状态,EEG显示慢θ波(4~7 Hz)减少和快θ波(7~10 Hz)增加[62]。KUC等[63]证实,慢刺激可以激活情感触觉的低阈值感受器,这种刺激是最令人愉悦的,与之相反的超轻动作是最令人不适,并且在瘙痒评分中得分最高。由此得出,轻揉慢的触觉刺激可以引起愉悦效应,改善人的负面情绪。详见表1。
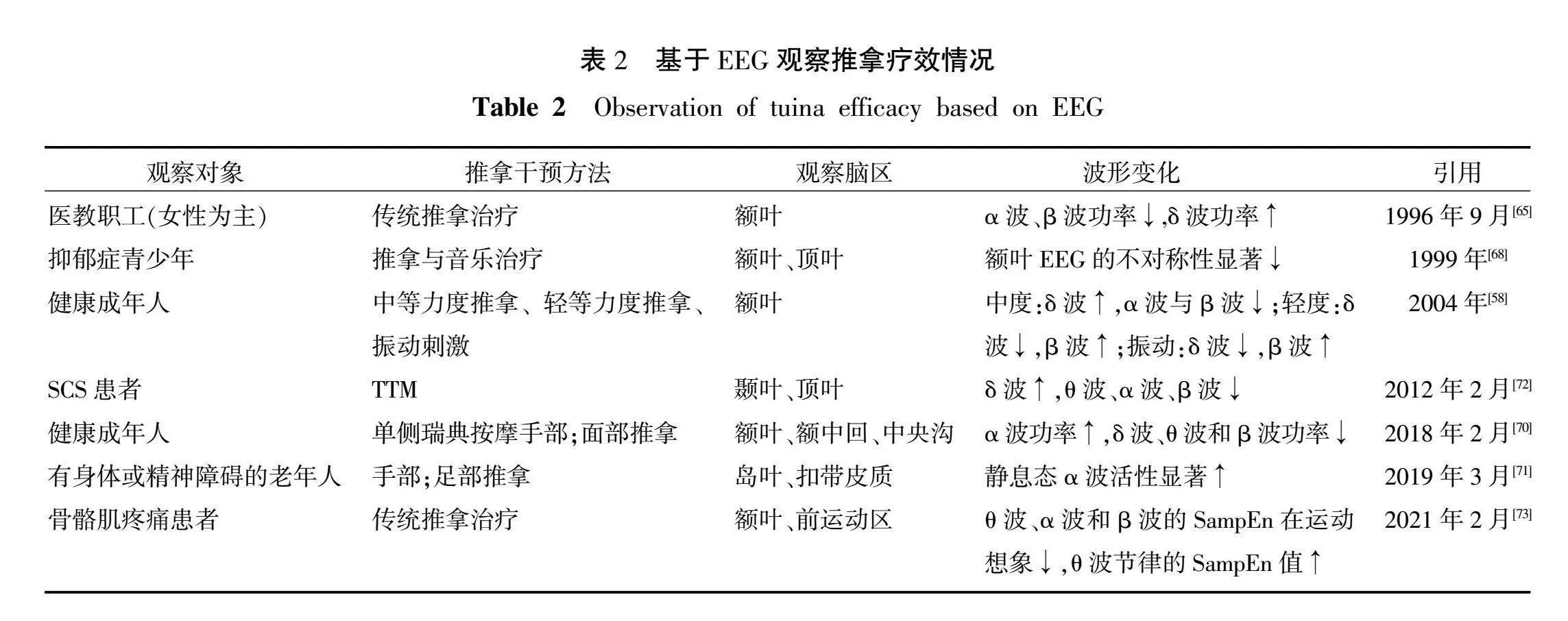
3.2.2 基于脑电观察推拿疗效及其比较 推拿作为一种触觉刺激形式,同样能够引发类似的积极效应。通过广泛的EEG研究表明,推拿能减少焦虑抑郁样情绪,缓解压力,以增加额叶δ波的活动,减少α波和β波的活动,使额叶α波不对称性由右脑型向左脑型偏移[64-65]。α波和β波活动与警觉性、注意力以及感觉加工呈负相关[66-67],这提示推拿能引起放松、愉悦和警觉性的增加。JONES等[68]发现,推拿能减少抑郁青少年右侧额叶EEG的不对称性。根据情感额叶不对称假说,左侧前额叶脑区主要表达积极情绪,右侧前额叶脑区主要表达消极情绪,而推拿能调节脑电的不对称性,是反映其调神作用的又一重要表现[69]。推拿手法的关键在于施术部位和施术力度。不同部位的推拿激活的脑区不同,引起的脑电效应也不同。如面部推拿能使人的注意力和警觉性提升,导致α波和β波功率的下降[70]。NAKANO等[71]观察到手部推拿能够显著增加人左侧岛叶皮质的静息态α波的活动,而足部推拿则能显著提高两侧后扣带回皮层的α波的活动,这表明手足部的推拿能产生高度愉快、放松的感觉。DIEGO等[58]再一次证实,推拿对缓解焦虑和压力有帮助,通过不同力度推拿的对比,发现中等力度能引起心率下降、δ波的活动增加、α波与β波的活动减少,使人放松。轻抚皮肤导致心率增加、δ波的活动降低、β波的活动增加,使人更觉醒[58]。振动刺激产生的效果与轻抚皮肤相似,不同之处在于其会导致δ波、α波活动的增加。但不论何种刺激都能使左侧额叶不对称性发生偏移,其中中等力度推拿效果最好[58]。BUTTAGAT等[72]对肩胛肋骨综合征(scapulocostal syndrome, SCS)患者采用传统泰式按摩(traditional Thai massage, TTM)发现能减少焦虑情绪和疼痛强度并增加患者的放松程度,表现为δ波的活动增加和θ波、α波、β波的活动减少。LI等[73]基于脑电证实推拿对疼痛有效,表现为α波活动减少。由上述研究可得出,不论何种部位和力度的推拿都能产生愉悦的情绪,特别是手足部和中等力度的推拿手法,更能增强这种愉悦感,面部推拿和轻抚则更倾向于提高人的警觉性。此外,使用机械推拿设备进行的操作也能产生积极的情绪效应。推拿对伴有情绪障碍的疼痛患者具有缓解作用,这种作用主要与EEG中的δ波、θ波、α波和β波4种波形有关。详见表2。
3.2.3 基于脑电观察其他按摩设备 随着科技的进步,许多新型按摩设备被发明出来,也为患者提供了更加便利的操作方式。使用按摩椅可使人的注意力增加,并伴随β波、θ波增加以及δ波的减少。KERAUTRET等[74]发现,推拿手法与按摩椅都能增加额区和顶区的α波和β波振荡的神经同步,以放松人的情绪,且推拿手法能更好地减少肌肉疼痛和增加肌肉松弛。LIM等[75]在按摩椅的基础上增加脑部按摩仪,可更好地减轻人的精神疲劳,改善认知功能。CHANG等[76]实验结果揭示,在推拿手法的过程中左侧α波不对称指数增加,左右脑之间的联系增强,受试者产生了积极的情绪体验,同时也说明推拿手法引起的脑电活动能从大脑皮质传递至整个大脑,反之机械按摩会打断这种联系。推拿刺激诱发脑电的变化,主要表现为α波和β波活动下降,δ波活动增加,额叶脑电不对称性从右脑转移到左脑,从而产生放松和正向的情感效应。详见表3。
4 结语
EEG的应用反映了推拿治疗中脑区神经电生理活动的整体变化,与中医学的整体观相契合。EEG记录的大脑神经活动,可直观反映推拿治疗对疼痛引发的负面情绪的改善效果,通过监测推拿前后大脑活动的变化,客观评价其情绪调节作用。推拿通过影响神经兴奋与抑制的过程,特别是面部推拿和轻揉手法,能够激发人的警觉性,通过调节脑内GABA和NMDA等神经递质,影响突触传递,从而调节痛情绪。此外,EEG还可以进一步比较出不同推拿手法和力度的临床疗效差异,以优化推拿治疗方案,为临床提供精准指导。推拿作为可以改善情绪的一个重要标志就是EEG的改变。EEG研究显示,推拿可影响大脑皮质活动,增加δ波的活动,减少α波与β波的活动,产生愉悦、放松、镇静等效果,但其研究多集中于特定人群如健康成年人且缺乏长期效果评估,未来研究需扩大样本多样性,并建立长期跟踪机制。随着卷积神经网络等算法在EEG分析中的应用,能更深入地了解大脑的协同作用,再结合多通道记录和材料学的创新,推拿治疗的科学性和精准性将得到提升。这种结合EEG的推拿治疗,在未来可显著提高治疗效果。因此,将EEG用于观察推拿效应具有极大的应用潜力。
参考文献
[1] MATHARU M, KATSARAVA Z, BUSE D C, et al. Characterizing neck pain during headache among people with migraine: Multicountry results from the Chronic Migraine Epidemiology and Outcomes-International (CaMEO-I) cross-sectional study[J]. Headache, 2024, 64(7): 750-763.
[2] MARIANI WIGLEY I L C, BJ?魻RNSDOTTER M, SCHEININ N M, et al. Infants' sex affects neural responses to affective touch in early infancy[J]. Developmental Psychobiology, 2023, 65(7): e22419.
[3] YIN Z Y, SHUAIPAN S P, HE P, et al. Efficacy of Tuina in chronic low back pain with anxiety: Study protocol for a randomised controlled trial[J]. BMJ Open, 2023, 13(10): e073671.
[4] LEE S, MOON H, RYU Y, et al. Sensory and emotional responses to deep pressure stimulation at myofascial trigger points: A pilot study[J]. Frontiers in Neuroscience, 2023, 17: 1197302.
[5] 何 佩, 徐 可, 郭光昕, 等. 从“心脑同治, 腹背双调”探析焦虑症的推拿选穴思路[J]. 世界科学技术: 中医药现代化, 2021, 23(8): 2904-2911.
[6] SUN C Z, MOU C Z. Survey on the research direction of EEG-based signal processing[J]. Frontiers in Neuroscience, 2023, 17: 1203059.
[7] KIM J A, DAVIS K D. Neural oscillations: Understanding a neural code of pain[J]. The Neuroscientist, 2021, 27(5): 544-570.
[8] CAO J, ZHAO Y F, SHAN X C, et al. Brain functional and effective connectivity based on electroencephalography recordings: A review[J]. Human Brain Mapping, 2022, 43(2): 860-879.
[9] 李征宇, 孙兮文, 张效初, 等. 按揉委中穴对脑愉悦回路的影响[J]. 上海中医药大学学报, 2008, 22(4): 51-53.
[10] 黄红叶, 陈水金, 陈乐春, 等. 推拿“委中”穴对坐骨神经慢性压迫性损伤模型大鼠海马CA3区突触可塑性的影响[J]. 中医杂志, 2024, 65(15): 1602-1610.
[11] 张 昊. 基于“通则不痛”推拿镇痛效应的中枢下行抑制调控机制研究[D]. 上海: 上海中医药大学, 2014.
[12] PITTENGER C, DUMAN R S. Stress, depression, and neuroplasticity: A convergence of mechanisms[J]. Neuropsychopharmacology, 2008, 33(1): 88-109.
[13] CHEN H C, BLEIMEISTER I H, NGUYEN E K, et al. The functional and anatomical characterization of three spinal output pathways of the anterolateral tract[J]. Cell Reports, 2024, 43(3): 113829.
[14] ATTA A A, IBRAHIM W W, MOHAMED A F, et al. Microglia polarization in nociplastic pain: Mechanisms and perspectives[J]. Inflammopharmacology, 2023, 31(3): 1053-1067.
[15] DENG J, ZHOU H, LIN J K, et al. The parabrachial nucleus directly channels spinal nociceptive signals to the intralaminar thalamic nuclei, but not the amygdala[J]. Neuron, 2020, 107(5): 909-923.e6.
[16] ZHU X, TANG H D, DONG W Y, et al. Distinct thalamocortical circuits underlie allodynia induced by tissue injury and by depression-like states[J]. Nature Neuroscience, 2021, 24(4): 542-553.
[17] SELLMEIJER J, MATHIS V, HUGEL S, et al. Hyperactivity of anterior cingulate cortex areas 24a/24b drives chronic pain-induced anxiodepressive-like consequences[J]. The Journal of Neuroscience, 2018, 38(12): 3102-3115.
[18] ZHUO M. Neural mechanisms underlying anxiety-chronic pain interactions[J]. Trends in Neurosciences, 2016, 39(3): 136-145.
[19] 曾珊珊, 伍大华, 谢 乐, 等. 慢性疼痛引起的负性情绪变化及相关脑环路研究[J]. 神经解剖学杂志, 2023, 39(1): 111-114.
[20] 陈栋洋, 韩庆荣, 盛海燕. 脊髓以上水平疼痛相关神经通路机制的研究进展[J]. 生理学报, 2023, 75(3): 475-485.
[21] JIANG H, LIU J P, XI K, et al. Contribution of AMPA receptor-mediated LTD in LA/BLA-CeA pathway to comorbid aversive and depressive symptoms in neuropathic pain[J]. The Journal of Neuroscience, 2021, 41(34): 7278-7299.
[22] CHEN F X, CAI J W, DAI L S, et al. Altered hippocampal functional connectivity after the rupture of anterior communicating artery aneurysm[J]. Frontiers in Aging Neuroscience, 2022, 14: 997231.
[23] 李 威, 刘志文, 曾佳玉, 等. 海马小胶质细胞在小鼠慢性炎性痛所致负性情绪中的形态变化[J]. 解剖学报, 2021, 52(3): 352-357.
[24] 杜金乐, 王振玉, 康 鑫, 等. 疼痛伴发焦虑抑郁情绪变化与小鼠内侧前额叶和前扣带回皮质神经元激活的时程性关系研究[J]. 空军军医大学学报, 2023, 44(11): 1034-1040.
[25] 王 英, 岳广欣, 梁 媛. 慢性疼痛与抑郁症的共同病理机制[J]. 中国疼痛医学杂志, 2023, 29(5): 366-370.
[26] SATO G, OSUMI M, MIKAMI R, et al. Long-term physical therapy for neuropathic pain after cervical spinal cord injury and resting state electroencephalography: A case report[J]. Spinal Cord Series and Cases, 2022, 8(1): 41.
[27] 王飞宇, 吴松涛, 王 璟. 疼痛与大脑活动的关系: 基于脑电图的研究[J]. 中国疼痛医学杂志, 2013, 19(7): 420-424.
[28] CANDIA-RIVERA D, NOROUZI K, RAMS?覫Y T Z, et al. Dynamic fluctuations in ascending heart-to-brain communication under mental stress[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2023, 324(4): R513-R525.
[29] ZEBHAUSER P T, HOHN V D, PLONER M. Resting-state electroencephalography and magnetoencephalography as biomarkers of chronic pain: A systematic review[J]. Pain, 2023, 164(6): 1200-1221.
[30] LIBERATI G, ALGOET M, SANTOS S F, et al. Tonic thermonociceptive stimulation selectively modulates ongoing neural oscillations in the human posterior insula: Evidence from intracerebral EEG[J]. NeuroImage, 2019, 188: 70-83.
[31] MUJIB M D, RAO A Z, HASAN M A, et al. Comparative neurological and behavioral assessment of central and peripheral stimulation technologies for induced pain and cognitive tasks[J]. Biomedicines, 2024, 12(6): 1269.
[32] 李春波, 吴文源, 何康梅, 等. 焦虑症患者心理生理学反应研究[J]. 中国心理卫生杂志, 2000, 14(5): 337-340.
[33] LI X H, MATSUURA T, XUE M, et al. Oxytocin in the anterior cingulate cortex attenuates neuropathic pain and emotional anxiety by inhibiting presynaptic long-term potentiation[J]. Cell Reports, 2021, 36(3): 109411.
[34] 刘潇雅, 刘 爽, 郭冬月, 等. 抑郁症脑电特异性研究进展[J]. 中国生物医学工程学报, 2020, 39(3): 351-361.
[35] LI L L, WANG P, LI S F, et al. Construction of a resting EEG-based depression recognition model for college students and possible mechanisms of action of different types of exercise[J]. BMC Psychiatry, 2023, 23(1): 849.
[36] CHILVER M R, KELLER A S, PARK H R P, et al. Electroencephalography profiles as a biomarker of wellbeing: A twin study[J]. Journal of Psychiatric Research, 2020, 126: 114-121.
[37] 张家铭, 刘丹阳, 钟冬灵, 等. 基于CiteSpace的脑电图诊断抑郁症可视化分析的特异性研究[J]. 生物医学工程学杂志, 2021, 38(5): 919-931.
[38] MEERWIJK E L, FORD J M, WEISS S J. Resting-state EEG delta power is associated with psychological pain in adults with a history of depression[J]. Biological Psychology, 2015, 105: 106-114.
[39] BASKARAN A, FARZAN F, MILEV R, et al. The comparative effectiveness of electroencephalographic indices in predicting response to escitalopram therapy in depression: A pilot study[J]. Journal of Affective Disorders, 2018, 227: 542-549.
[40] BARTHAS F, SELLMEIJER J, HUGEL S, et al. The anterior cingulate cortex is a critical hub for pain-induced depression[J]. Biological Psychiatry, 2015, 77(3): 236-245.
[41] EHLERS C L, WILLS D, KARRIKER-JAFFE K J, et al. Event-related oscillations to emotional faces are related to a history of internalizing disorders[J]. Clinical EEG and Neuroscience, 2023, 54(4): 420-433.
[42] 姜方洁, 付 玉, 吴桂生, 等. 应激诱导小鼠杏仁核theta波段下调介导焦虑反应[J]. 广西师范大学学报(自然科学版), 2016, 34(1): 162-167.
[43] HUANG M H, FAN S Y, LIN I M. EEG coherences of the fronto-limbic circuit between patients with major depressive disorder and healthy controls[J]. Journal of Affective Disorders, 2023, 331: 112-120.
[44] RAJAN J, GAUR G S, SHANMUGAVEL K, et al. Relation between heart rate variability and spectral analysis of electroencephalogram in chronic neuropathic pain patients[J]. The Korean Journal of Physiology & Pharmacology, 2024, 28(3): 253-264.
[45] 周秀芳, 李 燕, 张 蓉, 等. 柴芩升降散加味汤结合心理疗法对广泛性焦虑症患者脑电波的影响[J]. 中国实验方剂学杂志, 2012, 18(23): 305-307.
[46] WANG H C, HOU Y, ZHAN S Q, et al. EEG biofeedback decreases Theta and beta power while increasing alpha power in insomniacs: An open-label study[J]. Brain Sciences, 2023, 13(11): 1542.
[47] 肖 平. 疼痛诱发脑电响应的挖掘和应用[D]. 重庆: 西南大学, 2014.
[48] VON MOHR M, CROWLEY M J, WALTHALL J, et al. EEG captures affective touch: CT-optimal touch and neural oscillations[J]. Cognitive, Affective & Behavioral Neuroscience, 2018, 18(1): 155-166.
[49] HAWKINS R D. The contributions and mechanisms of changes in excitability during simple forms of learning in Aplysia[J]. Neurobiology of Learning and Memory, 2019, 164: 107049.
[50] ZHUO M. Ionotropic glutamate receptors contribute to pain transmission and chronic pain[J]. Neuropharmacology, 2017, 112(Pt A): 228-234.
[51] SILOTE G P, DE OLIVEIRA S F S, RIBEIRO D E, et al. Ketamine effects on anxiety and fear-related behaviors: Current literature evidence and new findings[J]. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 2020, 100: 109878.
[52] CHA?覵UPNIK P, SZYMA■SKA E. Kainate receptor antagonists: Recent advances and therapeutic perspective[J]. International Journal of Molecular Sciences, 2023, 24(3): 1908.
[53] NUSS P. Anxiety disorders and GABA neurotransmission: A disturbance of modulation[J]. Neuropsychiatric Disease and Treatment, 2015, 11: 165-175.
[54] LEGARRETA M D, SHETH C, PRESCOT A P, et al. An exploratory proton MRS examination of gamma-aminobutyric acid, glutamate, and glutamine and their relationship to affective aspects of chronic pain[J]. Neuroscience Research, 2021, 163: 10-17.
[55] 刘志凤, 焦 谊, 于天源, 等. 中医推拿的镇痛机制近十年研究进展[J]. 环球中医药, 2022, 15(3): 526-530.
[56] 裴宝顺. “以痛为腧”按揉法对BPI大鼠的疼痛及脑内奖赏系统相关区域GABA和DA的影响[D]. 上海: 上海中医药大学, 2020.
[57] 陈晓琴, 骆 勇, 陈志强, 等. 电针结合推拿治疗坐骨神经痛的临床疗效观察[J]. 世界中医药, 2016, 11(3): 515-518.
[58] DIEGO M A, FIELD T, SANDERS C, et al. Massage therapy of moderate and light pressure and vibrator effects on EEG and heart rate[J]. The International Journal of Neuroscience, 2004, 114(1): 31-44.
[59] 张 娟, 王艳国. 触觉刺激对大脑影响机制的研究进展[J]. 磁共振成像, 2018, 9(10): 791-795.
[60] VAN EDE F, JENSEN O, MARIS E. Tactile expectation modulates pre-stimulus beta-band oscillations in human sensorimotor cortex[J]. NeuroImage, 2010, 51(2): 867-876.
[61] MICHAIL G, DRESEL C, WITKOVSKY V, et al. Neuronal oscillations in various frequency bands differ between pain and touch[J]. Frontiers in Human Neuroscience, 2016, 10: 182.
[62] SHIMOJU R. Cortical theta oscillations and 50-kHz ultrasonic vocalizations in response to tactile reward indicate positive emotion in rats[J]. Neuroscience Letters, 2023, 810: 137328.
[63] KUC A, SKOROKHODOV I, SEMIRECHENKO A, et al. Oscillatory responses to tactile stimuli of different intensity[J]. Sensors, 2023, 23(22): 9286.
[64] FIELD T. Massage therapy research review[J]. Complementary Therapies in Clinical Practice, 2016, 24: 19-31.
[65] FIELD T, IRONSON G, SCAFIDI F, et al. Massage therapy reduces anxiety and enhances EEG pattern of alertness and math computations[J]. The International Journal of Neuroscience, 1996, 86(3/4): 197-205.
[66] BASTIAANSEN M C, B?CKER K B, BRUNIA C H, et al. Event-related desynchronization during anticipatory attention for an upcoming stimulus: A comparative EEG/MEG study[J]. Clinical Neurophysiology, 2001, 112(2): 393-403.
[67] NUNEZ P L. Toward a quantitative description of large-scale neocortical dynamic function and EEG[J]. The Behavioral and Brain Sciences, 2000, 23(3): 371-437.
[68] JONES N A, FIELD T. Massage and music therapies attenuate frontal EEG asymmetry in depressed adolescents[J]. Adolescence, 1999, 34(135): 529-534.
[69] FIELD T. Massage therapy research review[J]. Complementary Therapies in Clinical Practice, 2014, 20(4): 224-229.
[70] KAEWCUM N, SIRIPORNPANICH V. The effects of unilateral Swedish massage on the neural activities measured by quantitative electroencephalography (EEG)[J]. Journal of Health Research, 2018, 32(1): 36-46.
[71] NAKANO H, KODAMA T, UEDA T, et al. Effect of hand and foot massage therapy on psychological factors and EEG activity in elderly people requiring long-term care: A randomized cross-over study[J]. Brain Sciences, 2019, 9(3): 54.
[72] BUTTAGAT V, EUNGPINICHPONG W, KABER D, et al. Acute effects of traditional Thai massage on electroencephalogram in patients with scapulocostal syndrome[J]. Complementary Therapies in Medicine, 2012, 20(4): 167-174.
[73] LI H H, FAN K, MA J S, et al. Massage therapy's effectiveness on the decoding EEG rhythms of left/right motor imagery and motion execution in patients with skeletal muscle pain[J]. IEEE Journal of Translational Engineering in Health and Medicine, 2021, 9: 2100320.
[74] KERAUTRET Y, GUILLOT A, DALIGAULT S, et al. Foam rolling elicits neuronal relaxation patterns distinct from manual massage: A randomized controlled trial[J]. Brain Sciences, 2021, 11(6): 818.
[75] LIM J H, KIM H, JEON C, et al. The effects on mental fatigue and the cognitive function of mechanical massage and binaural beats (brain massage) provided by massage chairs[J]. Complementary Therapies in Clinical Practice, 2018, 32: 32-38.
[76] CHANG K M, LUO S Y, CHEN S H, et al. Body massage performance investigation by brain activity analysis[J]. Evidence-Based Complementary and Alternative Medicine, 2012,
