低温弱光胁迫下茄子幼苗实时荧光定量PCR内参基因的筛选与评价
2024-11-21林珲裘波音朱海生温庆放






摘要:为了探索茄子Solanum melongena L.的基因表达模式,利用qRT-PCR方法分析了茄子ACT、EF1α、TUA、TUB、GAPDH、eIF、UBQ、UBI3、PP2A、CYP、RPL28、L25、SAND、TBP、DNAJ、APRT、EXP、CAC、HSP20和CysPro 20个候选内参基因mRNA的表达差异情况,并运用GeNorm、NormFinder和BestKeeper 3种计算方法评价茄子20个候选内参基因在低温、弱光、低温弱光叶片样品中的表达稳定性。结果表明:茄子20个候选内参基因荧光定量引物扩增效率(E)数值在96.8%~117.6%,相关系数(R2)介于0.968 8~0.999 9,扩增效率良好,扩增反应具有高度的专一性,引物能特异性扩增,特异性好,均为单峰,样品间扩增曲线重复性强,可用于qRT-PCR扩增。茄子20个候选内参基因CT值表达丰度分析,发现茄子20个候选内参基因平均CT值在19.76~31.20。3种计算方法的综合评价分析结果显示,TBP基因在所有样本中为最稳定的内参基因。研究可为茄子低温、弱光和低温弱光胁迫下基因特异性表达研究提供了合适的内参基因。
关键词:茄子;内参基因;实时荧光定量PCR;标准化;基因表达
中图分类号:S641.1文献标志码:A文章编号:0253−2301(2024)08−0001−15
DOI:10.13651/j.cnki.fjnykj.2024.08.001
林珲,裘波音,朱海生,等.低温弱光胁迫下茄子幼苗实时荧光定量PCR内参基因的筛选与评价[J].福建农业科技,2024,55(8):01−15.
优秀学者论坛
温庆放,1965年生,二级研究员,福建省百千万人才,福建省农业科学院作物研究所党支部书记、所长,主要从事蔬菜育种与栽培研究。主持或参与了多项国家科技计划、福建省重大科技专项、福建省种业产业化工程项目等蔬菜重大科技项目;获福建省科技进步奖二等奖2项(排名第1)、三等奖1项(排名第1),参与获得福建省科技进步奖一等奖1项(排名第5)、二等奖3项(排名分列为2、3、6名);主持或参与育成蔬菜品种20多个通过国家品种登记或省认(鉴)定;授权国家发明专利5件;发表论文130多篇,其中SCI收录8篇;编著出版蔬菜专著7部。现任或兼任国家大宗蔬菜产业技术体系福州综合试验站站长、福建省蔬菜遗传育种重点实验室主任、福建省蔬菜工程技术研究中心主任、福建省园艺学会副理事长。
Screening and Evaluation of Reference Genes in Eggplant Seedlings by Real-time Fluorescence Quantitative PCR Under Low Temperature and Weak Light Stress
LIN Hui,QIU Bo-yin,ZHU Hai-sheng*,WEN Qing-fang*
(Fujian Key Laboratory of Vegetable Genetics and Breeding/Fujian Engineering Research Center for Vegetables/Crops Research Institute,Fujian Academy of Agricultural Sciences,Fuzhou,Fujian 350013,China)
Abstract:In order to explore the gene expression pattern of Solanum melongena L.,the qRT-PCR method was used to analyze the expression differences of mRNA in the 20 candidate reference genes of eggplant,including ACT,EF1α,TUA,TUB,GAPDH,eIF,UBQ,UBI3,PP2A,CYP,RPL28,L25,SAND,TBP,DNAJ,APRT,EXP,CAC,HSP20 and CysPro.The three calculation methods,including GeNorm,NormFinder and BestKeeper,were used to evaluate the expression stability of 20 candidate reference genes in eggplant samples at low temperature,weak light and low temperature and weak light stress.The results showed that the fluorescence quantitative primer amplification efficiency(E)values of 20 candidate reference genes in eggplant ranged from 96.8%to 117.6%,and the correlation coefficient(R2)was between 0.968 8−0.999 9,indicating that the amplification efficiency was good,and the amplified reaction was highly specific.The primers could be specifically amplified,with good specificity,all of which were unimodal.The amplification curves among the samples had strong repeatability,which could be used for qRT-PCR amplification.By analyzing the expression abundance of CT values of 20 candidate reference genes in eggplant,it was found that the average CT values of 20 candidate reference genes in eggplant ranged from 19.76 to 31.20.The comprehensive evaluation results of the three calculation methods showed that the TBP gene was the most stable reference gene in all the samples.The study could provide a suitable reference gene for the study of gene-specific expression in eggplant under low temperature stress,weak light stress and low temperature and weak light stress.
Key words:Eggplant(Solanum melongena L.);Reference gene;Quantitative real-time PCR;Standardization;Gene expression
茄子作为茄科茄属的一种重要蔬菜,深受消费者喜爱,在我国各地广泛种植[1]。它不仅富含多种膳食纤维、矿物质、蛋白质、酚类等营养物质,还含有丰富的维生素P和高水平抗氧化的有效成分[2−3]。茄子是喜温蔬菜,而福建地处亚热带地区,热量丰富,气候温暖,十分适宜茄子生长。近年来,随着交通运输和设施大棚的发展,茄子凭借其高经济价值和简单的栽培管理,已经成为福建省蔬菜的支柱产业之一[4]。温度和光照是绿色植物生长发育中重要的环境因素[5]。然而,福建冬季和初春,茄子在生产过程中极易受到低温和连续阴雨天气的影响,导致落花、落果、畸形果等现象频发,造成大面积减产,经济损失巨大[1]。因此,深入探究茄子对低温弱光胁迫的响应,制定一套适用于低温弱光环境的茄子栽培管理技术,并培育耐低温弱光的茄子品种,对福建茄子产业的发展具有重大意义。目前,尽管学者对茄子低温弱光胁迫的研究已取得一定进展,但大多停留在生理水平,其在分子层面上的发生机理仍有待进一步阐明。挖掘耐寒关键基因,阐明其调控机制,对于茄子的安全高效生产以及耐寒种质创制具有重要意义。因此,准确检测茄子在低温弱光胁迫下的基因表达量,成为当下亟待开展的研究。
实时荧光定量PCR(Quantitative Real-Time PCR,qRT-PCR)是分析茄子幼苗低温、弱光、低温弱光非生物胁迫下功能基因表达量的一种有效的试验方法,具有重复性好、灵敏度高、特异性强、对靶基因有高通量等特性[6−9]。为了获得准确的基因表达数据,在试验过程中要尽量避免由于引物设计、cDNA转录、PCR扩增等因素造成表达水平的偏差[10−13]。使用内参基因对目的基因表达数据进行标准化,是矫正偏差的重要手段[14]。理想的内参基因是在不同试验处理、不同组织、不同发育阶段等条件下都能一致表达的基因。
看家基因在维持细胞基本生命活动过程中保守性高,受到环境的影响较小[15]。因此,看家基因GAPDH[16]、UBQ[17]、TUB[18]、ACT[19]等被广泛的应用于不同植物在各种试验条件下的基因表达分析。然而,这些基因作为内参基因的适用性并非绝对,其稳定性在不同植物和试验条件下有所差异。在单子叶植物短柄厥内参基因筛选中,GAPDH基因被认为不适合作为内参基因[20],但在虎耳草激素处理的试验中,GAPDH基因却是表达最为稳定的基因[16];在双子叶植物中,UBQ10基因在珊瑚菜中表达最为活跃[21],而在大青杨中却被鉴定为最佳内参基因[17];在管状花目植物中,TUB基因在芝麻不同发育阶段的营养组织中表达稳定性最高[18],但在番茄的TOCMOV致病系统研究中则不建议被作为内参基因使用[22];在茄科植物夜香树(夜来香)中,ACT基因在花和叶的内参基因的评价中表达最为稳定[19],但在辣椒的非生物胁迫和激素处理试验中,ACT则为最不稳定的基因之一[23]。此外,一些编码细胞分化的基因,如PP2A[24]、CYP[25]、EXP[21]等,也常常被作为内参基因使用[26]。在茄属植物的内参基因评价中,PP2A基因在番茄的氮胁迫、低温和光胁迫下是最稳定基因[24],而在病毒侵染烟草基因表达变化的研究中,PP2A基因的表达稳定性是最差的基因之一[27]。因此,针对不同植物的不同试验条件,筛选合适的内参基因尤为重要。
茄子内参基因的筛选已取得了一些初步的进展[28−32]。在茄子花芽、花、成熟叶、嫩叶、茎和根等组织的内参基因的筛选研究中,18S rRNA被鉴定为最适合内参基因[28];在茄子不同组织以及不同植物生长调节剂、生物胁迫、干旱、盐处理下,TUA基因表达稳定性最好[29];在茄子果实的不同发育阶段及不同品种研究中,SAND基因被认为是最佳内参基因[30];在茄子高温胁迫下,EF1α基因表达稳定性最高[29]。可见,内参基因的表达水平在不同的试验条件下不是稳定不变的。茄子在低温、弱光、低温弱光胁迫下内参基因的研究尚待深入。在特定的试验条件下,筛选合适的内参基因是试验顺利进行的先决条件。为了在低温、弱光、低温弱光处理下研究参与3个胁迫的功能基因及转录因子,有必要筛选对各个具体试验条件下最佳的内参基因来对荧光定量PCR试验数据进行校正,这将促进茄子在基因表达水平的研究。
本研究选择了茄子在低温胁迫、弱光胁迫、低温弱光胁迫下的样品,利用qRT-PCR方法分析了ACT、EF1α、TUA、TUB、GAPDH、eIF、UBQ、UBI3、PP2A、CYP、RPL28、L25、SAND、TBP、DNAJ、APRT、EXP、CAC、HSP20和CysPro这20个植物常用的候选基因mRNA的表达差异情况,并运用GeNorm[31]、NormFinder[32]和Best-Keeper[33]3种计算方法对检测结果中候选内参基因表达稳定性进行评价,旨在筛选适宜低温弱光胁迫下茄子基因表达分析的内参基因,为茄子相关基因表达研究奠定基础。
1材料与方法
1.1试验材料
选用对低温弱光反应不同的两个茄子材料:耐低温弱光品系epl008和低温弱光敏感品系eplck。
1.2试验设计
试验在福建省蔬菜遗传育种重点实验室中进行。饱满的种子用3%次氯酸钠表面灭菌10 min,用蒸馏水清洗3次,再用蒸馏水浸泡12 h,用湿纱布包起然后放入带湿滤纸的培养皿中,在28℃黑暗中发芽。3 d后,将萌发的种子播种在装有育苗基质的干净穴盘中,转移到16h光照(28℃)/8 h暗周期、光合光子通量密度为300µmol·m−2·s−1、相对湿度为80%的条件下的气候室中[30,35]。
本试验共设置6个处理:(1)采集耐低温弱光材料epl008在低温处理下0、3、6、12、24和48 h的叶片。(2)采集耐低温弱光材料epl008在弱光处理下0、3、6、12、24和48 h的叶片。(3)采集耐低温弱光材料epl008在低温弱光处理下0、3、6、12、24和48 h的叶片。(4)采集低温弱光敏感材料eplck在低温处理下0、3、6、12、24和48 h的叶片。(5)采集低温弱光敏感材料eplck在弱光处理下0、3、6、12、24和48 h的叶片。(6)采集低温弱光敏感材料eplck在低温弱光处理下0、3、6、12、24和48 h的叶片。收集的茄子样品用锡箔纸包裹液氮速冻置于超低温冰箱存放,备用。每个样品来自3株植物处理作为生物复制处理,试验设计3个生物学重复。
1.3总RNA提取和cDNA的获得
RNA提取按照通用植物总RNA提取试剂盒中的试验手册进行(中国北京,百泰克)。用1%(w/v)琼脂糖凝胶电泳检测所提RNA的完整性,用美国Thermo Fisher Science公司的Nano-Drop™8 000分光光度计测定RNA浓度和纯度。A260/A280比值在1.9~2.1和A260/A230大于1.80的RNA样品才用于cDNA合成。cDNA根据制造商(Takara)的说明,在20µL的反应系统中,使用HiScript II Q RT SuperMix for qPCR(+gDNA wiper)(Takara)合成cDNA。每个样品所需的RNA用量,根据所提取的RNA浓度确定其比例,以确保每个组织样品的mRNA含量保持一致。
1.4内参基因筛选和引物设计
茄子20个候选内参基因ACT、EF1-α、TUA、TUB、GAPDH、eIF、UBQ、UBI3、PP2A、CYP、RPL28、L25、SAND、TBP、DNAJ、APRT、EXP、CAC、HSP20.2和CysPro的筛选,参考前人在茄科茄属蔬菜和其他作物研究成果[28−49](表1)。根据已有的茄子全基因组RNA-seq数据库(http://eggplant.kazusa.or.jp/index.html),筛选得到20条基因全长序列。根据引物设计原则,利用软件Premier 5.0设计荧光定量试验所需引物(表1)。引物检测反应程序为:94℃预变性3 min;94℃变性30 s,52℃退火30 s,2℃延伸30 s,35个循环;72℃延伸7 min。反应体系20.0μL:包括10×PCR buffer(含Mg2+)2.0μL、Primer F(10μmol·L−1)1.0μL、Primer R(10μmol·L−1)1.0μL、dNTP(10 mmol·L−1)1.0μL、Taq(5 U)0.2μL、cDNA 2.0μL、ddH2O 12.8μL。
1.5内参基因荧光定量PCR扩增
用稀释10倍的cDNA模板生成标准曲线斜率(slope),用E=(10-1/slope–1)×100%计算每个候选内参基因的扩增效率,以R2预测标准曲线回归方程的可靠性,进行3次重复。采用SYBR Green染料法,荧光定量PCR试验按照SYBR Premix Ex Taq TM试剂盒TaKaRa公司操作说明书进行,在7 500 Real Time System仪[ABI(美国)公司]上完成,每个样品设3次重复。反应体系10μL,包括2×SYBR Premix EXTaqTM 5μL、Primer F(10μmol·L−1)0.4μL、Primer R(10μmol·L−1)0.4μL、ROX Reference Dye(10μmol·L−1)0.2μL、cDNA 2.0μL、ddH2O 2.0μL。PCR扩增反应程序:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环。扩增完成后进行溶解曲线分析,溶解曲线程序:95℃15 s,60℃1 min,95℃15 s。分析溶解曲线确定每对扩增引物的特异性。
1.6数据分析
利用GeNorm、NormFinder和BestKeeper法分析20个候选内参基因稳定性。将qRT-PCR获得数据导出至Microsoft Excel 2003中,并根据软件要求对循环阈值(cycle threshold,CT)进行转换。每个软件产生候选内参基因稳定性的度量值,可用于对内参基因稳定性排序。最后,用几何平均值综合评价3种计算方法,生成最终排序表。
2结果与分析
2.1内参基因引物检测
茄子20个候选内参基因荧光定量引物扩增效率(E)数值在96.8%~117.6%,相关系数(R2)介于0.968 8~0.999 9(表2),表明引物扩增效率良好,可用于qRT-PCR试验。利用普通PCR对内参基因特异性进行检测(图1),结果表明20个内参基因扩增产物在100~250 bp,条带单一,大小与目标片段相同,说明扩增反应具有高度的专一性,引物能特异性扩增,未出现引物二聚体,适用于qRT-PCR研究。以茄子叶片cDNA为模板,经qRT-PCR扩增,对候选内参基因的引物溶解曲线分析(图2),结果表明20个候选内参基因引物特异性好,均为单峰,样品间扩增曲线重复性强,说明CDNA模板可进行差异性扩增,qRT-PCR结果可信度高。
2.2茄子20个候选内参基因CT值表达丰度分析
茄子20个候选内参基因平均CT值在19.76~31.20(图3)。根据CT值计算候选内参基因表达水平,候选内参基因在耐低温弱光品系epl008和低温弱光敏感品系eplck低温胁迫、弱光胁迫和低温弱光胁迫处理条件下基因表达水平不同。内参基因的表达丰度通过CT值来体现,一般来说,CT值越低表达丰度越高。由图3可知,内参基因CYP的表达丰度(19.76±4.02)较其他内参基因高,其次是TUA基因的表达丰度,为20.46±3.53。20个内参基因中,GAPDH基因在耐低温弱光品系epl008和低温弱光敏感品系eplck低温胁迫、弱光胁迫和低温弱光胁迫处理条件下的变化范围最大为31.20±4.07,SAND基因变化范围最小,范围为25.61±0.12。
2.3茄子内参基因的筛选
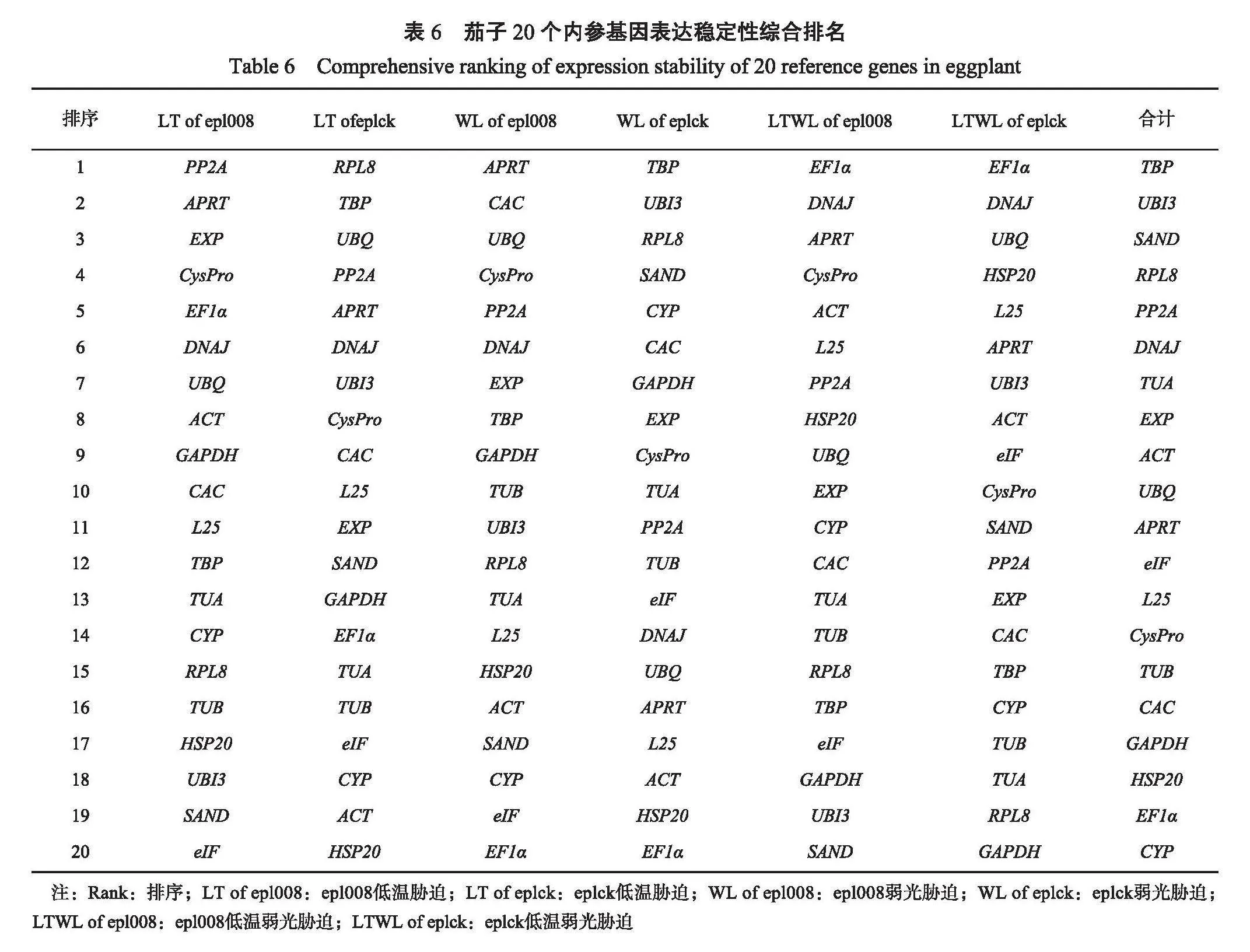
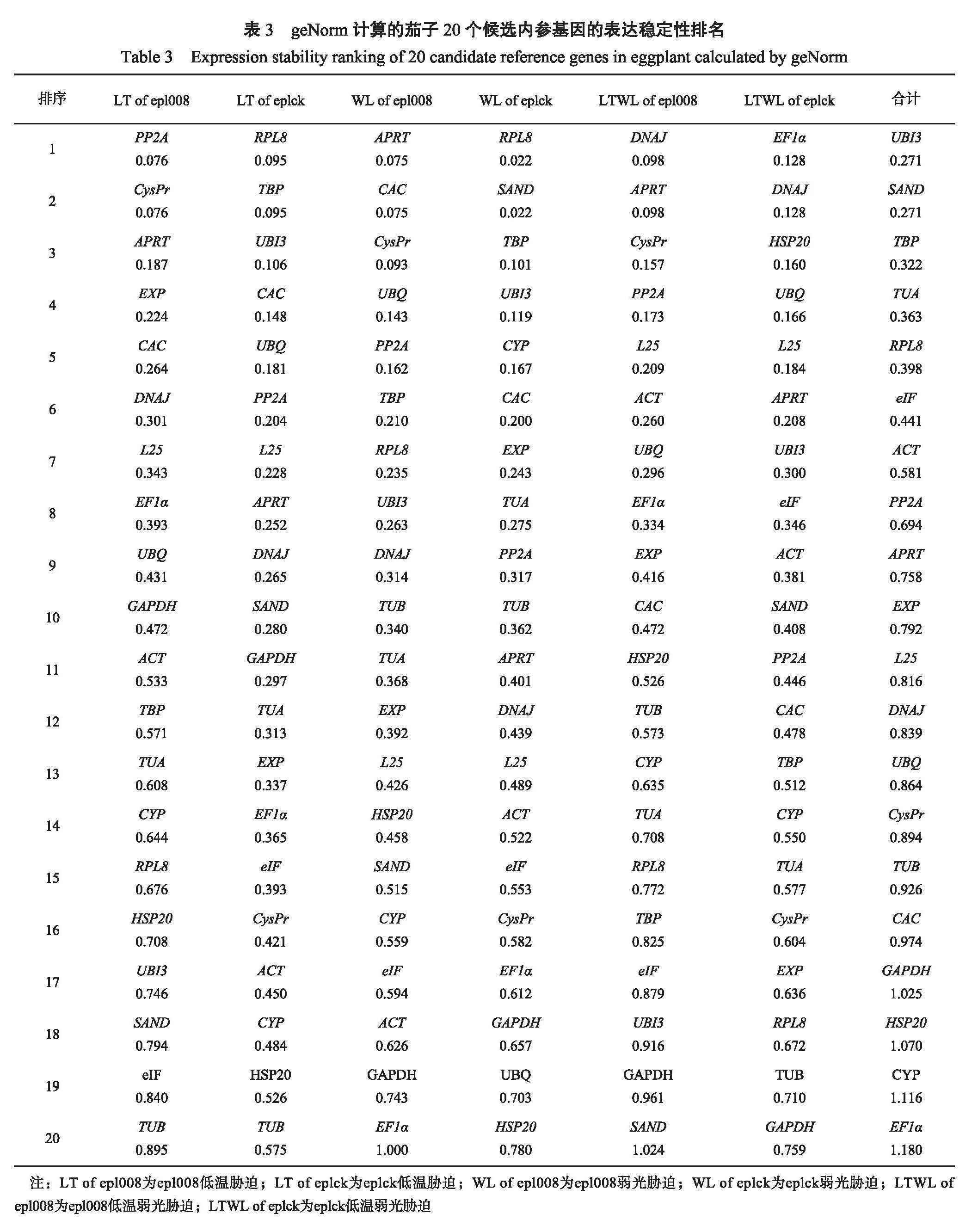
2.3.1 GeNorm软件分析在GeNorm软件分析中,通常以平均变异度(M)作为衡量内参基因稳定与否的标准,M越小,稳定性越好;反之,M越大,稳定性越差。学者们在分析中默认的M阈值为1.5。GeNorm软件的分析结果(表3)表明,20个内参基因不同处理中的表达稳定性不同。以低温胁迫的茄子epl008叶片为材料时,内参基因的M由低到高依次为PP2A=CysPr<APRT<EXP<CAC<DNAJ<L25<EF-1α<UBQ<GAPDH<ACT<TBP<TUA<CYP<RPL8<HSP20<UBI3<SAND<eIF<TUB;以低温胁迫的茄子eplck叶片为供试材料时,内参基因的M由低到高依次为RPL8=TBP<UBI3<CAC<UBQ<PP2A<L25<APRT<DNAJ<SAND<GAPDH<TUA<EXP<EF-1α<eIF<CysPr<HSP20<TUB;以弱光胁迫的茄子epl008叶片为材料时,内参基因的M由低到高依次为APRT=CAC<CysPr<UBQ<PP2A<TBP<RPL8<UBI3<DNAJ<TUB<TUA<EXP<L25<HSP20<SAND<CYP<eIF<ACT<GAPAH<EF-1α;以弱光胁迫的茄子eplck叶片为材料时,内参基因的M由低到高依次为RPL8=SAND<TBP<UBI3<CYP<CAC<EXP<TUA<PP2A<TUB<APRT<DNAJ<L25<ACT<eIF<CysPr<EF-1α<GAPAH<UBQ<HSP20。以低温弱光双重胁迫的茄子epl008叶片为材料时,内参基因的M由低到高依次为DNAJ=APRT<CysPr<PP2A<L25<ACT<UBQ<EF-1α<EXP<CAC<HSP20<TUB<CYP<TUA<RPL8<TBP<eIF<UBI3<GAPDH<SAND;以低温弱光双重胁迫的茄子eplck叶片为材料时,内参基因的M由低到高依次为EF-1α=DNAJ<HSP20<UBQ<L25<APRT<UBI3<eIF<ACT<SAND<PP2A<CAC<TBP<CYP<TUA<CysPr<EXP<R PL8<TUB<GAPDH;在茄子所有样本胁迫中,内参基因的M由低到高依次为UBI3=SAND<TBP<TUA<RPL8<eIF<ACT<PP2A<APRT<EXP<L25<DNAJ<UBQ<CysPr<TUB<CAC<G APDH<HSP20<CYP<EF-1α。茄子epl008叶片在低温胁迫下,PP2A和CysPr的M最小,稳定性最高,TUB的M最大,稳定性最差;茄子eplck叶片在低温胁迫下,RPL8和TBP的M最小,稳定性最高,TUB的M最大,稳定性最差;茄子epl008叶片在弱光胁迫下,APRT和CAC的M最小,稳定性最好,其次是CysPr,EF-1α的M最大,稳定性最差;茄子eplck叶片在弱光胁迫下,RPL8和SAND的M最小,稳定性最高,其次是TBP,HSP20的M最大,稳定性最差;茄子epl008叶片在低温弱光双重胁迫下,DNAJ和APRT的M最小,稳定性最高,SAND的M最大,稳定性最差;茄子eplck叶片在低温弱光双重胁迫下,EF-1α和DNAJ的M最小,稳定性最高,GAPDH的M最大,稳定性最差;在所有样品胁迫下,UBI3和SAND的M最小,稳定性最高,EF-1α的M最大,稳定性最差。
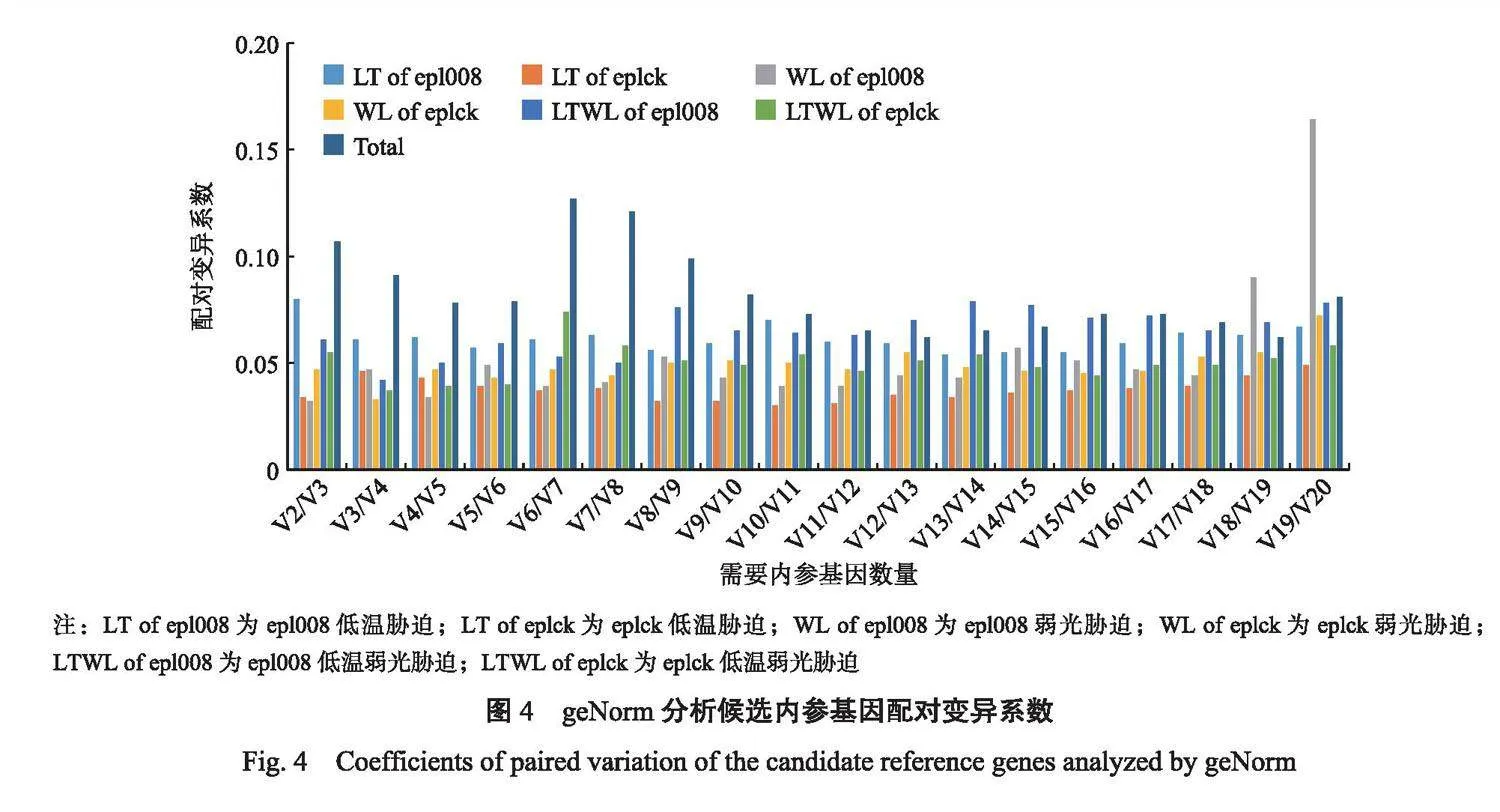
根据GeNorm软件得到的默认变异系数(VN/VN+1)确认最适内参基因数目。0.15为程序默认的阈值,VN/VN+1<0.15时,则认为最佳的内参基因数为N个。茄子epl008叶片在低温胁迫,茄子eplck叶片在低温胁迫,茄子epl008叶片在弱光胁迫,茄子eplck叶片在弱光胁迫,茄子epl008叶片在低温弱光胁迫、茄子eplck叶片在低温弱光胁迫和在所有样本处理下,V2/V3均低于0.15,表明在这些处理中,2个参考基因即可获得准确的结果(图4)。
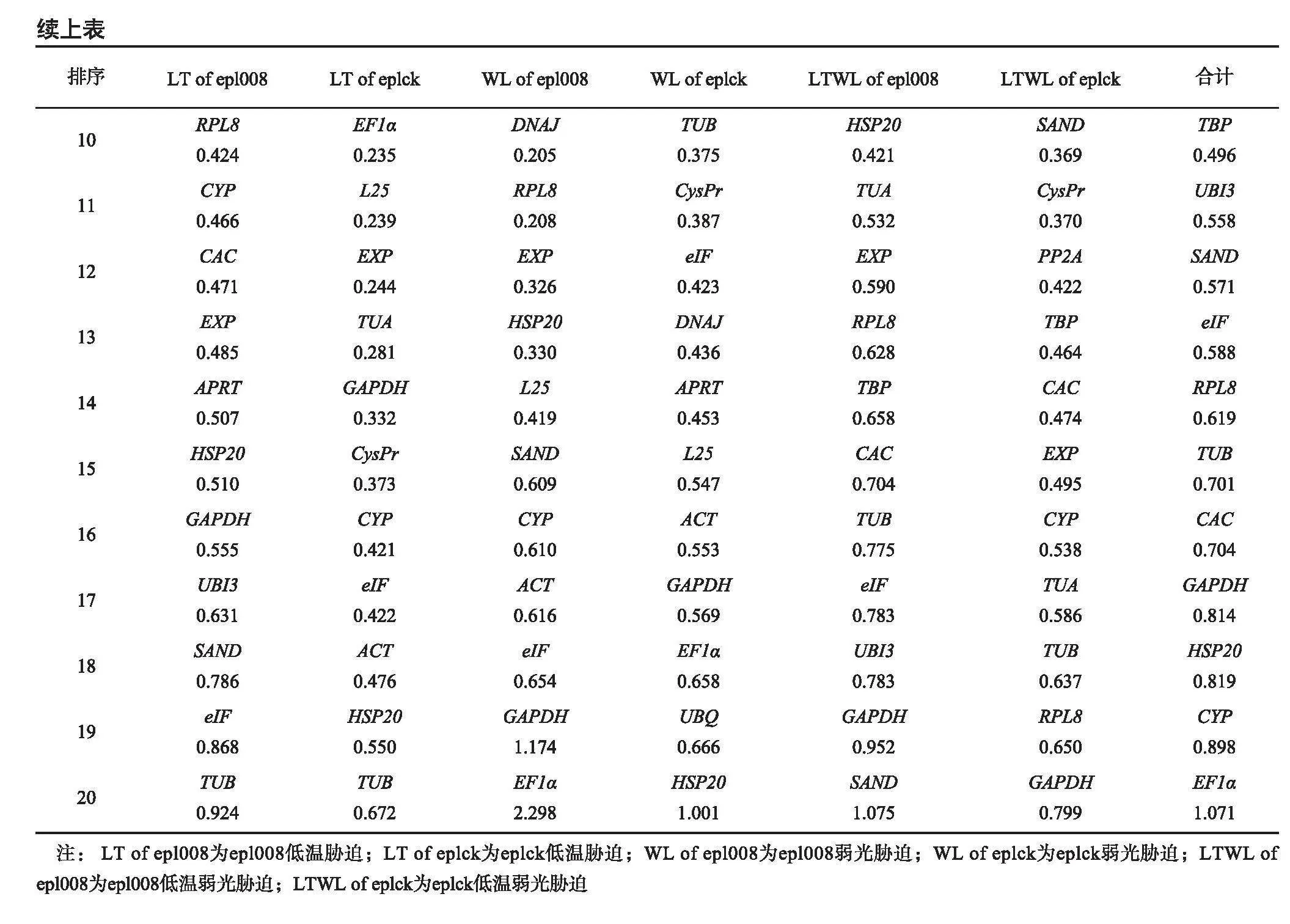
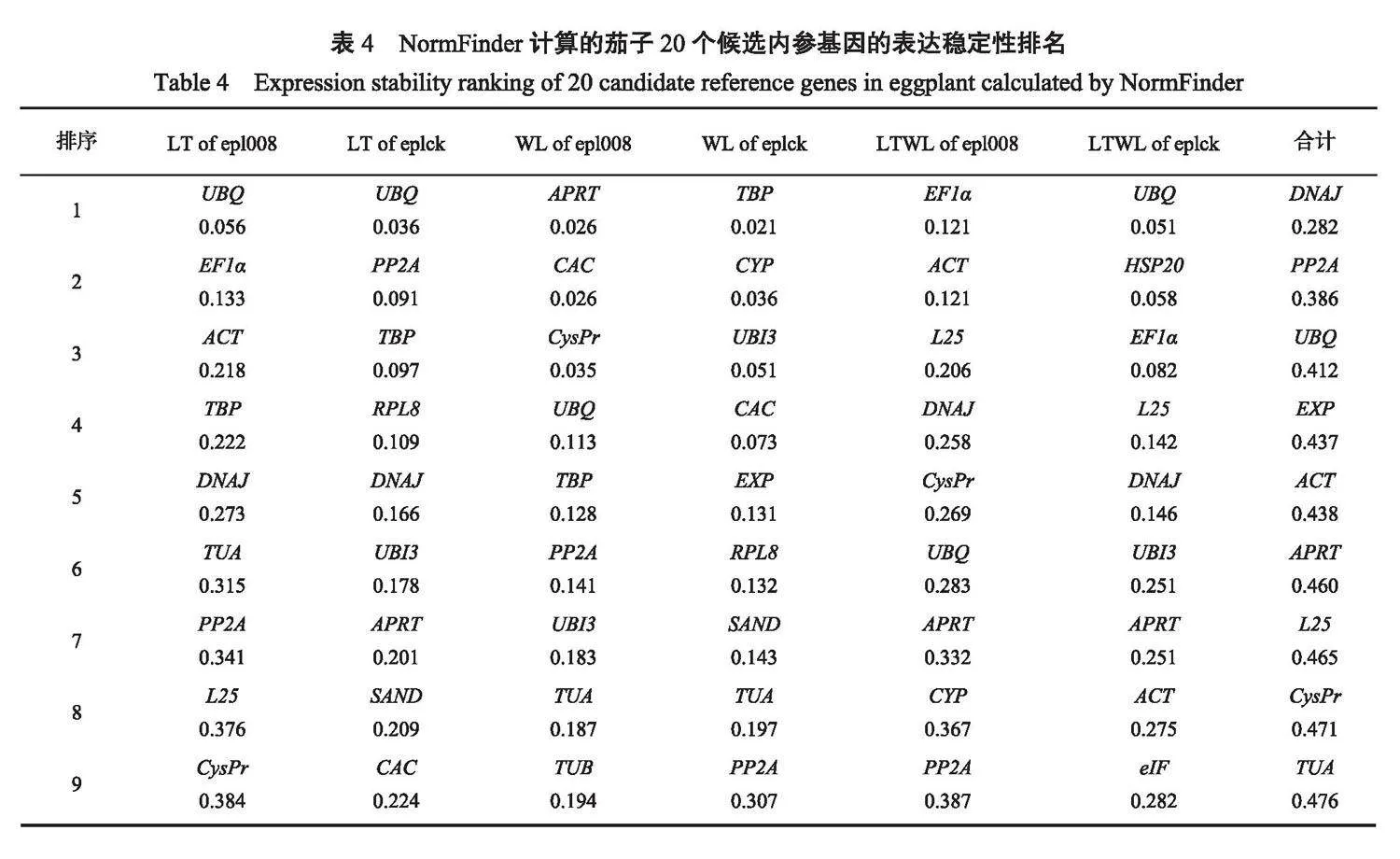
2.3.2 NormFinder软件分析NormFinder软件是通过计算基因表达稳定性(S)来分析内参基因的表达稳定性,S越大稳定性越差,S越小稳定性越好,稳定性和S呈现负相关。从NormFinder软件分析结果(表4)发现,茄子epl008叶片在低温胁迫下,UBQ的S最小,为0.056,稳定性最好,其次是EF1α,为0.133,TUB的S最大为0.924,稳定性最差;茄子eplck叶片在低温胁迫下,UBQ的S最小,稳定性最好,其次是PP2A,TUB的S最大,稳定性最差;茄子epl008叶片在弱光胁迫下,APRT的S最好,其次是CAC,EF1α的S最大,稳定性最差;茄子eplck叶片在弱光胁迫下,TBP的S最小,稳定性最好,HSP20的S最大,稳定性最差;茄子epl008叶片在低温弱光胁迫下,EF1α的S最小,稳定性最好,其次是ACT,SAND的S最大,稳定性最差;茄子eplck叶片在低温弱光胁迫下,UBQ在试验中波动不明显,表达稳定性最高,其次是HSP20,GAPDH的S最大,说明它在试验中表现很活跃。在所有样本处理下,DNAJ的S最小,稳定性最好,其次是PP2A,EF1α的S最大,稳定性最差;这和GeNorm软件分析的结果基本一致。
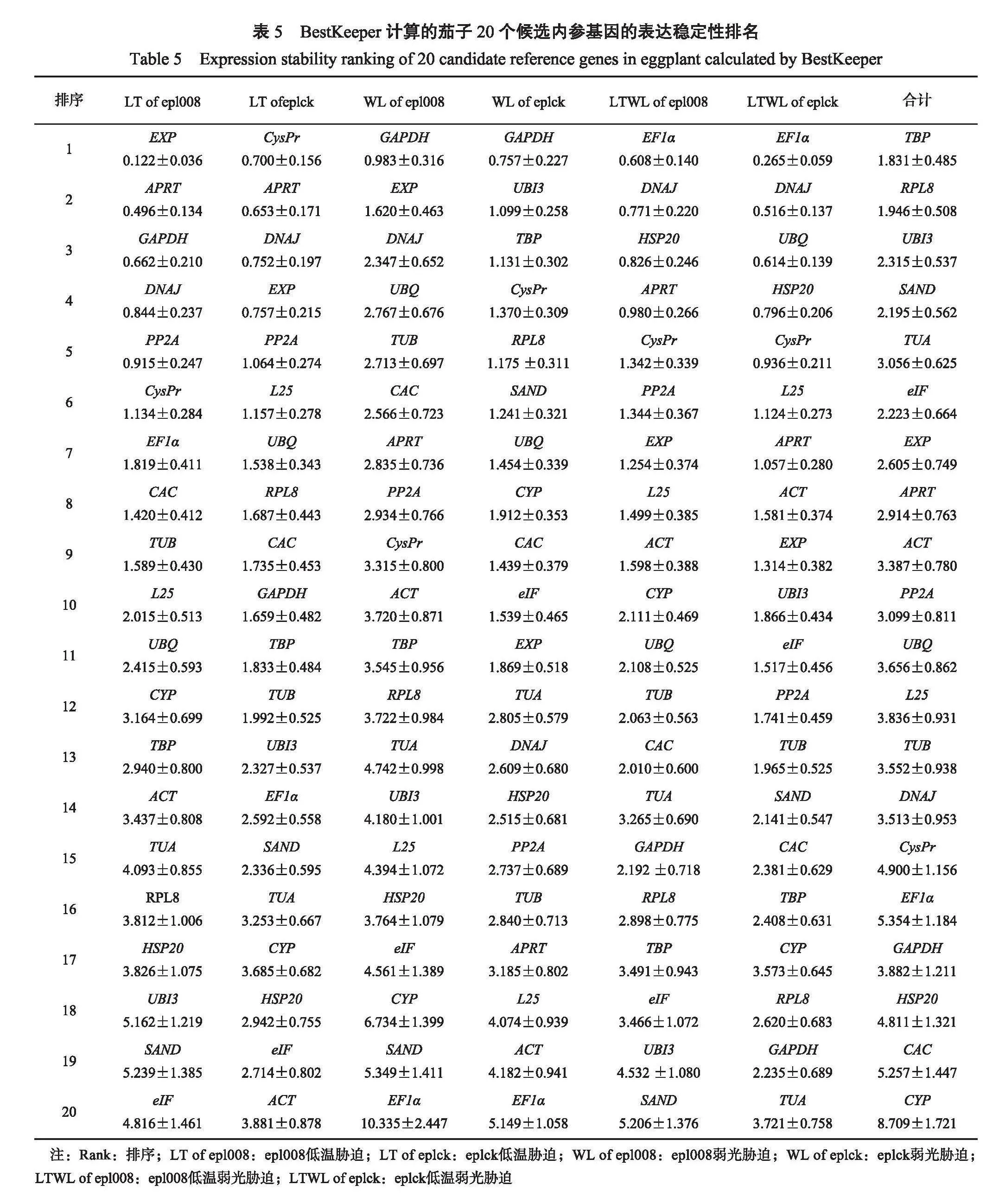
2.3.3 BestKeeper软件分析BestKeeper软件主要通过运算出标准偏差(standard deviation,SD)和变异系数(coefficients of variance,CV)通过比较各个值的大小,来确定20个候选内参基因的稳定性。标准偏差和变异系数越小,内参基因越稳定。运用BestKeeper软件进行运算结果表明(表5),当以低温胁迫的茄子epl008叶片为材料时,EXP的SD为0.122,CV为0.036,均小于1,稳定性最好,eIF的SD最大,为4.816,CV为1.461,稳定性最差。当以低温胁迫的茄子eplck叶片为材料时,CysPr的SD为0.700,CV为0.156,均小于1,稳定性好,ACT的SD最大,且SD为3.881,CV为0.878,稳定性最差;当以弱光胁迫的茄子epl008叶片为材料时,GAPDH的SD为0.983,CV为0.316,稳定性最好,EF1α的SD大于1,为10.335,CV为2.447,稳定性最差;当以弱光胁迫的茄子eplck叶片为材料时,GAPDH的SD为0.757,CV为0.227,稳定性最好,EF1α的SD大于1,稳定性最差;当以低温弱光胁迫的茄子epl008叶片为材料时,EF1α的SD为0.608,CV为0.140时,稳定性最好,SAND的SD为5.206,CV为1.376,稳定性最差。在所有样品处理下,TBP的SD为1.83,CV为0.485,稳定性最好,CYP的SD为8.709,CV为1.721,稳定性最差。这与GeNorm和NormFinder软件的分析结果基本一致。
2.3.4综合评价茄子20个内参基因在所有样品处理下,软件GeNorm的分析结果为,UBI3和SAND为表达最稳定的内参基因,EF1α为表达最不稳定的内参基因;软件NormFinder计算结果如下,DNAJ为表达最稳定的内参基因,EF1α为表达最不稳定的内参基因;软件BestKeeper给出的结果表明,TBP为表达最稳定的内参基因,CYP为表达最不稳定的内参基因;3种不同的统计方法得到的结果各不相同,通过几何均值统计法综合分析GeNorm、NormFinder和BestKeeper软件3种计算方法的结果,并结合geNorm软件的对不同处理下最佳内参基因数量的分析结果(表6):茄子epl008叶片在低温胁迫下,PP2A和APRT表达稳定性最好,eIF表达稳定性最差;茄子eplck叶片在低温胁迫下,RPL8和TBP表达稳定性最好,HSP20表达稳定性最差;茄子epl008叶片在弱光胁迫下,APRT和CAC表达稳定性最好,EF1α表达稳定性最差;茄子eplck叶片在弱光胁迫下,TBP和UBI3表达稳定性最好,EF1α表达稳定性最差;茄子epl008叶片在低温弱光胁迫下,EF1α和DNAJ表达稳定性最好,SAND稳定性最差;茄子eplck叶片在低温弱光胁迫下,EF1α和DNAJ表达稳定性最好,GAPDH稳定性最差。在所有的样品处理下,TBP和UBI3基因表达稳定性最好,CYP表达稳定性最差。
3讨论与结论
茄子富含对人体有益的维生素P,是全球排名前十的健康蔬菜之一[50]。南方冬季初春,茄子的生长常常受到低温弱光等恶劣环境条件的影响,茄子抗逆基因的挖掘、抗逆品种的培育等已成为科研工作者们的研究热点[51−55]。qRT-PCR是确定抗逆基因表达最常用的手段之一,而表达量数据的精确性取决814bd4b4b5ebc8561f8a0037d0c7e00e于使用内参基因的稳定性。在针对茄子不同抗性品种的研究中,筛选出在低温、弱光及低温弱光等胁迫下表达稳定的内参基因,对于深入探究茄子应对低温弱光逆境的机制具有重大意义[51]。本研究总结前人内参基因研究结果,结合茄子转录组测序数据挖掘候选内参基因,qRT-PCR数据显示每个候选内参基因表达量都存在变化,这个结论和Wu等[56]的研究结果类似。在特定条件下看家基因表达量变化较小,但如果将之作为内参基因,还需要进一步对这些候选内参基因的稳定性进行评估。
不同的统计方法可能获得截然相反的实验数据,究竟哪个软件评价的结果更可靠,目前没有定论[57]。根据前人的经验,本研究使用了GeNorm、NormFinder和BestKeeper3个软件统计计算,分析20个候选内参基因的稳定性[58],发现每种软件的候选内参基因稳定性排序存在差异。3种计算方法的分析结果相似,但由于分析方式和计算方法不同,候选内参基因稳定性排序上略有不同。GeNorm和NormFinder统计方法获得相同的最活跃基因EF1α。BestKeeper软件和获得和综合3种统计方法排序获得了相同最稳定基因TBP和最不稳定基因CYP。这样的结果是随机的呢,还是说明BestKeeper软件的统计方法优于其他两种方法还有待进一步确定。本研究采用多种算法进行内参基因表达稳定性统计,最大程度上降低因不同的计算方法而造成的数据偏差,并根据几何平均值综合评价分析,结果表明,在这项研究中TBP在所有样本中为最稳定的内参基因,而邓嘉硕等[51]在冷胁迫等多种逆境处理下,筛选出的ACT基因则表现相对活跃。
肌动蛋白ACT作为细胞骨架形成的重要蛋白,常常被认为是表现最稳定的内参基因之一[59−60]。邓嘉硕等[51]对不同组织与冷胁迫等逆境下茄子qRT-PCR内参基因筛选,ACT均为最稳定内参基因。为验证ACT基因的稳定性,本试验设计在低温胁迫、弱光胁迫、低温弱光胁迫处理下,采集低温弱光敏感eplck和耐低温弱光epl008品系0、3、6、12、24和48h的叶片为样本,从转录组数据中挖掘包括ACT基因的20个候选内参基因中,筛选茄子在这3种非生物因素下的最佳内参基因。本研究对筛选的数据进行综合评价分析,TBP在所有样本中表达稳定性最佳。但在特定的试验条件下,例如epl008品系低温胁迫下PP2A基因稳定性最好,ACT稳定性排名第8;eplck品系低温胁迫下,RPL8基因表达稳定性最佳,ACT排名第19。epl008品系弱光胁迫下,ACT基因稳定性排名第16;eplck品系低温胁迫下,ACT基因稳定性排名第18。在低温弱光胁迫下,epl008品系的样本,ACT基因稳定性排名第5,在epl008品系样本中,ACT基因稳定性排名第8。在所有的茄子样本中,ACT基因稳定性排名第9。即使在相同的冷胁迫条件下,针对不同茄子品系,使用不同试验设备,也可能得出不同的结果,ACT基因在茄子研究中没有通用性。为了顺利研究低温弱光等胁迫下功能基因的表达水平,筛选茄子内参基因是关键步骤。
参考文献:
[1]李彩霞,林碧英,申宝营,等.低温对茄子幼苗生理特性的影响及耐冷性指标的筛选[J].福建农业学报,2018,33(9):930−936.
[2]DONG R Y,YU B W,YAN S S,et al.Analysis of vitamin P content and inheritance models in eggplant[J].Horticultural Plant Journal,2020,6(4):240−246.
[3]PHAM T N M,SHIN C Y,PARK S H,et al.Solanum melongena L.extract protects retinal pigment epithelial cells from blue light-induced phototoxicity in in vitro and in vivo models[J].Nutrients,2021,13:359.
[4]姜涛.福建省茄子生产调查与耐低温资源筛选及生理响应研究[D].福州:福建农林大学,2017.
[5]杨玉凯,陈艺群,林碧英,等.光质对茄子幼苗光合特性及叶绿素荧光参数的影响[J].福建农林大学学报(自然科学版),2018,47(6):673−680.
[6]ZHANG Y,HAN X,CHEN S,et al.Selection of suitablereference genes for quantitative real-time PCR gene expression analysis in Salix matsudana under different abiotic stresses[J].Scientific Reports,2017,7:40290.
[7]WANG Z,XU J,LIU Y,et al.Selection and validation of appropriate reference genes for real-time quantitative PCR analysis in Momordica charantia[J].Phytochemistry.,2019,164:1−11.
[8]SUN H,JING X,SUN M,et al.Evaluation of reference genes for normalizing RT-qPCR in leaves and suspension cells of Cephalotaxus hainanensis under various stimuli[J].Plant Methods,2019,15:31.
[9]NGUYEN D,EAMENS A,GROF C.Reference gene identification for reliable normalisation of quantitative RT-PCR data in Setaria viridis[J].Plant Methods.,2018,14:24.
[10]EXPṒSITORODRḮGUEZ M,BORGES A A,BORGESPḖREZ,A,et al.Selection of internal control genes for quantitative real-time RT-PCR studies during tomato development processs[J].BMC Plant Biology,2008,8:131.
[11]LIU Q,QI X,YAN H,et al.Reference gene selection for quantitative real-time reverse-transcriptase PCR in annual ryegrass(Lolium multiflorum)subjected to various abiotic stresses[J].Molecules,2018,23:172.
[12]NOLAN T,HANDS R,BUSTIN S.Quantification of mRNA using real-time rt-PCR[J].Nature Protocols,2006,1(3):1559−1582.
[13]HUGGETT J,DHEDA K,BUSTIN S,et al,A.Real-time RT-PCR normalisation;strategies and considerations[J].Genes Immun,2005,6:279−284.
[14]BUSTIN S,BEAULIEU J F,HUGGETT J,et al.Practical implementation of minimum standard guidelines for fluorescence-based quantitative real-time PCR experiments[J].BMC Molecular Biology,2010,11:74.
[15]LI M Y,XIONG A S,WANG F,et al.Suitable Reference genes for Accurate gene expression analysis in parsley(Petroselinum crispum)for abiotic stresses and hormone stimuli[J].Frontiers In Plant Science,2016,7:1263.
[16]XIN LIU X,GUAN HR,SONG M,et al.Reference gene selection for qRT-PCR assays in Stellerachamaejasme subjected toabiotic stresses and hormone treatments based on transcriptome datasets[J].PeerJ,2018,6:e4535.
[17]WEI M,CHEN Y X,ZHANG M Q,et al.Selection and validation of reference genes for the qRT-PCR assays of populus ussuriensis gene expression under abiotic stresses and related ABA treatment[J].Forests,2020,11:476.
[18]WEI L B,MIAO H M,Ruihong ZHAO R H,et al.Identification and testing of reference genes for Sesame gene expression analysis by quantitative real-time PCR[J].Planta,2013,237:873−889.
[19]刘涛,熊青,许颖妍,等.夜香树花期荧光定量PCR内参基因的筛选[J].植物科学学报,2017,35(4):534−542.
[20]HONG S Y,SEO,P J,YANG M S,et al.Exploring valid reference genes for gene expression studies in Brachypodium distachyon by real-time PCR[J].BMC Plant Biology,2008,8:112.
[21]LI L,LI N.FANG H,et al.Selection and validation of reference genes for normalisation of gene expre-ssion in glehnia littoralis[J].Scientific Rorports,2020,10:7374.
[22]LACERDA A L M,FONSECA L N,BLAWID R,et al.Reference gene selection for qPCR analysis in tomato-bipartite begomovirus interaction and validation in additional tomato-virus pathosystems[J].PLoS ONE,2015,10(8):e0136820.
[23]WAN H J,YUAN W RUAN M Y,et al.Identification of reference genes for reverse transcription quantitative real-time PCR normalization in pepper(Capsicum annuum L.)[J].Biochemical and Biophysical Research Communications,2011,416:24−30.
[24]LØVDAL T,LILLO C.Reference gene selection for quantitative real-time PCR normalization in tomato subjected to nitrogen,cold,and light stress[J].Analytical Biochemistry,2009,387(2):238−242.
[25]QU R J,MIAO Y J,CUI Y J,et al.Selection of reference genes for the quantitative real-time PCR normalization of gene expression in Isatis indigotica fortune[J].BMC Molecular and Cell Biology,2019,20:9.
[26]YIN X J,HE T T,YI K,et al.Comprehensive evaluation of candidate reference genes for quantitative real-time PCR-based analysis in Caucasian clover[J].Scientifc Reports,2021,11:3269.
[27]BAEKA E,YOON J Y,PALUKAITIS P.Validation of reference genes for quantifying changes in gene expression in virus-infected tobacco[J].Virology,2017,510:29−39.
[28]GANTASALA N P,PAPOLU P K,THAKUR P K,et al.Selection and validation of reference genes for quantitative gene expression studies by real-time PCR in eggplant(Solanum melongena L.)[J].BMC Research Notes,2013,6(1):1−11.
[29]KANAKACHARI M,SOLANKE A U,PRABHAKARAN N,etal.Evaluation of suitable reference genes for normalization of qPCR gene expression studies in brinjal(Solanum melongena L.)during fruit developmental stages[J].Applied Biochemistry And Biotechnology,2016,178(3):433−50.
[30]周晓慧,刘军,庄勇.喀西茄内参基因实时荧光定量PCR表达稳定性评价[J].园艺学报,2014,41(8):1731−1738.
[31]庞强强,李植良,罗少波,等.高温胁迫下茄子qRT-PCR内参基因筛选及稳定性分析[J].园艺学报,2017,44(3):475−486.
[32]VANDESOMPELE J,DE PRETER K,PATTYN F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):RESEARCH0034.
[33]ANDERSEN C L,JENSEN J L,ØMTOFT T F.Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cancer Research,2004,64(15):5245−5250.
[34]PFAFFL M W,TICHOPAD A,PRGOMET C,et al.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper—Excel-based tool using pair-wise correlations[J].Biotechnology Letters,2004,26(6):509−515.
[35]WANG S B,LIU K W,ZHI L,et al.Evaluation of appropriate reference genes for gene expression studies in pepper by quantitative real-time PCR[J].Molecular Breeding,2012,30(3):1393−1400.
[36]SCHMIDT GW,DELANEY S K.Stable internal reference genes for normalization of real-time RT-PCR in tobacco(Nicotiana tabacum)during development and abiotic stress[J].Molecular Genetics And Genomics,2010,283:233−241.
[37]YU J J,SU Y,SUN J Y,et al.Selection of stable reference genes for gene expression analysis in sweet potato(Ipomoea batatas L.)[J].Molecular and Cellular Probes,2020,53:101610.
[38]TANG X,ZHANG N,SI H J,et al.Selection and validation of reference genes for RT-qPCR analysis in potato under abiotic stress[J].Plant Methods,2017,13:85.
[39]TANG F,CHU L W,SHU W B,et al.Selection and validation of reference genes for quantitative expression analysis of miRNAs and mRNAs in Poplar[J].Plant Methods,2019,15:35.
[40]HOSSAIN M S,AHMED R,HAQUE M S,et al.Identifcation and validation of reference genes for real-time quantitative RT-PCR analysis in jute[J].BMC Molecular and Cell Biology,2019,20:13.
[41]SU W B,YUAN Y,ZHANG L,et al.Selection of the optimal reference genes for expression analyses in diferent materials of Eriobotrya japonica[J].Plant Methods,2019,15:7.
[42]LIU B,JIANG Y T,LIN R Q,et al.Selection and Validation of Reference Genes 1 Desirable for Gene Expression Analysis by qRT-PCR on Seed Germination of Castanea henryi,2021:https://doi.org/10.1101/2021.01.27.428382.
[43]REN R,HUANG F Z,GAO R X,et al.Selection and validation of suitable reference genes for RT-qPCR analysis in dove tree(Davidia involucrata Baill.)[J].Trees,2019,33:837−849.
[44]ZHANG J,ZHU C S,HUO Y B,et al.Validation of suitable reference genes for quantitative gene expression analysis in Tripterygium wilfordii[J].Molecular Biology Reports,2019,46:4161−4174
[45]WANG C,CUI H M,HUANG T H,et al.Identification and validation of reference genes for qRT-PCR analysis in non-heading chinese cabbage flowers[J].Frontiers in Plant Science,2016,7:811.
[46]MARIOT R F,DE OLIVEIRA L A,VOORHUIJZEN M M,et al.Selection of reference genes for transcriptional analysis of edible tubers of potato(Solanum tuberosum L.)[J].PLoS ONE,2015,10:e120854.
[47]李飞,徐建飞,刘杰,等.冷驯化前后野生马铃薯Solanum acaule内参基因的筛选[J].西南农业学报,2012,25(5):1592−1595.
[48]LOPEZ-PARDO R,GALARRETA J,RITTER E.Selection of housekeeping genes for q RT-PCR analysis in potato tubers under cold stress[J].Molecular Breeding,2013(31):39−45.
[49]ZHAO Z,ZHOU H,NIE Z,et al.Appropriate Reference Genes for RT‐qPCR Normalization in Various Organs of Anemone flaccida Fr.Schmidt at Different Growing Stages[J].Genes,2021,12:459.
[50]陈锦溶,吕紫见,范丽莎,等.上位基因控制的茄子果色遗传效应解析[J].中国农业科学,2023,56(23):4729−4741.
[51]邓嘉硕,冯程,张泷昊,等.不同组织与逆境胁迫下茄子qRT-PCR内参基因筛选[J].中国蔬菜,2024(8):37−46.
[52]WANG Y,BAN Q Y,LIU T J,et al.Genome-wide identification and expression analysis of Autophagy-Related Genes in eggplant(Solanum melongena L.)[J].Scientia Horticulturae,2024,330:113085.
[53]LI D,TANG X,DONG Y,et al.Comparative genomic investigation of TCP gene family in eggplant(Solanum melongena L.)and expression analysis under divergent treatments[J].Plant Cell Reports,2022,41(11):2213−2228.
[54]LI B,CHEN X,WU Y,et al.Gene characterization and molecular pathway analysis of reverse thermosensitive genic male sterility in eggplant(Solanum melongena L.)[J].Horticulture Research,2019,1(6):118.
[55]SAINI D K and KAUSHIK P.Visiting eggplant from a biotechnological perspective:A review Visiting eggplant from a biotechnological perspective:A review[J].Scientia Horticulturae,2019,253:327−340.
[56]WU J Y,ZHANG H G,LIU L Q,et al.Validation of reference genes for RT-qPCR studies of gene expression in preharvest and postharvest longan fruits under different experimental conditions[J].Frontiers in Plant Science,2016,7(439):780.
[57]QI S A,YANG L W,WEN X H,et al.Reference gene selection for RT-qPCR analysis of flower development in Chrysanthemum morifolium and Chrysanthemum lavandulifolium[J].Frontiers in Plant Science,2016,7:287.
[58]ZHANG J C,XIE W G,YU X X,et al.Selection of suitable reference genes for RT-qPCR gene expression analysis in Siberian wild rye(Elymus sibiricus)under different experimental conditions[J].Genes,2019,10(6):451.
[59]LIN H,ZHANG Q R,CAO J S,et al.Selection of suitable reference genes for real-time qPCR gene expression in cauliflower under abiotic stress and methyl jasmonate treatment[J].Biologia Plantarum,2022,66:46−55.
[60]YOU S,CAO K,CHEN C,et al.Selection and validation reference genes for qRT-PCR normalization in different cultivars during fruit ripening and softening of peach(Prunus persica)[J].Scientific Reports,2021,11(1):7302.
(责任编辑:柯文辉)
