克隆间相互作用对豌豆蚜性投资策略的影响
2024-11-05李杨史文敏

摘要:为探究克隆间相互作用对豌豆蚜性别分化的影响。本研究使用3个豌豆蚜克隆(MS克隆,PS克隆,Y克隆)作为研究对象。首先选用琼脂法,在低温短日照条件下诱导性母后,分别制作1头区、2头区和混合区,调查各试验区性母的日产蚜量、后代性比和性母的保幼激素3的滴度。结果显示:在MS克隆的1头区,雌雄后代比约为1∶1,当初始性母数增加或与非我克隆共存时,后代的性雌蚜数会增加,雄蚜数减少。PS克隆与MS克隆共存时,相较于1头区,PS克隆后代性雌蚜和雄蚜数均减少,胎生蚜数却显著增加,而2头区的后代性别分化与1头区相比未出现明显差异。Y克隆各处理间性分化未出现差异。性母保幼激素3的滴度与雄蚜数量呈负相关,与胎生蚜数量呈正相关。本研究结果表明,豌豆蚜性母可以根据周边克隆的类型和密度调整后代性别比,以优化其生态适应性和基因传播效率。
关键词:豌豆蚜;竞争;性比;保幼激素3;繁殖
中图分类号:S433.3 文献标识码:A 文章编号:1007-0435(2024)10-3113-08
Impact of Interclonal Interactions on Sexual Investment Strategies of Pea Aphids
LI Yang*, SHI Wen-min
(College of Biology and Agriculture, Zunyi Normal University, Zunyi, Guizhou Province 563006, China)
Abstract:To investigate the effect of clonal interactions to sex differentiation in pea aphids. Three pea aphid clones (MS clone,PS clone,and Y clone) were used in this study. Firstly,the agar method was selected to induce sexuparae under low temperature and short-day light,and then using the sexupara of each clone to prepare a single aphid treatment and two-aphids treatment,as well as mixed clonal treatments consisting of different clones,and to investigate the daily aphid production of sexuparae,the sexual differentiation of the progeny,and the juvenile hormone III titer of sexuparae in each treatment. The results showed that in a single aphid treatment of the MS clone,the ratio of male to female progeny was about 1∶1,and the number of oviparous female aphids in the progeny increased and the number of male aphids decreased when the initial number of sexuparae was increased or coexisted with the non-self clone. When cohabitated with the MS clone,the PS clone exhibited a reduction in the count of oviparous females and males,alongside a marked increase in the population of viviparous aphids,in comparison to a single treatment,yet,the sexual differentiation observed in the progeny from the two-aphids treatment did not significantly deviate from that in a single aphid treatment. On the other hand,none of the Y clones showed significant differences in sex differentiation among treatments. The juvenile hormone III titer of sexuparae was negatively correlated with the number of male aphids,and positively correlated with the number of viviparous aphids. The findings of this study suggest that pea aphid sexuparae can adjust offspring sex ratios according to the type and density of peripheral clones to optimize their ecological fitness and gene transmission efficiency.
Key words:Acyrthosiphon pisum;Competition;Sex ratios;Juvenile hormone 3;Reproduction
收稿日期:2024-02-20;修回日期:2024-04-11
基金项目:国家自然科学基金(32160259);大学生创新创业训练计划项目(202310664673);遵义师范学院博士启动金项目(遵师BS[2019]25号)共同资助
作者简介:
李杨(1985-),男,汉族,贵州铜仁人,博士,副教授,主要从事昆虫进化生态学研究,E-mail:harayaka@qq.com;*通信作者Author of corresponding,E-mail:harayaka@qq.com
当不同生物体在同一环境共存时,它们之间的互动可能引发各自表型的调整[1]。这种适应性响应可能涵盖从互利共生、寄生、捕食和竞争等多种相互作用形式[2]。随着时间的推移,这些相互作用可能促成协同进化,使得一种物种的表型变化能够适应另一物种的特征或行为模式[3]。
在自然界中,拥有多种生活史的无脊椎动物表现出明显的表型多态性,这使其能够适应因季节性变化引起的环境和捕食压力[4-5]。特别是蚜虫,拥有无翅型、有翅型、有性型和孤雌型等众多表型[6]。大部分的蚜虫在春季到夏季,通过孤雌生殖进行繁衍后代;在秋季,受低温短日照的影响,发育成性母产生性雌蚜和雄蚜,二者交配后以卵越冬。孤雌生殖和有性生殖之间的转换不仅增加了蚜虫的遗传多样性,而且对其在寒冬中的生存至关重要[7]。
蚜虫性比调控机制是进化生态学中一个重要且尚未解决的问题之一[8]。目前一些学者对蚜虫性比影响因子研究中发现,不同光周期下豌豆蚜(Acyrthosiphon pisum)的后代性比有显著差异[9],次生共生菌Spiroplasma通过杀雄作用降低豌豆蚜的雄蚜数[10],次生共生菌Hamiltonella和Regiella均会导致豌豆蚜性比偏雌[11]。另外,Li等[12]发现雪虫(Prociphilus oriens)的雌性比与当年8月的降水量及9月的气温呈负相关性。
豌豆蚜隶属于半翅目(Hemiptera)蚜科(Aphididae),主要寄生豆科植物,保幼激素是调节豌豆蚜生理期感知后生殖模式变化的重要物质[13-14],能显著影响蚜虫的生殖方式转化[5,15]。在秋季,无论寄主植物的质量如何,光周期的变化都会直接影响蚜虫的发育[16]。光周期通过控制保幼激素滴度诱导蚜虫产生有性世代[14]。但目前关于豌豆蚜在不同性别分配模式下保幼激素3(蚜虫中唯一被发现的保幼激素[14])含量变化趋势的研究还相对较少。虽然有研究探讨了气候条件如何诱导性蚜产生,但没有研究评估蚜虫相邻的生物环境如何影响其性别分配。很多研究都是使用豌豆蚜进行单克隆饲养,将其置于不同的光周期和温度条件下,以研究单个或几个克隆的性蚜产蚜顺序和性别比例[10,15]。而野外寄主植物上通常有多个克隆共存,并同时产生性蚜[17-18]。多克隆共存会使近亲繁殖的机会增多,进而影响后代的性别比例[19]。前期研究发现,豌豆蚜具备“自我”和“非我”克隆的识别能力[11,20],并且能根据相邻克隆的分布和密度,调节自身繁殖。当豌豆蚜与非我克隆共存时,很可能会根据其他克隆的存在调整其后代的性别比例或有性形态和无性形态的比例,而在容器中饲养单一克隆会忽略克隆之间的相互作用。为了评估克隆间相互作用对豌豆蚜后代性分化的影响,本研究使用2个寄主种群的绿色型豌豆蚜克隆及1个基因突变的黄色型豌豆蚜克隆进行试验,设置不同的试验区,调查豌豆蚜在与不同类型克隆共存时的性母后代性别分化及保幼激素3滴度,旨在研究影响豌豆蚜性比调控因子,为豌豆蚜进化机制研究及虫情预报提供新的理论依据。
1 材料与方法
1.1 供试虫源
本研究使用2种色型(绿色型和黄色型)共3个豌豆蚜(A. pisum)克隆进行试验,①在新疆维吾尔自治区呼图壁县紫花苜蓿(Medicago sativa)植株上采集的绿色克隆(以下称MS克隆)。②在贵州省道真县豌豆(Pisum sativum)植株上采集的绿色克隆(以下称PS克隆)。③由绿色克隆基因突变而来的黄色克隆(以下称Y克隆)。所有克隆都在光照培养箱(温度:20℃,光周期:L∶D=16∶8,光照强度:7000~8000 Lux,湿度:50%~60%)中,使用5 cm左右的蚕豆幼苗进行单克隆继代饲养,蚕豆品种为‘七星长龙’。
1.2 试验设计
1.2.1 试验装置 本研究试验使用琼脂法[21]进行,所用培养基为直径12 cm,高4 cm的塑料容器,叶片采集至株高15 cm左右的蚕豆植株‘七星长龙’。
1.2.2 克隆间相互作用对豌豆蚜性母的后代性别分化及保幼激素3滴度的影响 本试验环境为温度15℃,L∶D=10∶14,光照强度7000~8000 Lux,湿度50%~60%。分别将10头MS克隆、PS克隆以及Y克隆的3龄胎生蚜若虫移动到载有1片蚕豆叶的培养基中,作为G0进行饲养,当G0产出若虫(G1:性母)发育至3龄后,准备以下3个试验区。
1头区:分别将上述3个克隆的1头G1移动到载有1片蚕豆叶的培养基中进行饲养,每隔5天添加或更换1片蚕豆叶,分别标记1PS、1MS及1Y。
2头区:分别将上述3个克隆的2头G1移动到载有1片蚕豆叶的培养基中进行饲养,每隔5天添加或更换1片蚕豆叶。分别标记为1PS+1PS,1MS+1MS和1Y+1Y。
异克隆共存区:将1头MS克隆和PS克隆的1龄若虫同时放入载有1片蚕豆叶的培养基中进行饲养,标记为1MS+1PS。再使用相同的方法,制备PS克隆和Y克隆以及MS克隆和Y克隆这2个异克隆相邻组合,分别标记为1PS+1Y和1MS+1Y。
每个处理分别准备20个培养基,G1产子开始后每天上午9点统计一次各克隆总个体数。在各克隆G1产子开始后第6天的上午10点,随机从各处理的不同克隆中选择4头G1,使用按照JH III ELISA试剂盒(凡科维,上海)说明书的步骤测定各克隆保幼激素的滴度,重复3次,继续饲养剩余培养基中的蚜虫直到G1全部死亡,待G1所产后代(G2)发育至成虫后,在解剖镜下统计各克隆G2的性别。
不同克隆以及不同性别豌豆蚜的区分方法:PS克隆的腹管是黑色,而MS克隆的是淡黄色,在解剖镜下通过腹管颜色可以区分PS克隆和MS克隆,Y克隆所有G2后代均为黄色,通过体色即可识别。雌蚜均为无翅型且体型较大,其中胎生蚜成虫腹部有红点,性雌蚜成虫腹部无红点。雄蚜成虫体型相对雌蚜成虫较细小,很容易辨识,MS克隆雄蚜为有翅型,Y克隆和PS克隆均为无翅型,可通过大小、体色、腹管颜色及翅型进行3克隆雄蚜的区分。
1.3 数据处理
本研究所有数据均采用JMP V17进行分析,不同相邻区对豌豆蚜性母日均产子数、后代性分化以及保幼激素3滴度的影响使用广义线性模型(GLM)进行分析,两两比较采用T检验进行,保幼激素3滴度和各类型后代个体数的关系采用皮尔逊分析法进行,各克隆的增殖率比较使用重复测量进行。绘图软件是Graphpad prism V10,表格使用Word V2019制作。
2 结果与分析
2.1 不同相邻对象共存时豌豆蚜后代的性分化
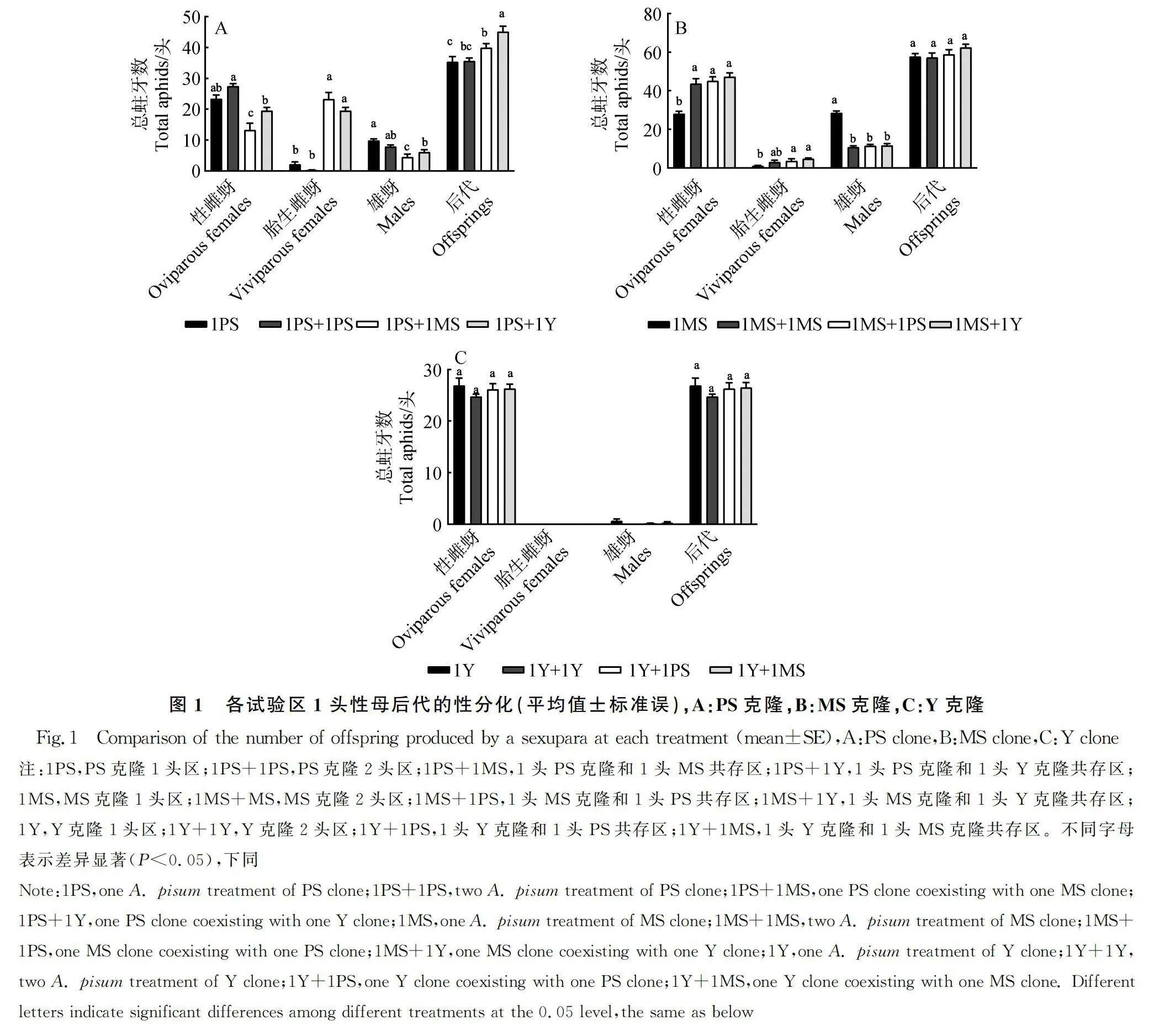
3个克隆在各处理中的性分化情况如图1所示,不同相邻对象对PS克隆后代的性分化具有显著影响(P<0.001)。在1PS中,性雌蚜数为23.38头,胎生蚜数为2.13头,雄蚜数为6.13头,与1PS+1PS处理间无显著性差异。当PS克隆与MS克隆共存时,其性蚜数较1PS显著降低,当PS克隆与Y克隆共存时,其雄蚜数较1PS显著降低。但两个处理中胎生蚜数量分别增加至23.25头和19.5头,且不同相邻对象对PS克隆性母后代总数也有显著影响(P<0.001)。1PS+1Y处理中PS克隆后代总数为42.13头,1PS+1MS处理中PS克隆后代总数为39.88头,均显著高于1PS(图1A)。不同相邻对象对MS克隆后代的性分化也具有显著影响(P<0.001)。在1MS中,性雌蚜为28.13头,胎生蚜为1头,雄蚜为28.5头。在2MS处理、1MS+1PS处理及1MS+1Y处理中,相较于1MS,3个处理的雄蚜数量均显著降低,而性雌蚜数量均显著增加,与之相对,胎生蚜数变化幅度则较小。不同相邻对象对MS克隆性母后代总数无显著影响(P=0.27,图1B)。但在Y克隆上,不同相邻对象对其后代性分化以及后代总数均无显著影响(性分化:P=0.7,后代总数:P=0.48),Y克隆性母在本实验条件中无胎生蚜产生,且只产生少量雄蚜(图1C)。
2.2 不同相邻对象共存时各克隆性母的日繁殖量变化
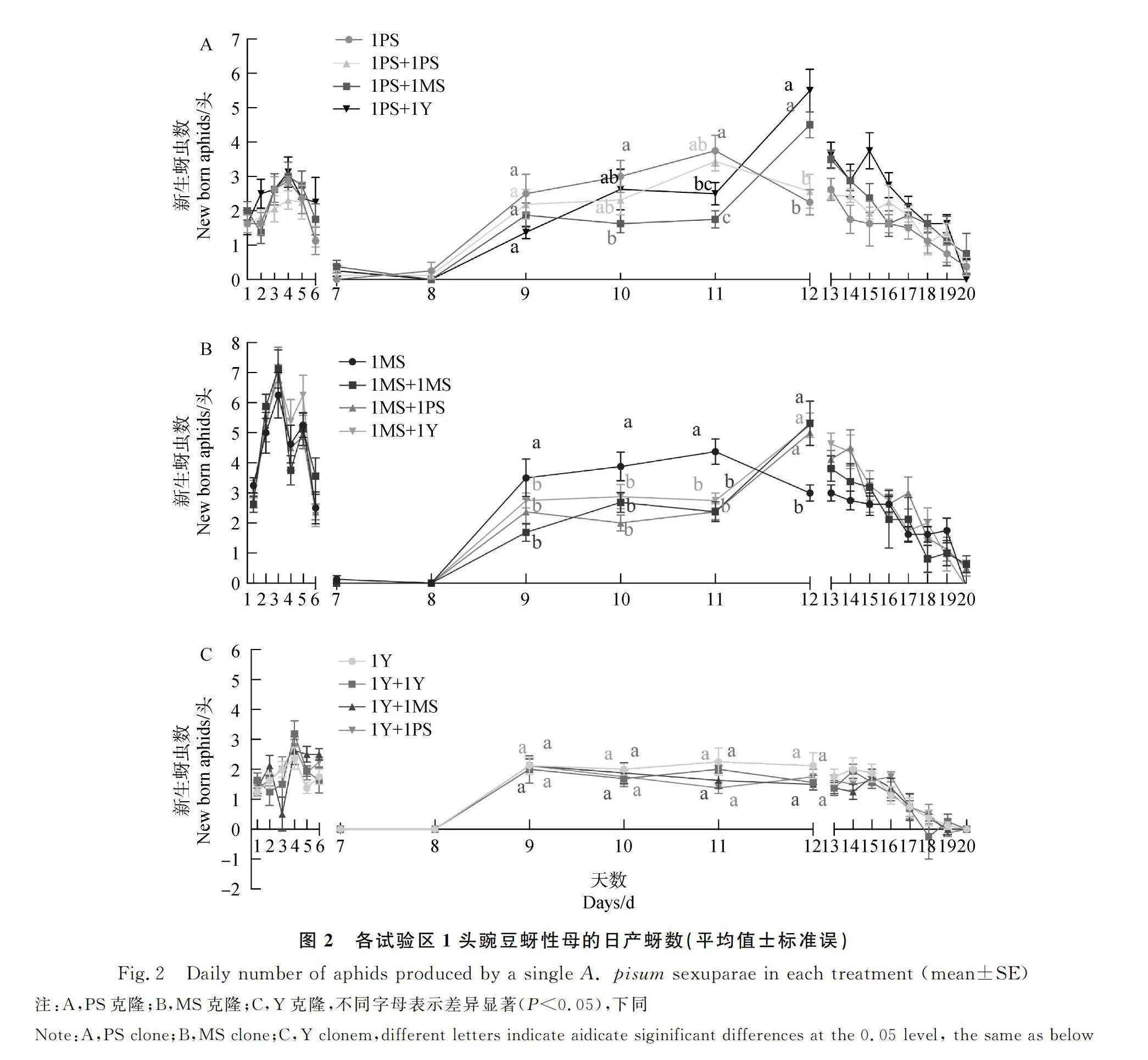
随着产蚜时间的推移,不同相邻对象对PS克隆和MS克隆性母的日繁殖量产生了显著影响(PS克隆:P<0.001,图2A;MS克隆:P<0.001,图2B),而Y克隆性母日繁殖量却未受相邻对象的影响(P=0.08,图2C)。在PS克隆中,第9天的1PS处理、1PS+1PS处理、1PS+1MS处理及1PS+1Y处理的产蚜数分别为2.5头、2.19头、1.87头和1.38头,各处理间无显著性差异。在第10天,1PS+1MS的产蚜数显著低于1PS,第11天,1PS+1MS和1PS+1Y的产蚜数均显著低于1PS。在第12天,1PS+1MS和1PS+1Y的产蚜数分别达到4.5头和5.5头,超过1PS(2.88头)和1PS+1PS(2.56头)(图2A)。在MS克隆中,1MS在第9天、第10天以及第11天的产蚜数分别为4.13头、4.12头和3.5头,显著高于其他3个处理,但在第12天,1MS+1MS,1MS+1PS及1MS+1Y的产蚜数分别增至5.56头、5头及5.25头,均显著高于1MS(图2B)。
2.3 异克隆共存区中各克隆增殖率的比较
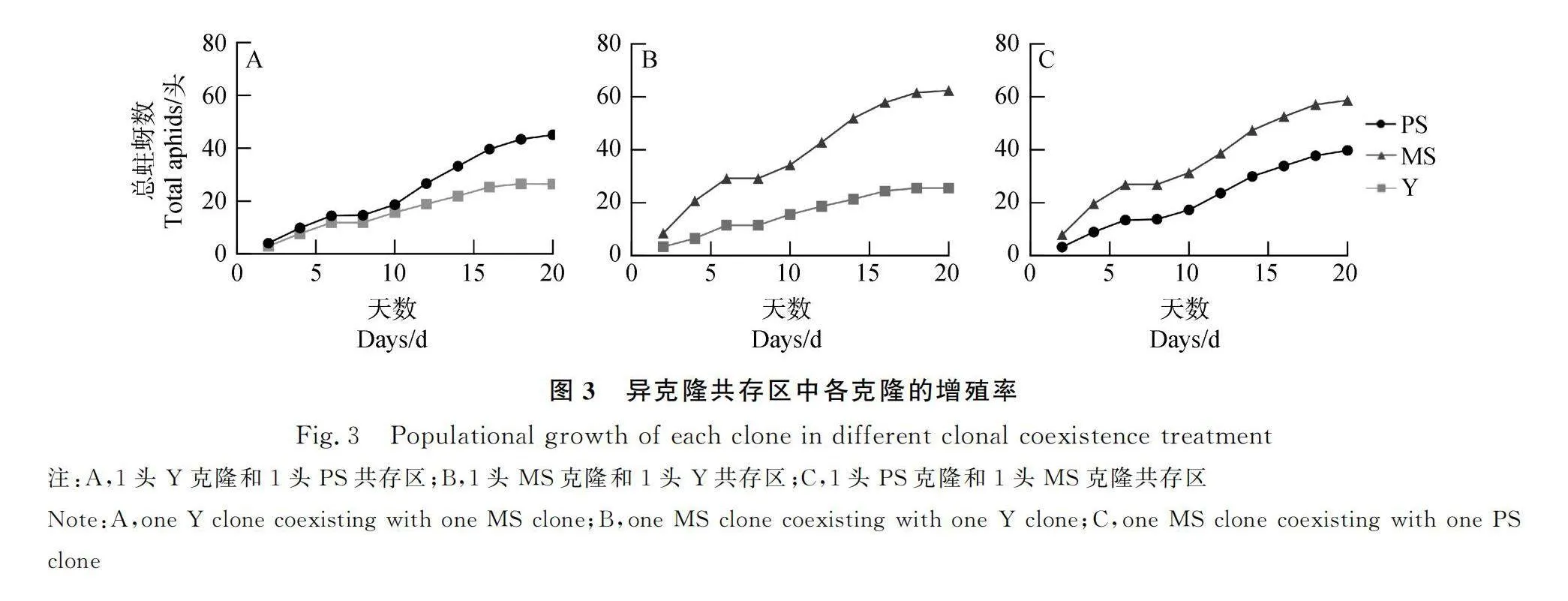
异克隆共存区各克隆的增殖情况如图3所示,在1头Y克隆和1头PS共存区,PS克隆的增殖率显著高于Y克隆(P=0.007,图3A),在1头MS克隆和1头Y共存区,MS克隆的增殖率也显著高于Y克隆(P<0.001,图3B),在1头PS克隆和1头MS克隆共存区,MS克隆的增殖率显著高于PS克隆(P<0.001,图3C)。
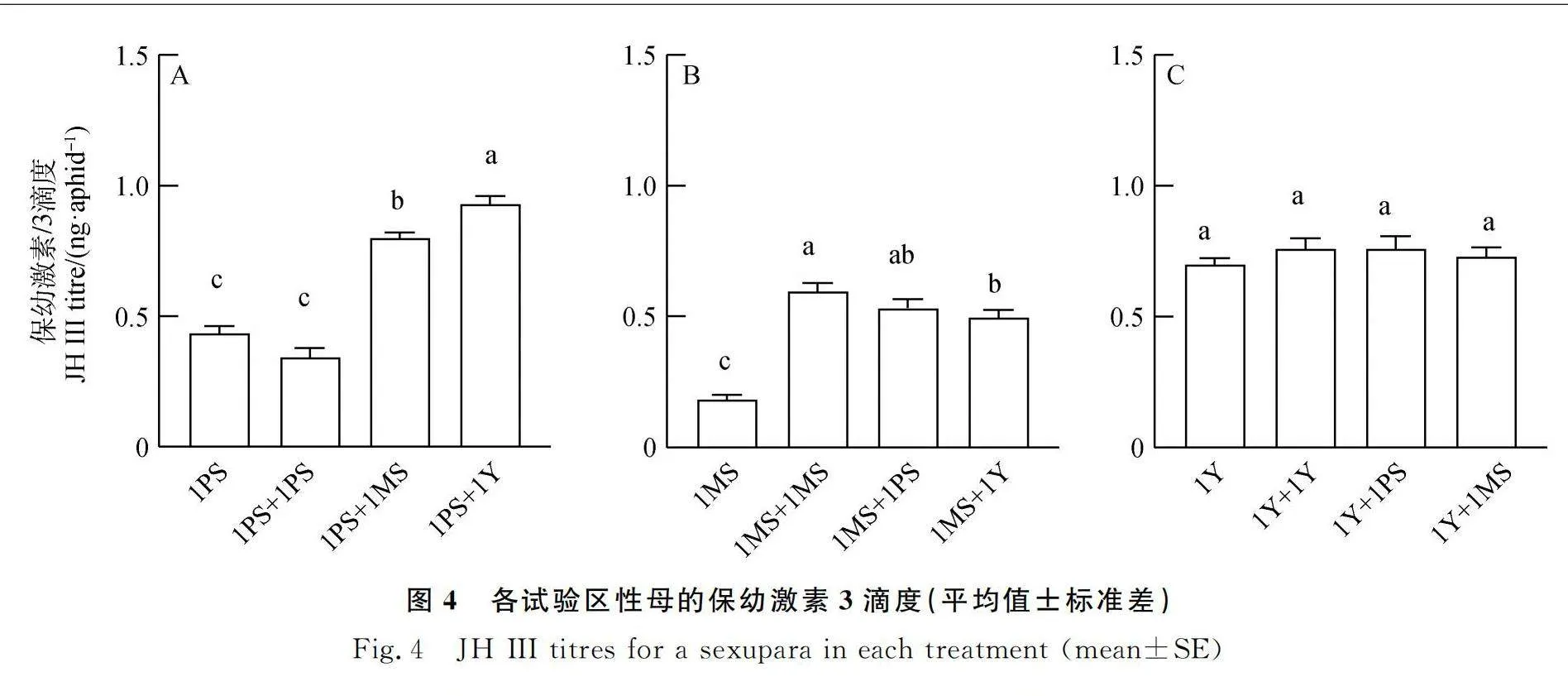
2.4 不同相邻对象对豌豆蚜性母保幼激素3滴度的影响
不同相邻对象对PS克隆和MS克隆性母产蚜后第6天的保幼激素3滴度具有显著影响(PS克隆:P<0.001,图4A;MS克隆:P<0.001,图4B),但是对Y克隆的保幼激素3滴度却无显著影响(P=0.49,图4C)。将MS克隆和PS克隆各处理的保幼激素滴度和各类型后代数分别合并,进行相关性分析后的结果如表1所示,胎生蚜数和保幼激素3滴度间有显著的正相关性(P=0.007),雄蚜数和保幼激素3滴度间呈负相关性(P=0.03),而性雌蚜数和保幼激素3之间无显著相关性(P=0.48)。
3 讨论
表型可塑性深植于基因组中,赋予生物多样的形态、生理和行为特征,被认为是一种进化上的策略[22-24]。众多研究已经证明,在单一克隆条件下,不同豌豆蚜克隆之间有性世代的性别分化存在显著差异[9-10,25]。本研究选用的两个绿色克隆分别来源于不同地区和不同寄主植物,而黄色克隆则源自基因突变,三者在遗传背景上有着明显的区别。在1头区,PS克隆有性世代的性别分化偏雌性(图1A),MS克隆雌雄比约为1∶1(图1B),而Y克隆极端偏雌,雄蚜数量极其稀少(图1C)。1头区的实验结果与前人研究[9-10,25]相符。
Trivers等[26]认为雌性可能会根据自身生理状态和繁殖期间所处的环境(如气温,降水以及食物供给等)调整后代的性别比例。PS克隆2头区的性别分化与1头区无明显差异(图1A),均偏雌性。PS克隆的雄蚜为无翅型,迁移困难,当种群中雄性数量增加,有可能会导致雄性个体间的局部配偶竞争(Local Mate Competition)[27-29],PS克隆在长期繁衍过程中可能为了减少局部配偶竞争,形成了偏雌的性比分配机制。当其与非我克隆共存时,性雌蚜和雄蚜数量降低,胎生蚜数量激增(图1A)。PS克隆采集地处贵州北部山区,冬季平均气温在0度以上,胎生蚜可以越冬。当PS克隆面对来自非我克隆的竞争时,性母投资胎生蚜,可以让血缘后代在早春的竞争中占据优势。此外,性母产下的性雌蚜和雄蚜血缘系数(Coefficient of kinship)仅为0.5,而胎生蚜血缘系数为1,作为性母,在混合种群中投资胎生蚜能更好地将自身的基因传递下去。MS克隆2头区的后代性分化偏雌(图1B),换言之,随着种群中同克隆密度增加,MS克隆性母可能为了减少LMC带来的不利后果,增加对性雌蚜的投资,同时减少对雄蚜的投资。当MS克隆与异克隆共存时,性比分配模式与2头区相似(图1B)。蚜虫的性比也受干母竞争的影响,为了在来年的竞争中让血缘干母占据优势,蚜虫也可能会根据周围蚜虫分布调节自身后代的性比[30],MS克隆的性母在面对非我克隆的竞争时,也采取增加性雌蚜的方式进行应对,这样可以最大限度增加来年早春时血缘后代的数量。与PS克隆不同,MS克隆并未增加对胎生蚜投资,这可能是由于MS克隆采集地冬季平均气温在0度以下,胎生蚜无法越冬所导致。有研究表明在来自一年生寄主(豌豆)的豌豆蚜种群中,产生有翅雄蚜的比例较高,而在多年生寄主(紫花苜蓿)上,产生无翅雄蚜的比例较高[31],本研究结果与之相反。因此,雄蚜表型可能由寄主植物及气候等多因素决定。本研究中,Y克隆是基因突变体,其性分化在各试验区间并未无显著性差异,均为极端偏雌(图1C),这可能是由于其特殊的基因型所决定,在未来的工作中,有必要对其繁殖的分子机制进行详细研究。
有性世代的交配程度和性母对子代投资的时机均能影响蚜虫的性比[32],本研究中的3个克隆在性母产蚜开始后6 d内,均只产出性雌蚜,之后中止产蚜2~3 d,观察发现,恢复产蚜后数日内产出的个体大部分为雄蚜,随后各处理性母产出的后代出现不同程度的分化,这与前人研究结果[25,33]类似。雪虫性母产出1只性雌蚜所需的成本是雄蚜的1.85倍[34],因此,豌豆蚜性雌蚜和胎生蚜所需的成本可能也高于雄蚜,PS克隆的1头区和2头区雄蚜数高于异克隆共存区,所以恢复产蚜后1~3 d(即产蚜开始后9~11 d)的1头区(1PS)和2头区(2PS)的日产蚜数高于异克隆共存区(1PS+1MS和1PS+1Y)。在产蚜开始后第12 d,由于性母投资的胎生蚜胚胎发育完成,开始大量产出,使得异克隆共存区第12 d的产蚜数激增(图2A)。增殖率相近的蚜虫共存时,一方为了取得竞争胜利,会采取增加产子数的策略以取得竞争优势[35]。由图3A可知,PS克隆和Y克隆的性母在前6 d的增殖率差异不明显,在1PS+1Y处理中性母将大量资源投入给胎生蚜,PS克隆为了占据优势资源,在1PS+1Y处理中加速繁殖,最终总个体数大于1PS(图1A)。另一方面,MS克隆1头区(1MS)雄蚜数量显著高于其他处理(图1B),所以在第9-11 d的产蚜数均显著高于其他处理,在第12 d,由于2头区(2MS)和异克隆共存区(1MS+1PS和1MS+1Y)的性雌蚜胚胎发育完成大量产出,使得日产蚜数超过1MS(图2B)。因此,推测豌豆蚜性母在产蚜中止的时候会根据周围个体的数量和密度来决定之后的性投资。另外,由于Y克隆在各处理中性分化未出现差异,所以日产子数间也未发现差异性(图2C)。由图3B和图3C可知,MS克隆性母产蚜后的增殖率一直显著高于PS克隆和Y克隆,一开始便占据竞争优势,所以MS克隆在1MS+1PS和1MS+1Y处理中并未出现性母产蚜数大于1MS的情况。光周期能影响豌豆蚜的性分化[9,25],在日光照长度8-12 h范围内,随着光照时数的逐渐缩短,豌豆蚜雄蚜数量逐渐减少,而性雌蚜数量逐渐升高[25]。因此,相邻对象的类型和光周期对豌豆蚜性分化可能存在交互作用,今后还需对不同相邻对象和光周期协同作用下的豌豆蚜的性比变化进行探究。
蚜虫的表型分化与保幼激素3滴度有关[36-38],保幼激素滴还可能会对卵巢不同位置的胚胎产生不同的影响[39]。本研究中,MS克隆和PS克隆与不同克隆共存时,后代性分化从性母产蚜后第6 d起,均出现不同程度的变化,在测量第6 d各处理性母的保幼激素3滴度时也发现了不同程度的差异(图4),Y克隆各处理中后代性分化无明显差异,而它的保幼激素3滴度也未检测出差异(图4C)。当保幼激素滴度降低时,会产生雄蚜[40],当补充外源保幼激素使得保幼激素滴度增加时,会让性母的胎生蚜数量增加或者恢复孤雌生殖[41],本研究发现,性母保幼激素3滴度与雄蚜数呈负相关,与胎生蚜数呈正相关(表1),这一结果与前人研究[40-41]相符,但是性雌蚜的具体影响因子尚不明确。未来的工作中,有必要对不同处理下的性母施加不同浓度的保幼激素3,以进一步评估保幼激素3对豌豆蚜性比调控的影响。
4 结论
豌豆蚜的性母会根据周围相邻对象的种类和密度调整后代的性别比例,不同寄主种群的豌豆蚜会采取不同的性比调控策略,促进自身基因更广泛地传播,在性母对后代性比的调整过程中保幼激素3可能发挥了重要作用。
参考文献
[1]AGRAWAL A A. Phenotypic plasticity in the interactions and evolution of species[J]. Science,2001,294(5541):321-326
[2]THOMPSON J N. Variation in interspecific interactions[J]. Annual Review of Ecology and Systematics,1988,19:65-87
[3]ELLERS J E,TOBYKIERS C R,CURRIE B R,et al. Ecological interactions drive evolutionary loss of traits[J]. Ecology Letters,2012,15:1071-1082
[4]AGRAWAL A A,LAFORSCH C T,RALPH T. Transgenerational induction of defences in animals and plants[J]. Nature,1999,401:60-63
[5]OGAWA K,MIURA T. Aphid polyphenisms:trans-generational developmental regulation through viviparity[J]. Frontiers in Physiolog,2014,5:24478714
[6]EMDEN H F V,HARRINGTON R. In Aphids as crop pests[M]. 2nd ed. Oxford University Press:Oxford,2017:81-97
[7]GUILLON J M. Sex ratio evolution when fitness and dispersal vary[J]. Evolutionary Ecology,2016,30:1097-1115
[8]COLIZZI F S,DAVID M T,CHARLOTTE H F. The circadian and photoperiodic clock of the pea aphid[J]. Journal of Comparative Physiology A,2023:https://doi.org/10.1007/s00359-023-01660-8
[9]ERLYKOVA N. Inter- and intracional variability in the photoperiodic response and fecundity in the pea aphid Acyrthosiphon pisum (Hemiptera:Aphididae) [J]. European Journal of Entomology,2003,100:31-37
[10]MCLEAN A H C,HRCˇEK J,PARKER B J,et al. Multiple phenotypes conferred by a single insect symbiont are independent[J]. Proceedings of the Royal Society B:Biological Sciences,2020,287:20200562
[11]李杨,杨燕芬,陈明丽. 次生共生菌对红色型豌豆蚜有性世代生物学特性的影响[J].草地学报,2023,31(7):2012-2019
[12]LI Y,AKIMOTO S. Frequency-dependent selection acting on the widely fluctuating sex ratio of the aphid Prociphilus oriens[J]. Journal of Evolutionary biology,2017,30(7):1347-1360
[13]MATSUDA N,KANBE T,ENDO J,et al. Suppression of autumnal sexual morph production in spring by a seasonal timer in an aphid[J]. Physiological Entomology,2020,45(2-3):103-109
[14]ISHIKAWA A,OGAWA H,GOTOH T K,et al. Juvenile hormone titre and related gene expression during the change of reproductive modes in the pea aphid[J]. Insect Molecular Biology,2011,21(1):49-60
[15]TAGU D,SABATER-MUNÑOZ B,SIMON J C. Deciphering reproductive polyphenism in aphids[J]. Invertebrate Reproduction & Development,2005,48:71-80
[16]SUTHERLAND O R W,MITTLER T E. Sexual forms of the pea aphid, Acyrthosiphon pisum, produced on an artificial diet[J]. Entomologia Experimentalis et Applicata, 1969,12(2):240-241
[17]AGAWA H,KAWATA M. The effect of color polymorphism on mortality in the aphid Macrosiphoniella yomogicola[J]. Ecological Research,1995,10:301-306
[18]LOXDALE H,LUSHAI G,HARVEY J. The evolutionary improbability of ‘generalism’ in nature,with special reference to insects[J]. Botanical Journal of the Linnean Society,2011,103(1):1-18
[19]SATO Y S,CAN Y. The extremely female-biased sex ratio of the social spider mites be explained by Hamilton′s local mate competition model[J]. Ecological Entomology,2007,32(6):597-602
[20]LI Y,AKIMOTO S. Self and non-self recognition affects clonal reproduction and competition in the pea aphid[J]. Proceedings of The Royal Society B:Biological Science,2021,288(1953):20210787
[21]LI Y,AKIMOTO S. Evaluation of an aphid-rearing method using excised leaves and agar medium[J]. Entomological Science,2018,21(2):210-215
[22]XUE B,LEIBLER S. Benefits of phenotypic plasticity for population growth in varying environments[J]. Proceedings of the National Academy of Sciences of the United States of America,2018,115(50):12745-12750
[23]ULLER T. Developmental plasticity and the evolution of parental effects[J]. Trends in Ecology and Evolution,2008,23:432-438
[24]MOCZEK A P. Developmental plasticity and evolution-quo vadis?[J]. Heredity,2015,115:302-305
[25]张廷伟,陈万斌,刘长仲,等. 不同光周期条件下绿色型豌豆蚜性蚜分化规律研究[J]. 中国生态农业学报,2017,25(2):166-171
[26]TRIVERS R L,WILLARD D E. Natural selection of parental ability to vary the sex ratio of offspring[J]. Science, 179:90-92
[27]ASTARAKI M,RASEKH A,SHISHEHBOR P,et al. Mate choice in the parasitoid Lysiphlebus fabarum is conditioned by host species and influences progeny fitness[J]. Biological Control,2019,131:8-17
[28]MARTEL V,SHUKER D,BOULTON R,et al. Sex allocation and the evolution of insemination capacity under local mate competition[J]. Entomologia Experimentalis et Applicata,2016,159(2):230-242
[29]DUNCAN A,MARINOSCI C,DEVAUX C,et al. Transgenerational cues about local mate competition affect offspring sex ratios in the spider mite Tetranychus urticae[J]. BioRxiv,2017,24:2850-2854
[30]DAGG J L,VIDAL S. Sex ratio adjustment and maternal condition in two aphid species[J]. Behavioral Ecology and Sociobiology,2004,55:231-235
[31]FRANTZ A,PLANTEGENEST M,SIMON J C. Host races of the pea aphid Acyrthosiphon pisum differ in male wing phenotypes[J]. Bulletin of Entomological Research, 2010;100(1):59-66
[32]HARDY I C W. In Sex ratio[M]. 2nd ed. Cambridge:Cambridge University Press,2002:254-265
[33]LEES A D. The photoperiodic responses and phenology of an English strain of the pea aphid Acyrthosiphon pisum[J]. Ecological Entomology,1989,14(1):69-78
[34]AKIMOTO S,MITSUHASHI R,YOSHINO T. Female-biased sex allocation in wild populations of the eriosomatine aphid Prociphilus oriens:local mate competition or transgenerational effects of maternal investment?[J]. Population Ecology,2012,54(3):411-419
[35]李杨,杨燕芬. 竞争效应对红色型豌豆蚜繁殖的影响[J].草地学报,2023,31(1):180-186
[36]ISHIKAWA A,GOTOH H,ABE T,et al. Juvenile hormone titer and wing-morph differentiation in the vetch aphid Megoura crassicauda[J]. Journal of Insect Physiology,2013,59 (4):444-449
[37]GAO J,GUO H J,SUN Y C,et al. Juvenile hormone mediates the positive effects of nitrogen fertilization on weight and reproduction in pea aphid[J]. Pest Management Science,2018,74(11):2511-2519
[38]HARDIE J. The corpus allatum,neurosecretion and photo- periodically controlled polymorphism in an aphid[J]. Journal of Insect Physiology,1987, 33(3):201-220
[39]LOXDALE H D,BALOG A,BIRON D G. Aphids in focus:unravelling their complex ecology and evolution using genetic and molecular approaches[J]. Biological Journal of the Linnean Society,2020,129:507-531
[40]COLIZZI F S,MARTNEZ-TORRES D, HELFRICH-FRSTER C. The circadian and photoperiodic clock of the pea aphid[J]. Journal of Comparative Physiology A,2023:https://doi.org/10.1007/s00359-023-01660-8
[41]MITTLER T E,EISENBACH J,SEARLE J B,et al. Inhibition by kinoprene of photoperiod-induced male production by apterous and alate viviparae of the aphid Myzus persicae[J]. Journal of Insect Physiology, 1979, 25(3):219-226
(责任编辑 刘婷婷)
