纤维素降解菌和温度对水稻秸秆纤维降解和发酵品质的影响
2024-11-05杨丹周雨歆尹含雪陈丹丹张庆




摘要:本研究从白蚁肠道中筛选出了一株纤维素降解菌,并探讨其在不同温度下水稻(Oryza sativa L.)秸秆青贮中的发酵效果。青贮试验设置对照组(CK)和纤维素降解菌处理组(CS),纤维素降解菌添加量为1×107cfu·g-1,分别进行常温(28℃)和高温(37℃)青贮,30 d后取样分析青贮品质。结果表明,与对照组相比,添加纤维素降解菌在常温条件下能够显著增加乳酸菌数量和乳酸含量,显著降低pH值(P<0.05);在高温条件下降低了氨态氮含量,pH值显著下降(P<0.05)。两种温度条件下,添加纤维素降解菌均显著降低中性洗涤纤维和酸性洗涤纤维含量(P<0.05)。综上所述,纤维素降解菌有助于降解纤维素,促进乳酸发酵,对水稻秸秆青贮饲料发酵品质具有改善作用。在37℃条件下,水稻秸秆青贮饲料纤维降解效果更佳。
关键词:纤维素降解菌;纤维;水稻秸秆;温度;青贮
中图分类号:S816.53 文献标识码:A 文章编号:1007-0435(2024)10-3305-08
Effects of Cellulose-degrading Bacteria and Temperature on Fibre Degradation and Fermentation Quality of Rice Straw
YANG Dan, ZHOU Yu-xin, YIN Han-xue, CHEN Dan-dan, ZHANG Qing*
(College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou, Guangdong Province 510642, China)
Abstract:This study isolated a cellulose-degrading bacterium from the termite gut and investigated its fermentation effects on rice straw silage at different temperatures. The silage experiment included a control group (CK) and a cellulose-degrading bacterium treatment group (CS),with the addition of cellulose-degrading bacteria at a concentration of 1×107 cfu·g-1. Fermentation was conducted at room temperature (28℃) and high temperature (37℃) for 30 days,after which samples were taken for quality analysis. The findings indicated that compared to the control,the addition of the cellulose-degrading bacterium significantly increased the quantity and content of lactic acid bacteria,markedly reduced pH values (P<0.05) under normal temperature condition,and lowered ammonia nitrogen content (P>0.05) while significantly reducing pH values (P<0.05) under high-temperature condition. In both temperature conditions,the cellulose-degrading bacterium notably decreased the levels of neutral detergent fiber and acid detergent fiber content (P<0.05). In summary,the cellulose-degrading bacterium aided in cellulose degradation,promoted lactic acid fermentation,and improved the fermentation quality of rice straw silage. Particularly,the effectiveness of fiber degradation in rice straw silage feed was enhanced under 37℃ condition.
Key words:Cellulose-degrading bacteria;Fiber;Rice straw;Temperature;Silage
收稿日期:2024-04-08;修回日期:2024-06-12
基金项目:广州市科技特派员项目(2024E04J0301);国家重点研发项目(2022YFE0111000-2,2022YFD1300901)资助
作者简介:杨丹(1999-),女,汉族,江西南昌人,硕士研究生,主要从事牧草青贮加工研究,E-mail:ydycbwywtb@163.com;*通信作者Author for correspondence,E-mail:zqing1988@126.com
水稻(Oryza sativa L.)是我国最主要的粮食作物,随着水稻单产的增加,每年废弃水稻秸秆产量也在持续增加[1]。青贮是一种利用乳酸菌厌氧发酵调制天然饲草的方法,经过青贮发酵过的饲草具有较高的营养价值,且适口性强、消化率高、利用率高[2-3]。因此将水稻秸秆进行青贮发酵,不仅可以有效地解决冬季新鲜牧草不足的问题,还可以解决直接焚烧和填埋废弃秸秆所造成的环境污染和资源浪费问题[4]。然而,秸秆纤维素含量丰富,且内部结构稳定不易被降解,粗糙坚硬,适口性差,青贮后的水稻秸秆不利于畜禽营养吸收与消化,难以达到预期的效果[5]。因此,如何降低秸秆的纤维素含量,提升秸秆饲料适口性的同时增强其营养品质,为动物提供更为优质的饲料是亟需解决的问题。
纤维素酶能破坏植物细胞壁,将纤维降解为可利用的还原糖,促进动物营养吸收,整个反应过程中所需条件温和且生态友好,受到了越来越多人的关注[6]。近年来,研究者将目光聚焦到微生物产酶这一方法上,筛选并识别具有降解纤维素的功能性微生物,试图通过微生物之间的协同作用,以高效率、低成本的方式对植物中存在的纤维素进行降解[7-9]。一般情况下,所筛选的微生物中,真菌降解纤维素的能力较细菌强,但是由于其生长较慢、相关酶类较复杂,且热稳定较差,限制了它的生产,所使用的菌株仍然存在纤维素降解能力低、活性不够稳定和pH作用不显著等问题[10-11]。Li等[12]从蚕粪中分离到了三株纤维素降解菌,经过16S rRNA基因序列比对分析,分别鉴定为地衣芽孢杆菌、解淀粉芽孢杆菌和枯草芽孢杆菌,且这三株细菌展现了高效的降解纤维素能力,水解能力值在1.86~5.97之间,酶活力范围为5.07~7.31 U·mL-1。从中可以看出筛选降解纤维素的细菌更具有其独特的优势:(1)细菌培养周期短、生长速度快、可以依靠低成本的氮源和碳源作为纤维素酶生产的能源;(2)细菌纤维素基因表达量相对较高、相对容易获得;(3)细菌纤维素酶的热稳定性好,原核表达控制系统相对简单方便[13]。
微生物产酶降解植物性纤维素已成为当前较为普遍的研究,研究者们通过利用微生物产酶的方式来加速堆肥腐熟的效率以及促进生物能源的转化[14-15]。然而,关于在水稻秸秆中添加纤维素降解菌制成青贮饲料,从而降解纤维素并有效改善其发酵品质的研究较少。因此,本研究从白蚁肠道中筛选出一株高效纤维素降解菌,应用于水稻秸秆中,观察其在两种不同温度下的发酵效果,为促进纤维素降解菌在农作物秸秆青贮饲料中的应用,纤维的降解能力和水稻秸秆发酵品质的改善提供理论依据。
1 材料与方法
1.1 试验材料
本试验所选用的白蚁来自华南农业大学林学与风景园林学院昆虫生物防治实验室,于2023年1月对200只白蚁进行养殖后收集的新鲜白蚁肠道。水稻种植于华南农业大学启林北试验田(23°16′ N,113°36′ E),于2023年12月人工收割水稻秸秆,在实验室切成2 cm左右的水稻秸秆碎段,用微型植物粉碎机(天津市泰斯特仪器有限公司)将水稻秸秆粉碎成粉状。
1.2 试验设计
试验设置对照组(CK)和纤维素降解菌处理组(CS)。将青贮原料水分含量调到65%,把筛选的纤维素降解菌按照1×107cfu·g-1添加量加进水稻秸秆中,对照组添加等量的生理盐水,混合均匀后分别装入聚乙烯塑料包装袋中,每袋约100 g,然后用真空密封机密封,按照28℃和37℃分别进行常温和高温青贮,一共24青贮样品袋(4个处理×6个重复)。青贮30 d后对青贮饲料进行发酵品质、纤维含量和可溶性糖含量分析。
1.3 试验方法
1.3.1 菌株的分离与纯化 将采集到的白蚁肠道内容物放置于研磨仪中加入10 mL 0.9%生理盐水进行研磨成匀浆。并以10倍梯度对菌液进行逐层稀释直至10-7梯度,随后分别取100 μL各梯度液涂布到LB固体培养基上。待菌液放干后倒置放于37℃恒温培养箱培养2 d后,挑取单菌落划线培养,二代划线后转移至LB液体培养基中培养1 d。
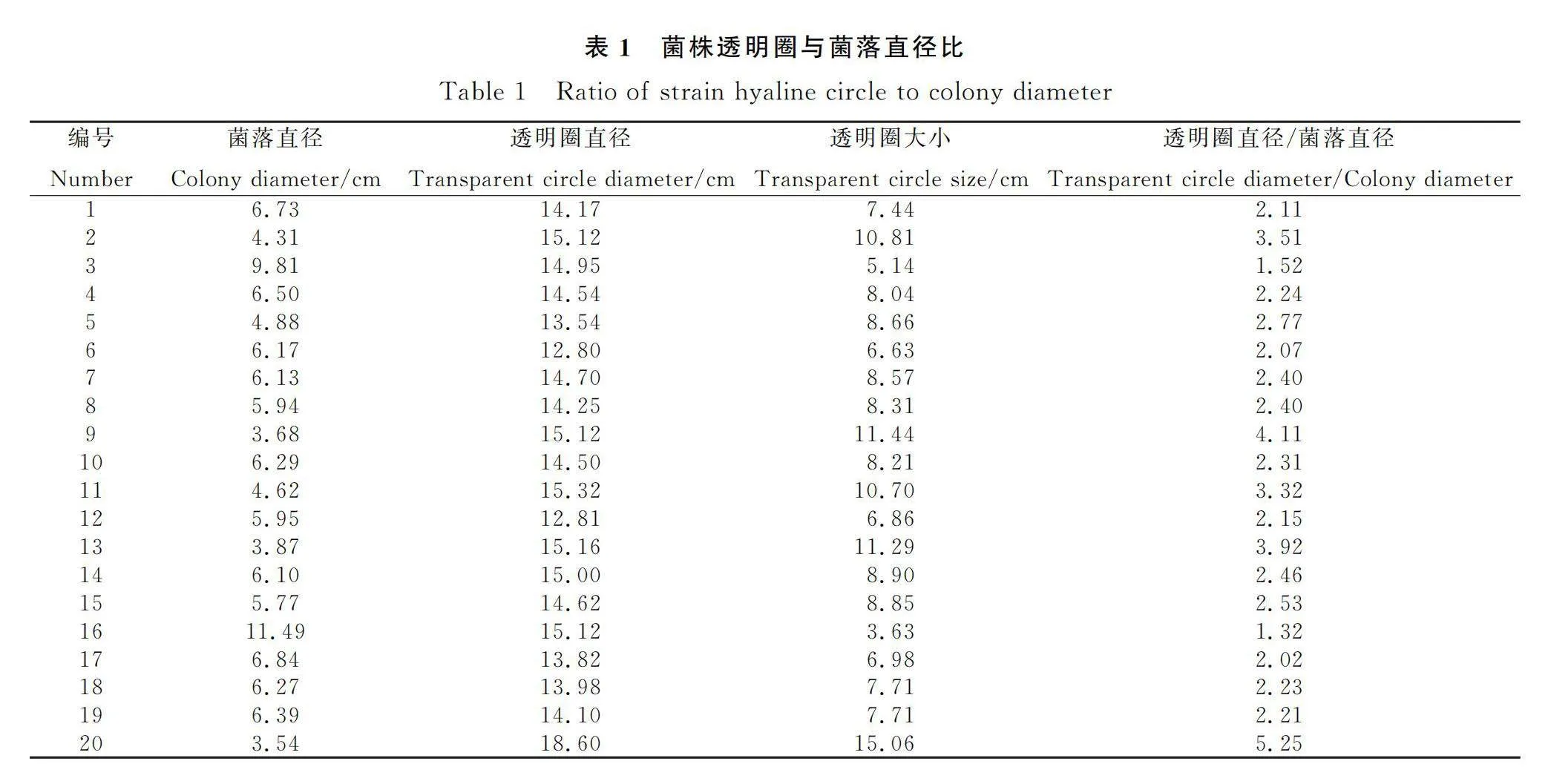
1.3.2 纤维素降解菌的初筛 取出上述菌液以0.5 μL以三点法接种到羧甲基纤维素钠固体培养基中,37℃培养2 d~4 d,待菌落长出来以后,将培养基平铺在试验台上,沿着培养基边缘缓慢加入5 mL 0.2%刚果红染液使其铺平整个平板后静置染色15~30 min,随后倒掉染液,加入5 mL的1 mol·L-1氯化钠溶液进行脱色30 min后倒掉。若菌落出现明显的透明圈则初步断定该菌株具有纤维素降解能力。用游标卡尺记录所筛选菌株的透明圈直径(D)与菌落直径(d),根据两者的比值大小(D/d)推测其产纤维素酶能力大小[16]。根据比值的大小选择酶活较高的菌株进行复筛。
1.3.3 纤维素降解菌的复筛 测定菌株的胞外酶活力,并筛选出一株酶活力较高的菌株用于水稻秸秆青贮,在常温和高温条件下比较青贮效果。(1)纤维素酶活测定:试验采用二硝基水杨酸法(Dinitrosalicylic acid,DNS)测定[17-19],将所筛选到的微生物按2%接种量加入50 mL液体产酶培养基中,37℃,以180 r·min-1恒温摇床上振荡培养48小时。取5 mL发酵液转入10 mL离心管8000 r离心10 min。取上清液0.5 mL作为粗酶液。空白对照为煮沸10 min灭活的等体积粗酶液,取0.5 mL粗酶液到20 mL试管中,加入1.5 mL的1%的底物,抽打混匀后将试卷放水浴锅50℃恒温条件酶解30 min,加入3 mL DNS溶液终止反应,充分混匀后沸水浴10 min,冷却后利用酶标仪比较540 nm处的吸光度,再代入所制作的葡萄糖标准曲线,得出纤维素降解菌所产生的葡萄糖含量。根据酶活力计算公式计算纤维素酶活性。(2)制作葡萄糖标准曲线:分别取1 mg·mL-1葡萄糖标准液0,0.4,0.6,0.8,1.0,1.2 mL加入到10 mL已标记的试管中,再依次加入2,1.8,1.6,1.4,1.2,1,0.8 mL蒸馏水,分别准确加入DNS试剂3 mL,沸水浴加热2 min。自来水冷却后,检测620 nm处吸光度,纵坐标为吸光度,横坐标为各标准浓度(mL),作图得到标准曲线。
1.3.4 菌株鉴定 根据SK8255 Ezup柱式细菌基因组DNA抽提试剂盒提取DNA,细菌通用引物扩增16S rDNA序列。PCR产物在1.5%琼脂凝胶,1×TAE缓冲液中进行电泳检测。将扩增产物送至生工生物工程(上海)股份有限公司进行测序,获得16S rRNA序列信息与GenBank基因库中的序列进行Blast相似性比较。
1.3.5 水稻秸秆青贮饲料发酵品质测定
(1)微生物数量测定
青贮30 d后开袋,混合均匀后使用五点法称取样品10 g,注入90 mL无菌生理盐水充分振荡混匀,将上清液从10-1至10-6进行梯度稀释,微生物数量测定采用平板计数法,乳酸菌和大肠菌分别采用MRS琼脂培养基和结晶紫中性红胆盐琼脂(VRBA)进行培养计数,酵母菌和霉菌采用孟加拉红培养基(虎红琼脂)进行培养计数[20]。
(2)pH值及有机酸测定
取10 g鲜样加入90 mL纯水于4℃冰箱浸泡过夜,24 h后取出用滤纸过滤后,使用雷磁PHS-3C型pH计(上海市精密科学仪器有限公司)测定滤液的pH值。其余滤液经0.22 μm孔径的滤膜进行过滤,采用岛津GC-14型高效液相色谱仪测定有机酸(乳酸、乙酸、丙酸和丁酸)含量。
(3)化学成分测定
采用蒽酮比色法测定可溶性碳水化合物,用葡萄糖制作标准曲线,将样品煮沸10 min,冷却过滤定容,吸取摇匀后加入蒽酮,在620 nm波长下测定吸光度,通过标准曲线计算原料中所含可溶性碳水化合物含量。取适量样品,称重记录,置于65℃恒温干燥箱烘干48 h,计算样品烘干后的重量与烘干前的重量的百分比就是干物质含量。根据Van Soest[21]的方法,使用纤维分析仪(2000,英国Ringbio)分析粗纤维、中性洗涤纤维和酸性洗涤纤维含量。
1.4 数据统计与分析
所有的试验数据统计分析均SPSS 27.0软件完成,采用独立样本T检验对不同温度下纤维降解菌添加处理的各个样本平均值之间差异进行比较,P<0.05为差异显著,P<0.01为差异极显著。所有图片则使用GraphPad Prism 8软件进行绘制后导出。
2 结果与分析
2.1 初筛纤维素降解菌
分离纯化后,通过初筛得到20株有透明圈的菌株,初步判定这些菌株具有产纤维素酶的能力,其中筛选出透明圈直径/菌落直径≥3的5株菌株,分别为2,9,11,13,20号菌株,菌株20的透明圈直径/菌落直径值最大,其次是菌株9。之后对这些比值较大的菌株进行复筛。
2.2 复筛纤维素降解菌
(1)葡萄糖标准曲线
通过DNS法测得葡萄糖标准曲线如图1所示,以三次重复值的均值得到葡萄糖标准曲线为y=2.666x-0.021,线性相关系数R2=0.999,由此可得,该标准曲线线性良好,达到基本要求。
(2)纤维素酶活力
对初筛后选出的5株菌进行酶活力测定,筛选出20号菌株透明圈与菌落直径最大且纤维素酶活力最高,因此20号菌株为最终获得的目的菌株。
2.3 纤维素降解菌16S rDNA鉴定
通过对复筛出的目的菌株进行提取DNA,以此模板进行PCR扩增,通过测序结果在NCBI网站进行Blast比对后,结果表明20号菌株归属于Cellulomonas sp.。
2.4 水稻秸秆化学成分和微生物组成
水稻秸秆的化学成分和微生物组成如表2所示。水稻秸秆干物质含量为54.67%;可溶性碳水化合物含量为3.50%DM;中性洗涤纤维含量和酸性洗涤纤维含量分别为83.91%和49.03%DM;原料表面附着的微生物数量丰富,其中乳酸菌和大肠杆菌分别为5.92和6.52 lg cfu·g-1 FW。
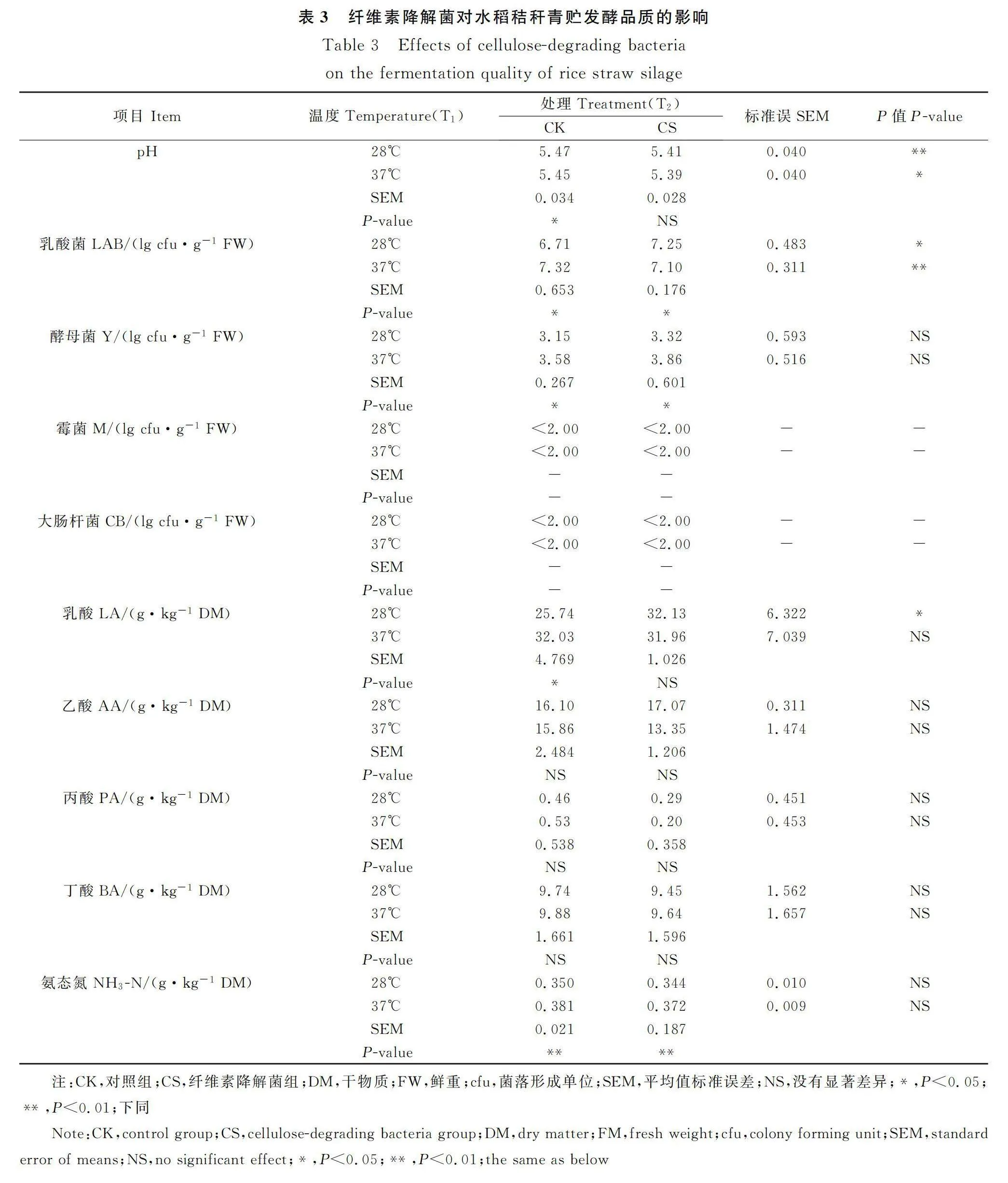
2.5 纤维素降解菌和温度对水稻秸秆青贮饲料发酵品质和微生物数量的影响
不同温度下纤维素降解菌对水稻秸秆青贮发酵品质如表3所示。两个温度条件下,添加纤维素降解菌后,水稻秸秆青贮饲料的pH值均显著降低(P<0.05)。当温度在37℃时,乳酸菌数量显著下降(P<0.05)。与此相反,乳酸菌数量和乳酸含量在常温条件下显著增加(P<0.05)。水稻秸秆自然青贮后,与28℃相比,37℃条件下的pH值显著降低,而乳酸含量、氨态氮含量、乳酸菌和酵母菌数量显著升高(P<0.05)。添加纤维素降解菌后,28℃下的乳酸菌,酵母菌数量和氨态氮含量较37℃显著增加(P<0.05)。
2.6 纤维素降解菌和温度对水稻秸秆青贮饲料纤维含量和碳水化合物含量的影响
由表4可知,相比常温条件下的CK组,37℃条件下自然青贮后水稻秸秆的可溶性碳水化合物含量显著增加,然而,添加CS后,可溶性碳水化合物含量显著降低(P<0.05)。在两种温度条件下,添加CS降低了中性洗涤纤维和酸性洗涤纤维含量,且中性洗涤纤维含量显著降低了近4个百分点,酸性洗涤纤维含量显著降低了近5个百分点(P<0.05)。当温度在37℃条件下,不论是自然青贮还是添加CS,酸性洗涤纤维含量显著降低(P<0.05)。
3 讨论
3.1 水稻秸秆营养成分
优质的水稻秸秆青贮的关键在于乳酸菌能否大量且迅速增殖。一般情况下,新鲜原材料本身附生乳酸菌的数量超过105cfu·g-1 FW就可以很好的满足青贮发酵品质[22]。本研究中的水稻秸秆乳酸菌数量正好符合快速发酵的要求,但不良微生物如酵母菌、霉菌和大肠杆菌的数量也较多,可能会增加营养物质的损耗,不利于青贮发酵。青贮原料中可溶性糖也是影响发酵品质的一个重要因素,充足的可溶性糖可以为乳酸菌提供充分的发酵底物[23]。水稻秸秆中可溶性碳水化合物大多是以木质纤维素(纤维素,半纤维素和木质素)的形式存在于细胞壁中,而水稻秸秆中纤维素含量最高,很难被乳酸菌充分利用[24-25]。同时,本研究中水稻秸秆的粗纤维、中性洗涤纤维和酸性洗涤纤维含量偏高,单独青贮不利于反刍动物消化,结果往往不理想。
3.2 纤维素降解菌和温度对水稻秸秆青贮发酵品质的影响
生产过程中通过应用添加剂来提高青贮发酵质量。纤维素降解菌产生的纤维素酶能够促进秸秆中结构性碳水化合物的分解,释放出额外的可溶性碳水化合物以补充乳酸菌发酵所需的底物,促进乳酸发酵,降低pH值并抑制有害微生物的活性,从而提高青贮发酵品质[26-27]。
本研究通过添加纤维素降解菌到水稻秸秆中发现,常温条件下添加CS,乳酸含量和乳酸菌数量显著增加,pH值显著降低,说明纤维素酶能够降解植物细胞壁为乳酸菌生长提供底物来源,促进乳酸增加,与王玉荣[28]和He等[29]观点一致,能有效抑制大肠杆菌和霉菌等不良微生物,加快乳酸的积累,降低pH值。确保厌氧环境是青贮饲料制作成功的关键因素,高温条件下,温度升高,酵母菌等其他不良微生物生长活跃,利用可溶性糖等营养物质产生乙醇和二氧化碳,导致本试验在水稻秸秆青贮中发现丁酸的存在,pH值下降迟缓,酵母菌数量和氨态氮含量显著增加[30]。
3.3 纤维素降解菌和温度对水稻秸秆可溶性碳水化合物和纤维的影响
常规青贮条件下,可溶性碳水化合物含量一般随青贮时间的延长呈现下降趋势[31]。然而,纤维素降解菌能分泌高活性纤维素酶,纤维素酶通过酶解作用能直接将水稻秸秆中的纤维素和半纤维素降解,释放可溶性糖[33-34]。在常温条件下,相较于CK,纤维素降解菌很好地发挥了酶解作用,增加了WSC含量。在高温条件水稻秸秆自然青贮下,WSC含量显著增加,这可能是使乳酸菌迅速增殖的最佳温度,其代谢产物乳酸含量增加,使pH维持稳定,抑制了好氧微生物对可溶性碳水化合物的分解,从而减少了对WSC的消耗量[23]。
纤维含量是评价青贮饲料的一个重要指标。水稻秸秆中拥有较高的粗纤维以及较低的可溶性碳水化合物含量,不利于动物的采食和干物质消化率,对动物生产性能也会产生影响[20]。本试验中,CF,NDF和ADF含量在添加CS的作用下均有所降低,尤其NDF和ADF含量显著低于对照组,这或许是因为纤维素降解菌在青贮过程中的酶解作用改变了水稻秸秆的细胞壁结构,持续对水稻秸秆中的纤维素和半纤维素进行降解[34]。这与Lee等研究结果相似[35],他们发现在水稻秸秆青贮过程中添加含有纤维素降解活性的真菌,真菌能够降解含木质素的植物结构,对纤维素和半纤维素的降解很有效,与对照组对比后,发现处理组均能降低青贮饲料的NDF和ADF含量。一般情况下,青贮后的NDF和ADF含量会比原料低。然而,本研究中发现青贮后高温和常温下的NDF和ADF含量均比原料高,37℃下添加纤维素降解菌的CF,NDF和ADF含量均低于28℃下储存的青贮饲料。这可能是青贮过程中营养物质被消耗,导致干物质含量中纤维含量占比更大[34-36]。高温下有利于促进具有纤维素分解活性的细菌生长。因此,当水稻秸秆在高温条件下,添加纤维素降解菌对青贮饲料纤维降解效果更佳。
4 结论
添加纤维素降解菌有助于水稻秸秆青贮饲料纤维素的降解,对青贮品质有一定的改善作用。本研究表明,纤维素降解菌的添加为青贮过程中微生物发酵提供了更多的发酵底物,两种温度条件下,中性洗涤纤维和酸性洗涤纤维含量均显著降低。常温条件下能够显著增加乳酸含量和乳酸菌数量,显著降低pH值,有利于改善水稻秸秆青贮饲料的发酵品质。总体而言,纤维素降解菌有助于降解纤维素,促进乳酸发酵,尤其在37℃条件下,水稻秸秆青贮的纤维降解效果更佳。
参考文献
[1]陈思凡. 甲酸、纤维素酶和纤维素降解菌对水稻、燕麦秸秆青贮过程中结构性碳水化合物降解的影响[D]. 南京:南京农业大学,2020:12-27
[2]张洪艳. 青贮饲料的种类、营养价值及其在反刍动物养殖中的应用[J]. 四川畜牧兽医,2024,51(2):35-37
[3]LIAO C,TANG X,LI M,et al. Effect of lactic acid bacteria,yeast,and their mixture on the chemical composition,fermentation quality,and bacterial community of cellulase-treated Pennisetum sinese silage[J]. Frontiers in Microbiolgy,2022,13:1047072
[4]吴硕,邹璇,王明亚,等. 陈皮柑汁对柱花草和水稻秸秆青贮品质的影响[J]. 草地学报,2021,29(7):1565-1570
[5]周苗育,武伟成,肖定福,等. 不同酶制剂组合对水稻秸秆青贮品质和体外瘤胃发酵特性的影响[J]. 动物营养学报,2023,35(6):3856-3866
[6]何家俊,赵国强,李莉,等. 纤维素酶对玉米秸秆与酒糟混合青贮营养成分、发酵品质、瘤胃体外降解率及微生物多样性的影响[J]. 动物营养学报,2023,35(5):3190-3200
[7]DOUD D,BOWERS RM,SCHULZ F,et al. Function-driven single-cell genomics uncovers cellulose-degrading bacteria from the rare biosphere[J]. ISME J,2020,14(3):659-675
[8]FLINT HJ,SCOTT KP,DUNCAN SH,et al. Microbial degradation of complex carbohydrates in the gut[J]. Gut Microbes,2012,3(4):289-306
[9]CAPOLUPO L,FARACO V. Green methods of lignocellulose pretreatment for biorefinery development[J]. Applied Microbiolgy and Biotechnololgy,2016,100(22):9451-9467
[10]孟建宇,徐慧欣,纳荷芽. 青贮饲料中纤维素降解细菌的分离与鉴定[J]. 中国饲料,2018(15):45-47
[11]郭威,郭晓军,武红敏,等. 青贮用产纤维素酶菌株3X-10的产芽孢条件优化[J]. 中国饲料,2017(10):23-27
[12]LI H,XU X,ZHANG M,et al. Accelerated degradation of cellulose in silkworm excrement by the interaction of housefly larvae and cellulose-degrading bacteria[J]. Journal of Environmental Management,2022,323:116295
[13]韩珍珍. 猪尸体堆肥中高温纤维素降解菌的筛选[D]. 武汉:华中农业大学,2020:15-29
[14]SILVA RC,CAMARGO FP,SAKAMOTO IK,et al. Metataxonomic characterization of an autochthonous and allochthonous microbial consortium involved in a two-stage anaerobic batch reactor applied to hydrogen and methane production from sugarcane bagasse[J]. Enzyme and Microbial Technology,2023,162:110119
[15]MA L,SUN R,YANG H,et al. Metagenomics analysis revealed the coupling of lignin degradation with humus formation mediated via shell powder during composting[J]. Bioresoure Technology,2022,363:127949
[16]郭晓杰. 纤维素降解菌的筛选鉴定及降解条件优化[D]. 烟台:烟台大学,2020:10-30
[17]钱林,郑巧利,付瑾,等. 一株高效纤维素降解菌株的分离鉴定及其酶学性质[J]. 微生物学通报,2010,37(4):524-528
[18]姚晓红,孙宏,沈琦,等. 纤维素降解菌的筛选及其对西兰花废弃茎叶品质的改善[J]. 浙江农业科学,2024,65(2):459-464
[19]杨艳华. 农作物秸秆高效降解菌的筛选与菌剂制备研究[D]. 杭州:浙江农林大学,2020:15-26
[20]杨丹,吴硕,陈丹丹,等. 黄梁木精油活性成分测定及其对全株玉米青贮有氧稳定的影响[J]. 草地学报,2023,31(9):2860-2867
[21]VAN SOEST P J,ROBERTSON J B,LEWIS B A. Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science,1991,74(10):3583-3597
[22]吕竑建,郭香,陈德奎,等. 植物乳酸菌和贮藏温度对辣木叶青贮品质的影响[J]. 草业学报,2021,30(3):121-128
[23]任海伟,孙文丽,裴佳雯,等. 不同温度下干玉米秸秆与废弃白菜混贮品质差异及微生物多样性[J]. 应用基础与工程科学学报,2020,28(4):788-804
[24]王晓萌. 纤维素降解菌剂发酵玉米秸秆过程中秸秆饲料主要品质指标的分析[D]. 呼和浩特:内蒙古农业大学,2018:19-45
[25]SUNH,LIAO C,CHEN L,et al. Potential for volatile fatty acid production via anaerobically-fermenting rice straw pretreated with silage effluent and phenyllactic acid[J]. Bioresource Technology,2023,369:128355
[26]李君风,原现军,董志浩,等. 西藏地区牦牛瘤胃中兼性厌氧纤维素降解菌的分离鉴定[J]. 草业学报,2017,26(6):176-184
[27]SU R,NI K,WANG T,et al. Effects of ferulic acid esterase-producing Lactobacillus fermentum and cellulase additives on the fermentation quality and microbial community of alfalfa silage[J]. PeerJ,2019,7:e7712
[28]王玉荣. 不同微生态制剂对稻秸分子结构及瘤胃降解特性的影响[D]. 阿拉尔:塔里木大学,2017:16-26
[29]HE L,ZHOU W,WANG C,et al. Effect of cellulase and Lactobacillus casei on ensiling characteristics,chemical composition,antioxidant activity,and digestibility of mulberry leaf silage[J]. Journal of Dairy Science,2019,102(11):9919-9931
[30]黄勤楼,钟珍梅,黄秀声,等. 纤维素降解菌的筛选及在狼尾草青贮中使用效果评价[J]. 草业学报,2016,25(4):197-203
[31]刘艳. 饲用苎麻木质纤维素降解菌的筛选、鉴定与对青贮品质影响的研究[D]. 长沙:湖南农业大学,2019:15-30
[32]XU J,ZHANG K,LIN Y,et al. Effect of cellulase and lactic acid bacteria on the fermentation quality, carbohydrate conversion,and microbial community of ensiling oat with different moisture contents[J]. Front in Microbiology,2022,13:1013258
[33]DU Z,YAMASAKI S,OYA T,et al. Cellulase-lactic acid bacteria synergy action regulates silage fermentation of woody plant[J]. Biotechnology Biofuels and Bioproducts,2023,16(1):125
[34]CHEN C,XIN Y,LI X,et al. Effects of Acremonium cellulase and heat-resistant lactic acid bacteria on lignocellulose degradation,fermentation quality,and microbial community structure of hybrid elephant grass silage in humid and hot areas[J]. Front in Microbiology,2022,13:1066753
[35]LEE S M,GUAN L L,EUN J S,et al. The effect of anaerobic fungal inoculation on the fermentation characteristics of rice straw silages[J]. Journal of Applied Microbiology,2015,118(3):565-573
[36]WILSON J R, DEINUM B, EUGELS F M. Temperature effects on anatomy and digestibility of leaf and stem of tropical and temperate forage species[J]. Netherlands Journal of Agricultural Science,1991,39(1):31-48
(责任编辑 闵芝智)
