外源谷胱甘肽对白粉菌胁迫下草地早熟禾抗氧化系统的影响
2024-11-05吴凡赵宇民张艺凝许志宇高鹏赵祥朱慧森梁银萍
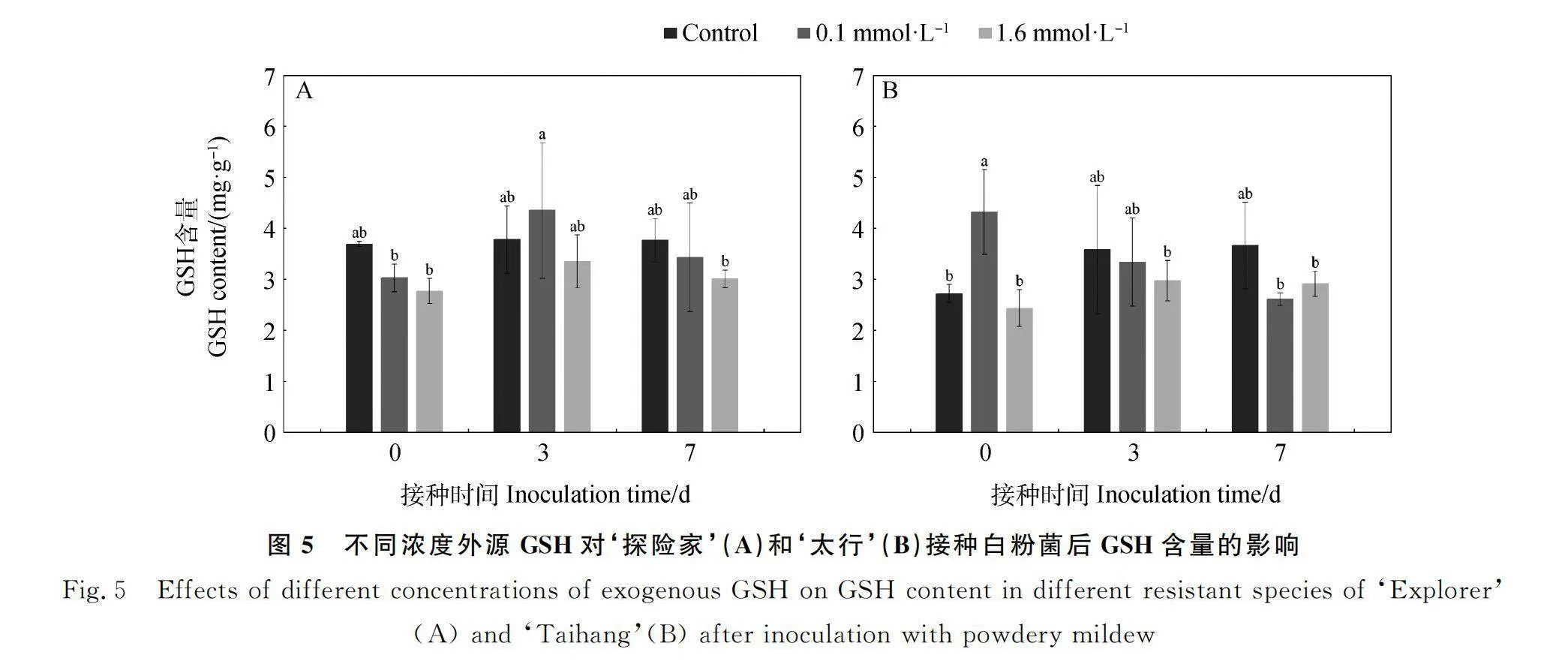

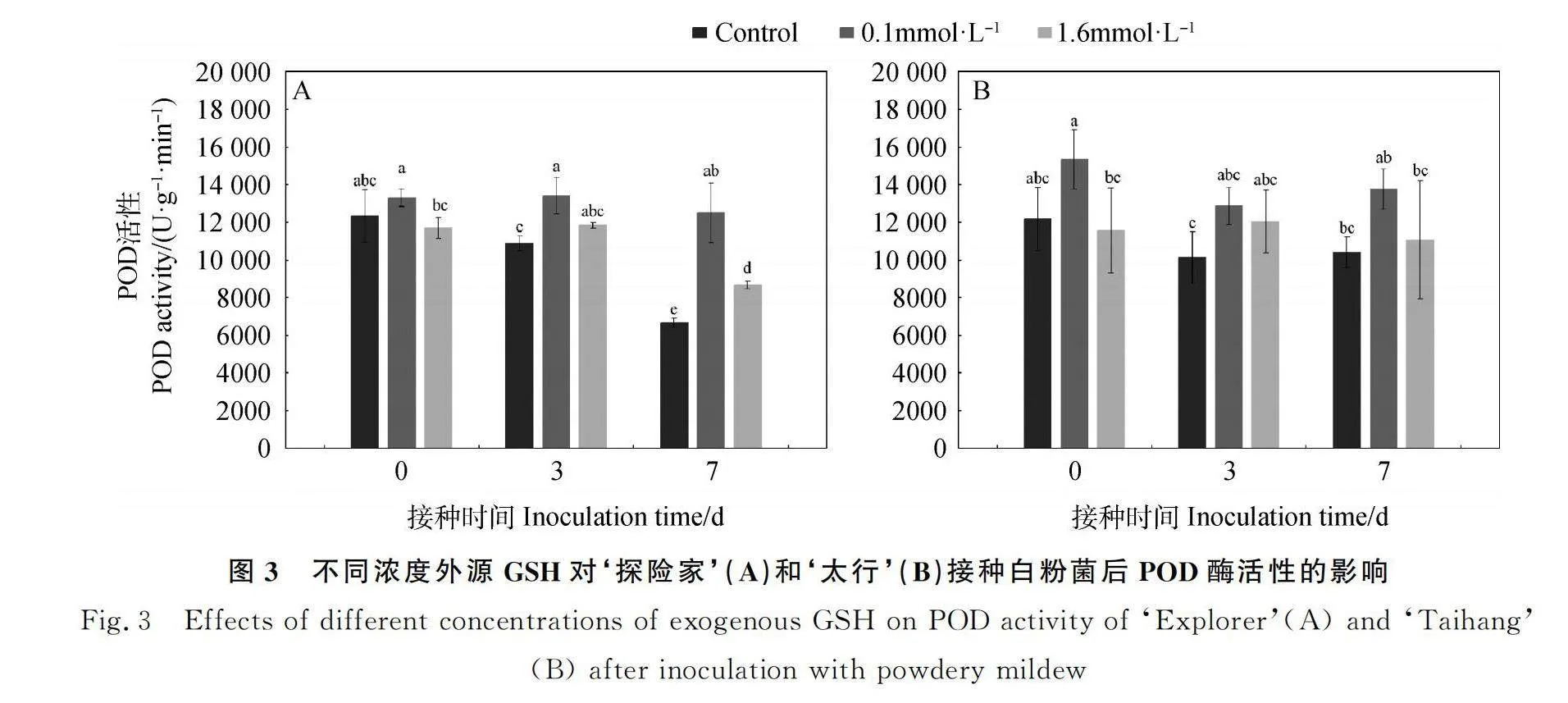
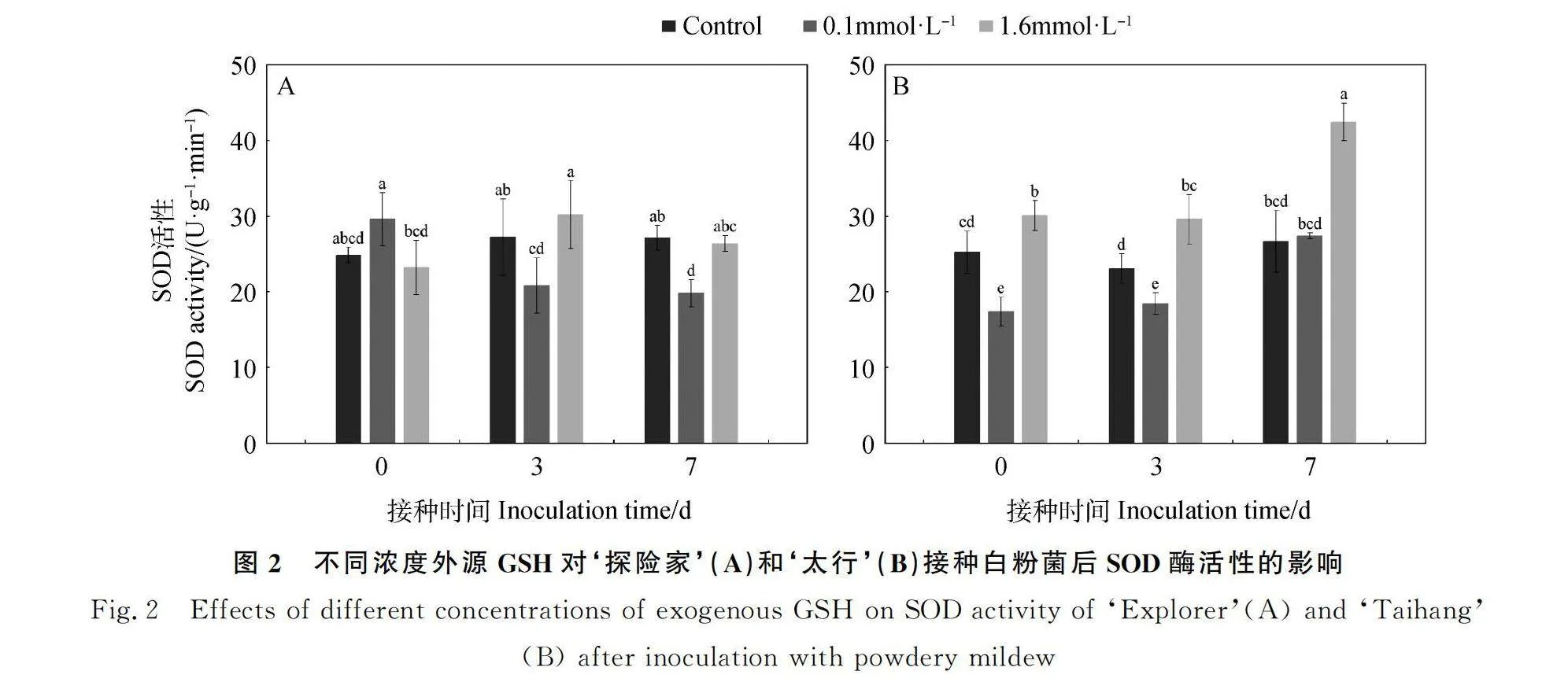

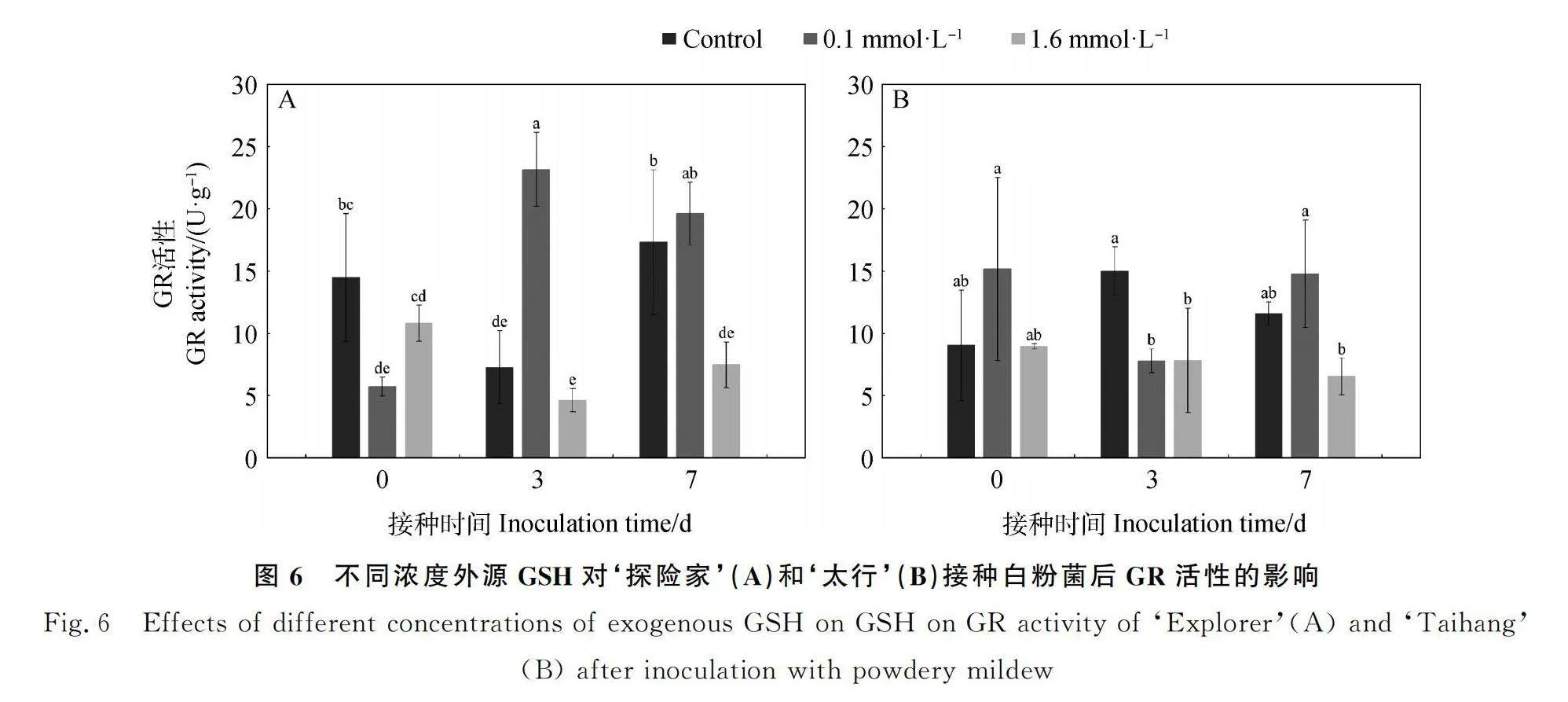

收稿日期:2024-05-28;修回日期:2024-07-23
基金项目:山西农业大学博士科研启动经费(2020BQ74);山西省高等学校科技创新项目(2021L166);博士来晋工作奖励资金科研项目(SXBYKY2021023);山西省中央引导地方科技发展资金(YDZJSX2022B006);山西省重点研发计划(202102140601006)资助
作者简介:吴凡(1999-),女,蒙古族,内蒙古呼和浩特人,硕士研究生,主要从事牧草病害防治研究,E-mail:17836504181@163.com;*通信作者Author for correspondence,E-mail:liangyinping3@163.com
摘要:草地早熟禾(Poa pratensis L.)白粉病的发生严重影响其观赏价值和使用年限。谷胱甘肽(Glutathione,GSH)作为植物体内关键的抗氧化剂在植物抵御病原菌侵染过程中起重要作用。为探讨外源GSH调控下植物抗氧化系统在草地早熟禾抗白粉病中的角色,本研究以草地早熟禾中抗品种‘太行’和极感品种‘探险家’为材料,通过喷施0.1 mmol·L-1和1.6 mmol·L-1外源GSH,测定接种白粉菌后3 d和7 d植物抗氧化系统相关指标。结果表明在白粉菌侵染早期施用0.1 mmol·L-1 GSH后草地早熟禾的超氧化物歧化酶(Superoxide dismutase,SOD)活性与抗病性呈负相关关系,过氧化物酶(Peroxidase,POD)活性与抗病性呈正相关关系;谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和谷胱甘肽巯基转移酶(Glutathione S-transferase,GST)活性显著提高(P<0.05),0.1 mmol·L-1 GSH处理下草地早熟禾抗病能力更强。本研究明确了外源GSH通过调控草地早熟禾抗氧化系统增强白粉病抗性的生理生化机制,为防治草地早熟禾白粉病提供了理论依据。
关键词:草地早熟禾;白粉病;谷胱甘肽;抗氧化系统
中图分类号:S435.121.46 文献标识码:A 文章编号:1007-0435(2024)10-3080-11
Effects of Exogenous Glutathione on Antioxidant System of Poa pratensis L. under Powdery Mildew Stress
WU Fan, ZHAO Yu-min, ZHANG Yi-ning, XU Zhi-yu, GAO Peng, ZHAO Xiang, ZHU Hui-sen, LIANG Yin-ping*
(College of Grassland Science, Shanxi Agricultural University, Taigu, Shanxi Province 030801, China)
Abstract:The occurrence of powdery mildew in kentucky bluegrass (Poa pratensis L.) seriously affects its ornamental value and life span. Glutathione (GSH) as a key antioxidant in plants plays an important role in the defense of plants against pathogen. In order to explore the role of plant antioxidant system under the regulation of exogenous GSH in the resistance of P.pratensis to powdery mildew,the medium-resistant variety ‘Taihang’ and the highly susceptible variety ‘Explorer’ were used as materials in this study. By spraying 0.1 mmol·L-1 and 1.6 mmol·L-1 exogenous GSH,the antioxidant indexes of plants were measured at 3 days and 7 days after inoculation with powdery mildew. The results showed that the activity of superoxide dismutase (SOD) in P.pratensis was negatively correlated with the disease resistance,and the activity of peroxidase (POD) was positively correlated with the disease resistance after the application of 0.1 mmol·L-1 GSH at the early stage of powdery mildew infection (P<0.05). The activities of glutathione peroxidase (GPX) and glutathione S-transferase (GST) were significantly increased (P<0.05),and the resistance of P.pratensis to powdery mildew was stronger under 0.1 mmol·L-1 GSH treatment. The present study clarified the physiological and biochemical mechanism of exogenous GSH enhancing plant powdery mildew resistance by regulating the antioxidant system of P. pratensis,which provided a theoretical basis for the prevention and control of powdery mildew in P.pratensis.
Key words:Poa pratensis L.;Powdery mildew;Glutathione;Antioxidant system
草地早熟禾(Poa pratensis L.)是一种被广泛应用于城市园林绿化和运动场建植的优质多年生冷季型草坪草[1-3]。随着我国草坪种植面积的日益增加和集约化管理水平的提升,草坪病害已成为影响草坪品质和使用年限的重要因素[4]。白粉病(Powdery mildew)是禾草上一种常见的茎叶病害,其病原菌为禾布氏白粉菌(Blumeria graminis)[5],是草坪上常见的多循环病害,可通过空气、风或昆虫等传播到寄主植物表面,引起大面积流行,严重影响植物的坪用价值和饲用价值,增加防治难度[6-8]。草地早熟禾白粉病的病原菌为禾布氏白粉菌早熟禾专化型(Blumeria graminis f. sp. Poae)[9],其侵染植物时,菌丝体叶表寄生,以叶正面为主。白粉病会危害草地早熟禾整个地上器官,严重影响植株光合作用,植株呼吸强度和蒸腾速率大幅提高,甚至导致叶片干枯死亡[2,10]。
在植物抵御病原微生物入侵的过程中,植株的免疫系统会被激活,进而刺激并启动一系列防御反应,会产生大量活性氧(Reactive oxygen species,ROS)[11]。植物中ROS的增加会诱导局部细胞死亡,并促使ROS清除系统迅速激活,以应对氧化应激[12]。病原菌侵染植物时会促使植物体内抗氧化系统迅速响应,该系统由酶类及非酶类组分协同作用。酶类成分主要包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、过氧化氢酶(Catalase,CAT)、谷胱甘肽巯基转移酶(Glutathione S-transferase,GST)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和谷胱甘肽还原酶(Glutathione reductase,GR),非酶类组分包括还原型谷胱甘肽(Glutathione,GSH)和抗坏血酸(Ascorbic acid,AsA)。该系统高效清除产生的ROS,维持细胞氧化还原平衡,保护细胞结构与功能,是植物抗病机制的重要组成部分[13-14]。Wang等[15]研究发现,柱花草(Stylosanthes spp.)受炭疽病菌(Colletotrichum gloeosporioides)侵染后幼苗叶片中SOD,POD,CAT,GPX和GR活性及AsA和GSH含量均呈现上升趋势。研究发现在高粱(Sorghum bicolor)[16]和菜豆(Phaseolus vulgaris)[17]中抗氧化酶的活性也会在病原菌侵染后增加。
GSH是植物细胞内重要的氧化还原缓冲物质[18],在植物体的复杂生命活动中扮演着不可或缺的角色,参与细胞代谢过程中产生的多余活性氧自由基的清除、过氧化物的还原、对氧化还原敏感信号的传导、与异源有毒物质络合、调控植物生长发育以及对各种逆境胁迫的抵抗[19-21]。GSH在植物应对胁迫时发挥的作用与其含量、氧化还原状态(还原型谷胱甘肽/氧化型谷胱甘肽GSH/GSSG比率)以及其合成代谢相关的酶类活性的提高或诱导密切相关[22]。GR,GPX和GST是谷胱甘肽代谢中重要的三种酶,它们是植物体内抗氧化防御体系的重要组成部分,研究发现它们酶活性的提高,可增强植物对各种环境胁迫的抵抗力[23]。GR通过使植物体内谷胱甘肽库保持在还原状态参与抗氧化防御,从而减轻病原菌引起的氧化应激[23]。GPX在植物受到侵害时被诱导产生,参与了膜脂过氧化物和过氧化氢的脱毒[24]。GST与植物对亲电子有毒物质的清除过程有关[25]。前人研究表明谷胱甘肽能够通过保护植物免受活性氧的损害、激活防御机制、调节代谢过程以及维持氮素平衡等多种方式,帮助植物抵御病害的侵害,这表明谷胱甘肽在植物抵御病原菌过程中起着重要的作用[26]。目前,对于GSH的研究主要集中在干旱、盐碱和重金属等植物非生物胁迫中,对GSH在植物生物胁迫中的影响研究较少。Kunstler等[27]研究表明,NahG转基因烟草在水杨酸(Salicylic acid,SA)缺乏的条件下较野生型更易感白粉菌,发病程度严重,但通过提高GSH水平可使其基础抗性增强,将植物对白粉菌的抗性恢复到野生型水平;Otulak等[28]研究马铃薯叶片谷胱甘肽的含量及其与不同品种马铃薯Y病毒病(PVYNTN)相互作用时发现谷胱甘肽是PVYNTN-马铃薯病理系统中信号传导和调控网络的重要组成部分,在对PVYNTN的抗性反应中,谷胱甘肽通过减少对宿主植物细胞的潜在损害来激活植物防御,导致感病程度降低。
国内外关于谷胱甘肽与植物抗白粉病的相关研究主要集中在小麦(Triticum aestivum Linn.)[29]、烟草(Nicotiana tabacum L.)[27]及番茄(Solanum lycopersicum)[30]等植物上,而对草地早熟禾白粉病的研究主要集中在病原物鉴定、抗性品种筛选和病害防治三方面,尚未有谷胱甘肽抵抗白粉菌的相关研究,对外源谷胱甘肽在草地早熟禾抵御白粉菌侵染过程中起到的作用尚不明确。因此本研究使用单孢子堆分离纯化的草地早熟禾白粉菌菌株BGP(TG),以对BGP(TG)中抗的草地早熟禾‘太行’和对BGP(TG)极感的草地早熟禾‘探险家’为材料,测定不同浓度GSH处理下不同抗性品种草地早熟禾抗氧化系统相关指标的变化,进而探讨草地早熟禾的不同抗性品种受白粉菌胁迫时GSH起到的作用,进一步阐明GSH与草地早熟禾白粉病抗性之间的内在联系,为草地早熟禾白粉病的防控策略构建理论框架,深入研究草地早熟禾如何通过GSH代谢来抵抗白粉病,并为草地早熟禾白粉病的综合防治提供依据。
1 材料与方法
1.1 供试材料
供试草地早熟禾:‘太行’和‘探险家’草地早熟禾。‘太行’草地早熟禾对供试白粉菌中抗[9],由山西农业大学草业学院提供;‘探险家’草地早熟禾对供试白粉菌极感[9],购于北京正道种业有限公司。
供试白粉菌:禾布氏白粉菌早熟禾专化型(B. graminis f. sp. poae)菌株BGP(TG)利用单孢子堆分离的方法分离、纯化自山西农业大学草业学院温室(37°25′N,112°35′E)发病的草地早熟禾,在感病‘探险家’草地早熟禾叶片上活体培养保存[9,31]
1.2 种子处理与幼苗培育
选取大小均匀且籽粒饱满的‘太行’和‘探险家’的种子,使用75%的乙醇将种子浸泡1 min进行表面消毒,然后使用无菌水冲洗种子3~5次至酒精味去除,冲洗完成后,使用灭菌滤纸将种子表面的水分吸干。将育苗基质∶沙子=2∶1混合均匀后装入32孔育苗穴盘(长×宽×高=540 mm×280 mm×110 mm)中,平整土壤表面,按10 g·m-2的播种量均匀撒播草地早熟禾种子,覆2~3 mm蛭石。播种完成后用水浸灌浇透,在恒温光照培养箱(RGL-P1000型)中随机区组培养,条件设置光/暗周期为16 h/8 h,温度为20℃,相对湿度为(60±2)%。每5天浸灌1次,待播种1个月后,进行后续试验。
1.3 白粉菌密集抖落接种法
草地早熟禾禾布氏白粉菌在感病草地早熟禾扩繁培养,接种10 d后发病的叶片作为每次接种的来源。利用白粉菌分生孢子密集抖落方法,对草地早熟禾进行接种,接种的孢子密度为100~200 个·mm-2[32]。
1.4 外源谷胱甘肽对草地早熟禾白粉病抗性的影响
将‘探险家’草地早熟禾按1.2进行培养1个月后,用0.1 mmol·L-1,0.4 mmol·L-1,1.6 mmol·L-1和6.4 mmol·L-1共4个浓度的GSH及蒸馏水对照对叶面进行喷施处理,每1 d喷施1次,共处理3次,1 d后接种白粉菌,接种9 d后统计严重度并计算病情指数,每个处理设置3个生物学重复,每个重复随机调查25株;筛选出最适浓度进行后续抗氧化系统指标的测定。
参考董文科对草地早熟禾白粉病严重度分级标准[33]:0级(无症状);1级(少量细小模糊的白粉斑,病斑面积占整个叶面积的5%以下);3级(白粉层薄,病斑面积占整个叶面积的6%~10%);5级(白粉层较厚,病斑面积占整个叶面积的11%~20%);7级(白粉层厚,病斑面积占整个叶面积的21%~40%);9级(白粉层厚,病斑面积占整个叶面积的40%以上)。
病情指数(DI)=∑各级病叶数×分级叶数总和×最高分级×100
1.5 草地早熟禾抗氧化系统指标的测定
将‘探险家’和‘太行’2个品种草地早熟禾按文中1.2进行培养。1个月后,用0.1 mmol·L-1和1.6 mmol·L-1的GSH及蒸馏水对草地早熟禾叶面进行喷施处理,每1 d喷施1次,共处理3次,1 d后接种白粉菌,分别在接菌的第0 d,3 d,7 d采集2个品种的草地早熟禾叶片,在液氮中速冻,储存在-80℃超低温冰箱中备用。
(1)抗氧化酶活性指标的测定
取草地早熟禾叶片0.05 g,加入磷酸盐缓冲液(Phosphate buffered saline,PBS)在冰浴中研磨,离心后取上清液得酶液,SOD活性采用氮蓝四唑(Nitrotetrazolium blue chloride,NBT)法测定[34],将酶液与NBT等试剂混合,在光照下反应,通过比色测定SOD对NBT光化学还原的抑制程度计算SOD活性;POD活性采用愈创木酚法测定[34],将酶液与愈创木酚、过氧化氢反应后测定470 nm吸光值,根据公式计算POD活性;CAT活性采用紫外吸收法测定[35],将酶液与过氧化氢反应,测定反应液240 nm吸光值变化。根据标准曲线计算CAT活性。
(2)GSH代谢相关酶活性测定
GSH代谢相关酶活性均采用南京建成生物工程研究所的试剂盒进行测定。取草地早熟禾叶片0.05 g,加入生理盐水制成10%匀浆液,4℃条件下使用研磨仪进行研磨后,2500 r·min-1,离心10 min,取匀浆上清液后按照说明书加入各个酶的提取液混匀,4000 r·min-1离心10 min,取上清液进行显色反应,静置后使用酶标仪测定420 nm吸光值,计算GSH含量;使用酶标仪测定340 nm吸光值,计算GR活性;使用酶标仪测定412 nm吸光值,计算GPX活性;使用酶标仪测定412 nm吸光值,计算GST活性。
1.6 数据分析
数据处理和统计分析借助于Microsoft Excel 2016和SPSS 26.0软件进行(单因素方差分析,Duncan多重比较法),制图通过Origin 2021软件完成。
2 结果与分析
2.1 外源GSH对草地早熟禾接种白粉菌后病情指数的影响
喷施不同浓度GSH对‘探险家’白粉病病情指数的影响有较大差异(图1)。从病情指数来看,0.1 mmol·L-1 GSH处理接种白粉菌后病情指数显著低于其他处理(P<0.05),且病情指数会随喷施浓度的增加而升高,在1.6 mmol·L-1 GSH处理时,升至最高,显著高于6.4 mmol·L-1 GSH处理(P<0.05)。根据不同浓度外源GSH处理下草地早熟禾接种白粉菌后的病情指数,选择0.1 mmol·L-1,1.6 mmol·L-1 和未喷施(对照处理)GSH 3个处理进行后续试验指标的测定。
2.2 外源GSH对‘探险家’和‘太行’接种白粉菌后抗氧化酶活性的影响
2.2.1 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后SOD活性的影响 如图2所示,随着接种时间的增加,对照处理下‘探险家’(图2A)SOD活性在各时间点无显著差异。0.1 mmol·L-1 GSH处理下,SOD活性在0 d时最高,显著高于3 d和7 d(P<0.05);1.6 mmol·L-1 GSH处理下,SOD活性在3 d时最高,显著高于0 d(P<0.05),但和7 d无显著差异。对照处理下‘太行’(图2B)SOD活性在0 d,3 d和7 d时均无显著差异。0.1 mmol·L-1 GSH处理下,SOD活性在7 d时达到最大;1.6 mmol·L-1 GSH处理下,SOD活性在7 d时达到最大。未接种白粉菌时(0 d),‘探险家’0.1 mmol·L-1 GSH处理的SOD活性显著高于1.6 mmol·L-1 GSH处理(P<0.05),‘太行’0.1 mmol·L-1 GSH处理的SOD活性显著低于对照及1.6 mmol·L-1 GSH处理(P<0.05);‘探险家’和‘太行’在接种白粉菌3 d和7 d后,0.1 mmol·L-1 GSH处理的SOD活性均显著低于1.6 mmol·L-1 GSH处理(P<0.05)。0.1 mmol·L-1 GSH处理下未接种白粉菌(0 d)和白粉菌侵染初期(3 d)抗性品种‘太行’的SOD活性均低于感病品种‘探险家’,分别是‘探险家’的59%和89%。
2.2.2 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后POD活性的影响 如图3所示,随着接种时间的增加,对照处理下‘探险家’(图3A)POD活性在0 d时最高,显著高于7 d(P<0.05),在7 d时POD活性最低。0.1 mmol·L-1 GSH处理下,POD活性各处理间无显著差异;1.6 mmol·L-1 GSH处理下,POD活性在3 d时最高,在7 d时最低。对照处理下‘太行’(图3B)POD活性先降低后升高,在3 d时最低,但各时间点无显著差异;0.1 mmol·L-1 GSH处理下,POD活性在3 d时最低,与0 d和7 d无显著差异;1.6 mmol·L-1 GSH处理下,POD活性在各时间点无显著差异。‘探险家’和‘太行’的POD活性在未接种白粉菌时(0 d),对照均与其他两个处理无显著差异,0.1 mmol·L-1 GSH处理显著高于1.6 mmol·L-1 GSH(P<0.05);‘探险家’和‘太行’在接种白粉菌3 d后,0.1 mmol·L-1 GSH处理的POD活性均高于1.6 mmol·L-1 GSH处理,分别是1.6 mmol·L-1 GSH处理的1.13倍和1.07倍;接种白粉菌7 d后,‘探险家’0.1 mmol·L-1 GSH处理的POD活性显著高于1.6 mmol·L-1 GSH处理(P<0.05),‘太行’0.1 mmol·L-1 GSH处理的POD活性高于1.6 mmol·L-1 GSH处理,是1.6 mmol·L-1 GSH处理的1.24倍。0.1 mmol·L-1 GSH处理下未接种白粉菌时(0 d)抗性品种‘太行’的POD活性高于感病品种‘探险家’,是‘探险家’的1.15倍;在白粉菌侵染初期(3 d),抗性品种‘太行’的POD活性低于感病品种‘探险家’,是‘探险家’的95%;白粉菌侵染7 d后,抗性品种‘太行’的POD活性高于感病品种‘探险家’,是‘探险家’的1.10倍。
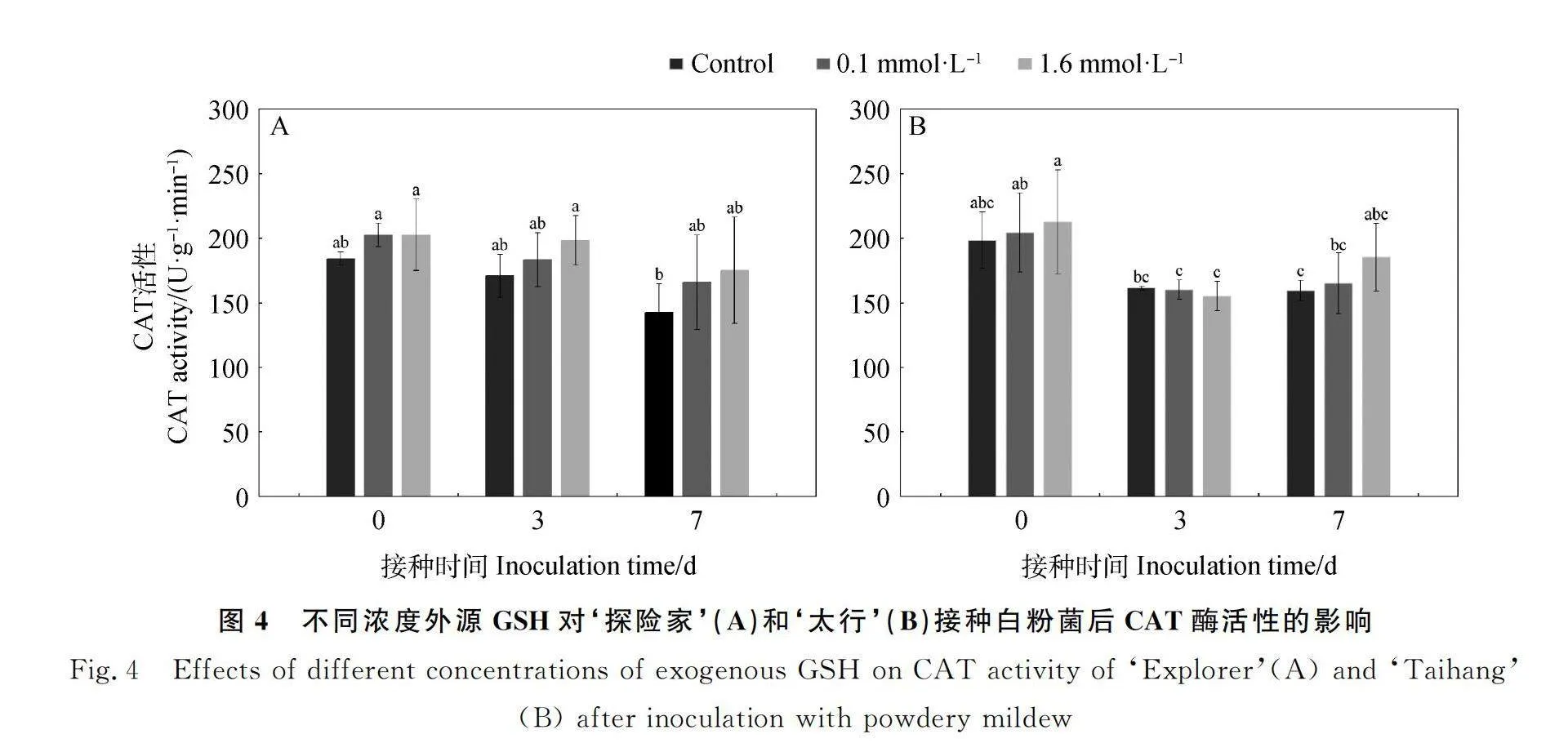
2.2.3 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后CAT活性的影响 如图4所示,随着接种时间的增加,对照处理下‘探险家’(图4A)CAT活性逐渐降低,在7 d最低,但各时间点无显著差异。0.1 mmol·L-1 GSH处理下,CAT活性在7 d时最低,但各时间点无显著差异;1.6 mmol·L-1 GSH处理下,CAT活性在7 d时最低,但各时间点无显著差异。对照处理下‘太行’(图4B)CAT活性逐渐降低,在7 d时最低;0.1 mmol·L-1 GSH处理下,CAT活性在3 d时最低;1.6 mmol·L-1 GSH处理下,CAT活性在3 d时最低。‘探险家’和‘太行’的CAT活性在未接种白粉菌(0 d)、接种白粉菌3 d和7 d后各处理间均无显著差异。0.1 mmol·L-1 GSH处理下未接种白粉菌时(0 d)抗性品种‘太行’的CAT活性高于感病品种‘探险家’,是‘探险家’的1.01倍;在白粉菌侵染初期(3 d)及7 d后,抗性品种‘太行’的CAT活性均低于感病品种‘探险家’,分别是‘探险家’的87%和99%。
2.3 外源GSH对草地早熟禾接种白粉菌后GSH含量及GSH代谢酶的影响
2.3.1 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后GSH含量的影响 如图5所示,随着接种时间的增加,对照处理下‘探险家’(图5A)GSH含量先升高后降低,在3 d时最高,但0 d,3 d和7 d之间无显著差异。0.1 mmol·L-1 GSH处理下,GSH含量在3 d时最高,且显著高于0 d(P<0.05);1.6 mmol·L-1 GSH处理下,GSH含量在各时间点无显著差异。对照处理下‘太行’(图5B)GSH含量逐渐升高,在0 d时最低,且与3 d和7 d无显著差异;0.1 mmol·L-1 GSH处理下,GSH含量在0 d时最高,且显著高于7 d(P<0.05),但与3 d无显著差异;1.6 mmol·L-1 GSH处理下,GSH含量在3 d最高,但在各时间点无显著差异。未接种白粉菌时(0 d)‘探险家’各处理间无显著差异,‘太行’1.6 mmol·L-1 GSH处理及对照的GSH含量均显著低于0.1 mmol·L-1 GSH处理;‘探险家’和‘太行’的GSH含量在接种白粉菌3 d和7 d后,0.1 mmol·L-1 GSH处理与1.6 mmol·L-1 GSH处理均无显著差异。0.1 mmol·L-1 GSH处理下未接种白粉菌时(0 d)抗性品种‘太行’的GSH含量高于感病品种‘探险家’,是‘探险家’的1.43倍;在白粉菌侵染初期(3 d)及7 d后,0.1 mmol·L-1 GSH处理下抗性品种‘太行’的GSH含量均低于感病品种‘探险家’,分别是‘探险家’的77%和76%。
2.3.2 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后GR活性的影响 如图6所示,随着接种时间的增加,对照处理下‘探险家’(图6A)GR活性在3 d时最低,显著低于0 d和7 d(P<0.05)。0.1 mmol·L-1 GSH处理下,GR活性在3 d时最高,显著高于0 d(P<0.05),与7 d时无显著差异;1.6 mmol·L-1 GSH处理下,GR活性3 d时最低,显著低于0 d(P<0.05),与7 d无显著差异。对照处理下mSgkI/xB9tJHEAf+syEkmqYmlg40GnF9F5jxW3DVtIA=‘太行’(图6B)GR活性先升高后降低,在3 d时最高,各时间点均无显著差异;0.1 mmol·L-1 GSH处理下,GR活性在0 d时最高,且显著高于3 d(P<0.05),但与7 d无显著差异;1.6 mmol·L-1 GSH处理下,GR活性在7 d时最低,但各时间点无显著差异。未接种白粉菌时(0 d)‘探险家’0.1 mmol·L-1 GSH处理的GR活性显著低于对照(P<0.05),与1.6 mmol·L-1 GSH处理无显著差异;‘太行’各处理间无显著差异;接种白粉菌3 d后,‘探险家’0.1 mmol·L-1 GSH处理的GR活性显著高于1.6 mmol·L-1 GSH处理(P<0.05),‘太行’0.1 mmol·L-1 GSH处理的GR活性与1.6 mmol·L-1 GSH处理无显著差异;‘探险家’和‘太行’在接种白粉菌7 d后,0.1 mmol·L-1 GSH处理的GR活性均显著高于1.6 mmol·L-1 GSH处理(P<0.05)。0.1 mmol·L-1GSH处理下未接种白粉菌时(0 d)抗性品种‘太行’的GR活性高于感病品种‘探险家’,是‘探险家’的2.66倍;在白粉菌侵染初期(3 d)及7 d后,抗性品种‘太行’的GR活性均低于感病品种‘探险家’,分别是‘探险家’的34%和75%。
2.3.3 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后GPX活性的影响 如图7所示,随着接种时间的增加,对照处理下‘探险家’(图7A)GPX活性在各时间点无显著差异。0.1 mmol·L-1 GSH处理下,GPX活性先升高后降低,在3 d时最高,显著高于0 d和7 d(P<0.05);1.6 mmol·L-1 GSH处理下,GPX活性3 d时最低,显著低于0 d和7 d(P<0.05)。对照处理下‘太行’(图7B)GPX活性先升高后降低,在3 d时最高,显著高于0 d(P<0.05),但与7 d之间无显著差异;0.1 mmol·L-1 GSH处理下,GPX活性在0 d时最高,且与3 d和7 d无显著差异;1.6 mmol·L-1 GSH处理下,GPX活性在3 d时最高,且与0 d和7 d无显著差异。未接种白粉菌时(0 d)‘探险家’各处理间无显著差异;‘太行’0.1 mmol·L-1处理的GPX活性显著高于对照及1.6 mmol·L-1 GSH处理(P<0.05);接种白粉菌3 d后,‘探险家’0.1 mmol·L-1 GSH处理的GPX活性显著高于1.6 mmol·L-1 GSH处理(P<0.05),‘太行’0.1 mmol·L-1 GSH处理的GPX活性高于1.6 mmol·L-1 GSH处理,是1.6 mmol·L-1 GSH处理的1.07倍;接种白粉菌7 d后,‘探险家’0.1 mmol·L-1 GSH处理的GPX活性显著高于1.6 mmol·L-1 GSH处理(P<0.05),‘太行’0.1 mmol·L-1 GSH处理的GPX活性高于1.6 mmol·L-1 GSH处理,是1.6 mmol·L-1 GSH处理的1.28倍。0.1 mmol·L-1 GSH处理下未接种白粉菌时(0 d)抗性品种‘太行’的GPX活性高于感病品种‘探险家’,是‘探险家’的2.21倍;在白粉菌侵染初期(3 d)及7 d后,抗性品种‘太行’的GPX活性低于感病品种‘探险家’,分别是‘探险家’的75%和88%。
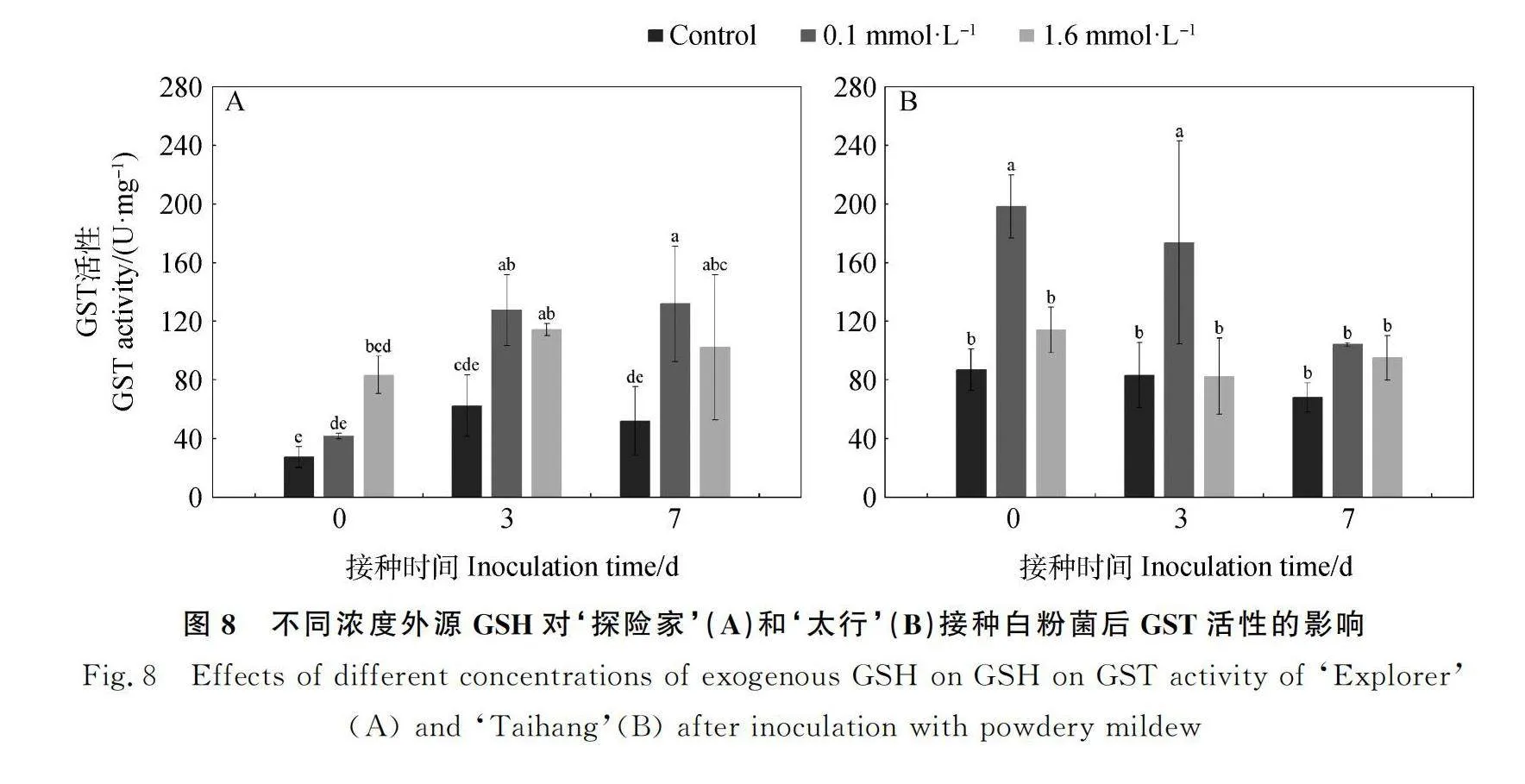
2.3.4 不同浓度外源GSH对‘探险家’和‘太行’接种白粉菌后GST活性的影响 如图8所示,随着接种时间的增加,对照处理下‘探险家’(图8A)GST活性在3 d最高,0 d最低,但各时间点无显著差异。0.1 mmol·L-1 GSH处理下,GST活性逐渐升高,在7 d时最高,显著高于0 d(P<0.05),与3 d无显著差异;1.6 mmol·L-1 GSH处理下,GST活性0 d时最低,各处理之间无显著差异。对照处理下‘太行’(图8B)GST活性在7 d时最低,但各时间点无显著差异;0.1 mmol·L-1 GSH处理下,GST活性在0 d最高,显著高于7 d(P<0.05),但与3 d无显著差异;1.6 mmol·L-1 GSH处理下,GST活性在3 d时最低,与0 d和7 d无显著差异。未接种白粉菌时(0 d)‘探险家’0.1 mmol·L-1处理的GST活性与对照及1.6 mmol·L-1 GSH处理无显著差异;‘太行’0.1 mmol·L-1处理的GST活性显著高于对照及1.6 mmol·L-1 GSH处理(P<0.05);接种白粉菌3 d后,‘探险家’0.1 mmol·L-1 GSH处理的GST活性高于1.6 mmol·L-1 GSH处理,是1.6 mmol·L-1 GSH处理的1.12倍,‘太行’的GST活性0.1 mmol·L-1 GSH处理显著高于1.6 mmol·L-1 GSH处理(P<0.05);‘探险家’和‘太行’在接种白粉菌7 d后,0.1 mmol·L-1 GSH处理的GST活性均高于1.6 mmol·L-1 GSH处理,分别是1.6 mmol·L-1 GSH处理的1.29倍和1.10倍。0.1 mmol·L-1 GSH处理下未接种白粉菌(0 d)和白粉菌侵染初期(3 d)时,抗性品种‘太行’的GST活性均高于感病品种‘探险家’,分别是‘探险家’的4.78倍和1.36倍。
3 讨论
SOD,POD和CAT是植物体内关键的抗氧化酶,能够降低细胞内活性氧自由基积累并缓解膜脂过氧化伤害[36],其活性水平反映了植物的抗逆性。SOD作为一种关键的抗氧化剂,具备显著清除超氧阴离子的能力,同时它还能有效地将这些超氧阴离子歧化为HO。POD和CAT可以清除HO[37-39],POD也是木质素合成的关键酶之一,各抗氧化酶相互协作共同参与植物的抗病过程。研究发现白粉菌侵染早期时(3 d),0.1 mmol·L-1 GSH处理的‘探险家’SOD活性显著降低,POD活性显著提高;0.1 mmol·L-1 GSH处理的‘太行’较清水对照而言SOD活性显著降低,POD活性升高。云兴福[40]研究发现,黄瓜对霜霉病的抗性与SOD活性呈负相关关系,与POD活性呈正相关关系;张伟丽等[41]研究发现不同抗性品种柱花草(Stylosanthes spp.)在接种胶胞炭疽菌[Colletotrichum gloeosporioides(Penz.)Penz. & Sacc]早期SOD活性与抗病性呈负相关关系,这与本研究结果相一致。此外,本研究还发现,白粉菌侵染早期,0.1 mmol·L-1 GSH处理较清水对照会显著降低两个材料的SOD活性,提高POD活性,且1.6 mmol·L-1 GSH处理对2个材料的SOD活性的降低程度和POD活性的提高程度均低于0.1 mmol·L-1 GSH处理,即低浓度GSH较高浓度GSH处理对草地早熟禾接种白粉病早期有更好的抗病效果,病情指数也反映了该情况,适宜浓度的GSH处理可以缓解胁迫,高浓度处理显著降低病情指数。吴夏雷等[42]研究发现不同浓度的外源GSH和GSSG对杉木体胚的成熟均表现出低浓度促进,高浓度抑制的作用。这可能是因为只有适宜浓度的GSH才会更好地在草地早熟禾抗白粉病相关防御中发挥有效作用。
在深入探讨SOD,POD和CAT三个抗氧化酶在草地早熟禾抗白粉病过程中的作用及其与施用外源GSH处理之间的关系后,我们进一步认识到,这些抗氧化酶活性的变化反映了植物自身的抗逆性,还可能与植物诱导抗病性的激活机制紧密相连。植物诱导抗病性是当前的研究热点之一,利用化学物质激活植物抗病基因,有利于加速抗性品种的选育,还能减轻农药过度使用带来的环境压力[43],GSH在抵抗各种逆境胁迫等方面都发挥着重要作用(重金属、干旱、盐胁迫、病菌侵染)[44-48]。本研究中0.1 mmol·L-1 GSH处理的‘探险家’在接种白粉菌后GPX活性在各时间点均显著高于清水对照,而1.6 mmol·L-1 GSH处理较对照无显著变化,0.1 mmol·L-1和1.6 mol·L-1 GSH处理的‘探险家’在接种后GST活性在各时间点均显著高于清水对照;‘太行’在接种白粉菌后在各时间点喷施外源GSH处理较清水对照GPX和GST活性明显提高,且0.1 mmol·L-1 GSH处理的GPX活性高于1.6 mmol·L-1 GSH处理。外源GSH处理提高了草地早熟禾接种白粉菌后的GPX和GST活性,且‘太行’和‘探险家’在0.1 mmol·L-1 GSH处理后提高幅度大于1.6 mmol·L-1 GSH处理,‘探险家’各浓度GSH处理下的病情指数也印证了这一情况。王丹等[48]研究发现在缺乏硫的条件下小白菜响应外源GSH处理过程中,随时间的推移GPX和GST活性持续上升,且GST活性始终高于清水处理;马立功等[49]通过转基因方法过表达HaGSTU1的转基因烟草叶片中GST及GPX活性显著提高,增强了对核盘菌(Sclerotinia sclerotiorum)的抗性;Li等[50]也研究发现在Cd胁迫下卷心菜的根和叶GPX与GST活性增加。这与本研究结果一致,外源GSH能有效提高植物在逆境胁迫后的GPX和GST活性,与抗氧化酶相互作用,缓解因胁迫产生的生理紊乱,提高植物抗性。
4 结论
本研究以不同抗性品种草地早熟禾为材料,通过测定喷施外源GSH后的生理生化指标,发现草地早熟禾受白粉菌侵染早期,SOD酶活性与抗病性呈负相关关系,POD酶活性与抗病性呈正相关关系;喷施外源GSH能够增加草地早熟禾的GPX和GST活性;0.1 mmol·L-1 GSH能够提高草地早熟禾对白粉病的抗性,1.6 mmol·L-1 GSH处理未能增强草地早熟禾对白粉病的抗性,为利用外源GSH提高草地早熟禾对白粉病的抗性提供了理论依据和参考。
参考文献
[1]王永玲,闫浩. 草地早熟禾冠锈病综合治理[J]. 中国林副特产,2009(4):35-36
[2]陈国亮. 草坪草锈病、白粉病在天水地区的发生与防治对策[J]. 农业科技与信息,2012(15):19-20
[3]叶文兴,张胜男,刘雪婷. 12个草地早熟禾品种幼苗耐盐性分析[J]. 草地学报,2023,31(9):2740-2747
[4]古丽君,徐秉良,李彬,等. 草坪禾草根腐病病原菌生物学特性研究[J]. 草业学报,2012,21(3):93-98
[5]HANLIN R T,AMANO K. Host range and geographical distribution of the powdery mildew fungi[J]. Mycologia,1986,82(4):533
[6]NASERI B,SHEIKHOLESLAMI M. Progression of powdery mildew in susceptible-resistant wheat (Triticum aestivum) cultivars sown at different dates[J]. Journal of Phytopathology,2021,169(10):640-647
[7]CENCI A,DOVIDIO R,TANZARELLA O A,et al. Identification of molecular markers linked to Pm13,an Aegilops longissima gene conferring resistance to powdery mildew in wheat[J]. Theoretical and Applied Genetics,1999(98):448-454
[8]朱琨,金忠民,张军,等. 外源激素对草地早熟禾抗白粉病、叶表结构、光合特性的影响[J]. 草地学报,2023,31(8):2417-2424
[9]梁银萍,许志宇,吴凡,等. 山西省草地早熟禾白粉菌分离株BGP(TG)的鉴定及致病力分析[J]. 微生物学通报,2023,50(10):4389-4400
[10]张会茹. 草坪白粉病的诊断及防治[J]. 农技服务,2008,25(12):72-73
[11]FENG P,ZHANG X,GODANA E A,et al. Control of postharvest soft rot of green peppers by Bacillus subtilis through regulating ROS metabolism[J]. Physiological and Molecular Plant Pathology,2024(131):102280
[12]WANG N,FAN X,HE M,et al. Transcriptional repression of TaNOX10 by TaWRKY19 compromises ROS generation and enhances wheat susceptibility to stripe rust[J]. The Plant Cell,2022,34(5):1784-1803
[13]GILL S S,TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930
[14]HOSSAIN M S,SOHAG M M H,FARDUS J,et al. Acetate alleviates As toxicity via improving ROS metabolism and antioxidant defense system in lentil seedlings[J]. Plant Stress,2023(9):100190
[15]WANG H,CHEN Z,LIU G,et al. Alterations of growth,antioxidant system and gene expression in Stylosanthes guianensis during Colletotrichum gloeosporioides infection[J]. Plant Physiology and Biochemistry,2017(118):256-266
[16]RESENDE R S,RODRIGUES F A,CAVATTE P C,et al. Leaf gas exchange and oxidative stress in sorghum plants supplied with silicon and infected by Colletotrichum sublineolum[J]. Phytopathology,2012,102(9):892-898
[17]POLANCO L R,RODRIGUES F A,NASCIMENTO K J T,et al. Photosynthetic gas exchange and antioxidative system in common bean plants infected by Colletotrichum lindemuthianum and supplied with silicon[J]. Tropical Plant Pathology,2014(39):35-42
[18]CHRISTINE H F,GRAHAM N. Ascorbate and glutathione:the heart of the redox hub[J]. Plant Physiology,2011,155(1):2-18
[19]ASTHIR B,KAUR G,KAUR B. Convergence of pathways towards ascorbate-glutathione for stress mitigation[J]. Journal of Plant Biology,2020,63(5):243-257
[20]YIN L,JEROEN H,TJAKKO A,et al. Glutathione protects Lactococcus lactis against oxidative stress[J]. Applied and Environmental Microbiology,2003,69(10):5739-5745
[21]米春娇,洪流,马馼,等. 谷胱甘肽引发对老化燕麦种子发芽与幼苗生长特性的影响[J]. 草地学报,2024,32(3):928-934
[22]MAY M J,VERNOUX T,LEAVER C,et al. Glutathione homeostasis in plants:implications for environmental sensing and plant development[J]. Journal of Experimental Botany,1998,49(321):649-667
[23]陈坤明,宫海军,王锁民. 植物谷胱甘肽代谢与环境胁迫[J]. 西北植物学报菌物研究,2004,24(6):1119-1130
[24]PASSAIA G,MARGIS-PINHEIRO M. Glutathione peroxidases as redox sensor proteins in plant cells[J]. Plant Science,2015(234):22-26
[25]CNUBBEN N H,RIETJENS I M,WORTELBOER H,et al. The interplay of glutathione-related processes in antioxidant defense[J]. Environmental Toxicology and Pharmacology,2001,10(4):141-152
[26]CHONGCHONG L,YANKE J,YINGZHE Y,et al. Glutathione and neodiosmin feedback sustain plant immunity[J]. Journal of Experimental Botany,2022,74(3):976-990
[27]KUNSTLER A,KATAY G,GULLNER G,et al. Artificial elevation of glutathione contents in salicylic acid-deficient tobacco (Nicotiana tabacum cv.Xanthi NahG) reduces susceptibility to the powdery mildew pathogen Euoidium longipes[J]. Plant Biology,2020,22(1):70-80
[28]OTULAK K,KOZIEL E,PRZEWODWSKI W,et al. Glutathione Modulation in PVYNTN susceptible and resistant potato plant interactions[J]. International Journal of Molecular Sciences,2022,23(7):3797
[29]WANG Q,GUO J,JIN P,et al. Glutathione S-transferase interactions enhance wheat resistance to powdery mildew but not wheat stripe rust[J]. Plant Physiology,2022,190(2):1418-1439
[30]JAHNOVA J,CINCALOVA L,SEDLAROVA M,et al. Differential modulation of S-nitrosoglutathione reductase and reactive nitrogen species in wild and cultivated tomato genotypes during development and powdery mildew infection[J]. Plant Physiology and Biochemistry,2020(155):297-310
[31]梁银萍,许志宇,孙小涵,等. 白粉菌BGP(TG)在不同抗性草地早熟禾叶片上的侵染过程观察[J]. 微生物学通报,2023,50(11):4839-4851
[32]梁银萍,常小丽,张敏,等. 小麦L699叶片受白粉菌胁迫后蛋白质的差异表达[J]. 麦类作物学报,2016,36(4):460-464
[33]董文科. 草地早熟禾抗白粉病机理研究[D]. 兰州:甘肃农业大学,2020:29
[34]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:211-217
[35]孔祥生. 植物生理学实验指导技术[M]. 北京:中国农业出版社,2008:129-131
[36]惠竹梅,王智真,胡勇,等. 24-表油菜素内酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响[J]. 中国农业科学,2013,46(5):1005-1013
[37]SAIBI W,FEKI K,BEN MAHMOUD R,et al. Durum wheat dehydrin (DHN-5) confers salinity tolerance to transgenic Arabidopsis plants through the regulation of proline metabolism and ROS scavenging system[J]. Planta,2015,242(5):1187-1194
[38]KOCSY G,PAL M,SOLTESZ A,et al. Low temperature and oxidative stress in cereals[J]. Acta Agronomica Hungarica,2011,59(2):169-189
[39]于力,郭世荣,阎君,等. 亚精胺诱导黄瓜幼苗对白粉病抗性的研究[J]. 西北植物学报,2012,32(7):1384-1389
[40]云兴福. 黄瓜组织中氨基酸、糖和叶绿素含量与其对霜霉病抗性的关系[J]. 华北农学报,1993(4):52-58
[41]张伟丽,郭振飞. 不同抗性品种柱花草接种炭疽菌后CAT、SOD活性及HO、胼胝质含量的变化[J]. 扬州大学学报(农业与生命科学版),2007(2):73-77,94
[42]吴夏雷,孙宇涵,胡瑞阳,等. 不同植物生长调节剂添加处理对杉木体胚成熟的影响[J]. 分子植物育种,2019,17(6):2035-2041
[43]李小玲,刘长命,刘炼红,等. 外源亚精胺对甜瓜幼苗白粉病抗性的影响[J]. 西北植物学报,2015,35(9):1800-1807
[44]陈镔,谭淑端,董方旭,等. 重金属对植物的毒害及植物对其毒害的解毒机制[J]. 江苏农业科学,2019,47(4):34-38
[45]董守坤,马玉玲,李爽,等. 干旱胁迫及复水对大豆抗坏血酸-谷胱甘肽循环的影响[J]. 东北农业大学学报,2018,49(1):10-18
[46]单长卷,代海芳. 外源谷胱甘肽对干旱胁迫下玉米幼苗叶片生理特性的影响[J]. 灌溉排水学报,2016,35(1):59-62
[47]何超超. 外源谷胱甘肽对小白菜硫代葡萄糖苷生物合成影响的初步研究[D]. 杭州:浙江农林大学,2018:3-14
[48]王丹,汪宽鸿,杨静,等. 外源谷胱甘肽喷施对缺硫胁迫下小白菜谷胱甘肽代谢的影响[J]. 植物营养与肥料学报,2021,27(3):511-519
[49]马立功,孟庆林,张匀华,等. 向日葵谷胱甘肽-S-转移酶基因的克隆及抗病功能研究[J]. 中国油料作物学报,2015,37(5):635-643
[50]LI Y,ZHANG L J. Advances in the research on the AsA-GSH cycle in horticultural crops[J]. Frontiers of Agriculture in China,2010,4(4):84-90
(责任编辑 闵芝智)
